竹节参的化学成分、药理作用及质量标志物(Q-Marker)预测分析
周 静,付先芸,蔡三金,袁 丁,梅志刚,冯知涛*
竹节参的化学成分、药理作用及质量标志物(Q-Marker)预测分析
周 静1,付先芸1,蔡三金1,袁 丁1,梅志刚2*,冯知涛1*
1. 三峡大学医学院,国家中医药管理局中药药理科研三级实验室,湖北 宜昌 443002 2. 湖南中医药大学 中西医结合心脑疾病防治湖南省重点实验室,湖南 长沙 410208
竹节参为五加科人参属植物,在我国主要分布于湖北、云南、贵州及四川等地,以湖北恩施分布最为丰富。因其既具有人参的补益作用又具三七的活血作用,常被作为民族药用于治疗跌打损伤、关节炎以及虚劳等气虚血瘀证。竹节参主要化学成分为皂苷类、糖类、氨基酸类、挥发油类、核苷类及无机盐类。研究显示,竹节参具有抗疲劳、保肝、镇静、保护心脑血管、免疫调节、抗肿瘤、抗衰老及抗炎等药理作用。对国内外关于竹节参的化学成分、药理作用的研究进展进行综述,并对其质量标志物(quality marker,Q-Marker)进行预测分析,越南参皂苷R1、越南参皂苷R2、竹节参皂苷Ⅳa和竹节参皂苷Ⅴ等化合物可作为竹节参的主要Q-Marker,为竹节参质量评价体系的建立提供依据和相关新药研发提供参考。
竹节参;质量标志物;越南参皂苷R1;越南参皂苷R2;竹节参皂苷Ⅳa;竹节参皂苷Ⅴ;竹节参多糖;竹节参总皂苷;心脑血管系统调节;免疫调节;抗炎
竹节参C. A. Mey.是五加科人参属多年生草本植物,其药用部位为干燥根茎,其味甘、微苦,性温,具有散瘀止血、消肿止痛、祛痰止咳、补虚强壮之功,兼具人参益气补虚与三七的散瘀止血之功,临床常用于治疗气虚血瘀之跌打损伤、风湿性关节炎、咳嗽痰多、病后虚劳等[1]。研究表明,竹节参主要化学成分为皂苷类、糖类、氨基酸类、挥发油类、核苷类及无机盐类等,具有抗溃疡、保肝、促进胃肠蠕动、镇静、抗惊厥、抗疲劳、调血脂、改善神经网络功能、保护心脑血管、免疫调节、镇痛、抗炎、抗肿瘤、抗衰老等作用。众所周知,中药的品种产地、采收贮藏及炮制加工等因素均会影响竹节参的化学成分构成以及药理药效的发挥,故建立一套完整的竹节参质量标志物(quality marker,Q-Marker)体系,有助于提升竹节参中药及产品质量,增强临床疗效,促进竹节参产业健康稳定发展。本文对竹节参的化学成分及其药理作用进行综述,并根据Q-Marker概念,从亲缘学及化学成分特有性、传统药效、传统药性、化学成分可预测性、不同加工方法的影响等诸方面对竹节参的Q-Marker进行预测分析,为竹节参的质量评价和相关产品研发提供科学依据。
1 化学成分
竹节参的用药部位主要为根茎,目前研究表明竹节参的化学成分主要分为6大类,包含皂苷类、糖类、氨基酸类、挥发油类、核苷类及无机盐类等[2-4]。
1.1 皂苷类
竹节参中含有丰富的皂苷类化合物。竹节参皂苷包含三萜皂苷和甾醇型皂苷,其中的三萜皂苷很大程度上决定了竹节参的药理活性。三萜皂苷分为齐墩果烷型、达玛烷型和奥寇梯隆型,迄今已有111个三萜皂苷类成分从竹节参中提取分离[5]。
1.1.1 齐墩果烷型三萜皂苷 齐墩果烷型是竹节参皂苷中含量最多的成分,质量分数约为90.5%,是竹节参的主要有效成分之一,皆属于五环三萜类皂苷[4]。其中竹节参皂苷Ⅳa、Ⅴ的含量最高[6-7]。部分齐墩果烷型三萜皂苷的化学结构见图1。
1.1.2 达玛烷型三萜皂苷 竹节参中所含四环三萜型皂苷以达玛烷型皂苷研究较多,且较深入[2,5]。达玛烷型皂苷根据C-6位基团的不同可分为原人参二醇型和原人参三醇型。20()-原人参二醇型包含竹节参皂苷Ⅰa、Ⅲ、Ⅵ、Ⅶ、FK6,人参皂苷Rb1、Rb3、Rc、Rd,三七皂苷Fe和七叶胆皂苷ⅩⅦ;20()-原人参三醇型包含人参皂苷Re、Rg1、Rg2、Rh1,三七皂苷R1、R2。部分达玛烷型三萜皂苷的化学结构见图2。
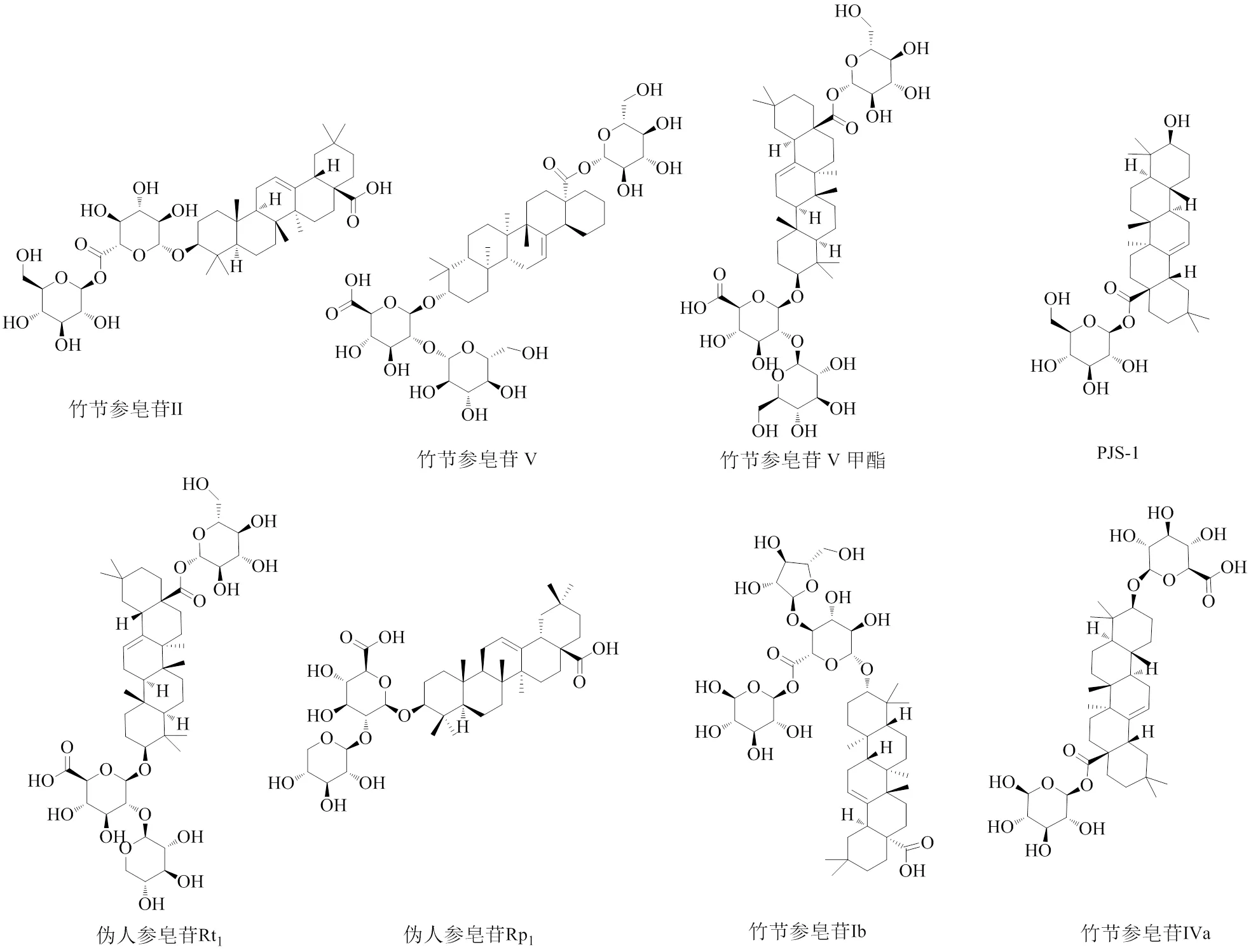
图1 竹节参中齐墩果烷型三萜皂苷的化学结构
1.1.3 奥寇梯隆型三萜皂苷 竹节参中奥寇梯隆型三萜皂苷质量分数为1.8%[8],伪人参皂苷F11是此型皂苷中最具有代表性的皂苷成分。部分奥寇梯隆型三萜皂苷的化学结构见图3。

图3 竹节参中奥寇梯隆型三萜皂苷的化学结构
1.2 糖类
竹节参总糖量约为41.51%,包含了多糖(18.33%)、低聚糖(19.98%)及还原糖(3.2%)[9]。通过蒽酮硫酸法和苯酚硫酸法来测定湖北恩施产竹节参中的竹节参多糖(polysaccharides of,PSPJ)的质量分数分别为14.18%、10.89%[10]。
1.3 氨基酸类
研究表明,竹节参含有16种氨基酸[11],质量分数为13.704%。这16种氨基酸均在人参属的4种植物中均能检测到,相比人参、三七和西洋参,竹节参中含量是最高的。在这些氨基酸中,竹节参的人体必需氨基酸质量分数为4.777%,也在这4种人参属中药中含量最高,为总氨基酸的34.89%。此外,竹节参所含的酸性及中性氨基酸也较其他3种药物高。
1.4 挥发油类
竹节参中挥发油质量分数约为0.016%[2]。通过对贵州竹节参与湖北竹节参精油的共同成分进行鉴定与检测,质量分数最高的是湖北竹节参中的正己酸(13.92%),而不同成分中,质量分数最高的为黔竹节参中的3-甲基丁酸(9.56%)。
1.5 核苷类
竹节参中尿嘧啶、胸嘧啶、尿苷、鸟苷、胸苷、腺苷、肌苷和胞苷8种核苷类物质已被分离出来。伍红年等[12]使用HPLC法对竹节参中的核苷成分进行了测定,发现7种核苷(脱氧尿苷、肌苷、鸟苷、尿苷、次黄嘌呤、腺苷和胸腺嘧啶核苷)成分,且在各自测定的浓度范围内线性关系良好,其对评价竹节参的质量具有参考意义。
1.6 无机盐类
竹节参中检测到15种无机元素,其中含有6种人体必须微量元素(锌、铜、铁、锰、钒、镍),其质量分数为0.309 74 mg/g;3种人体必须宏量元素(钙、镁、磷),其质量分数为16.185 7 mg/g[13]。
2 药理作用
2.1 抗疲劳作用
竹节参中起抗疲劳作用的化学物质主要为PSPJ与竹节参总皂苷(total saponins of,TSPJ)。TSPJ与PSPJ均能显著延长小鼠游泳时间,其机制可能为TSPJ与PSPJ能减少运动后血清中的血乳酸及尿素氮含量,提高小鼠体内的肝糖元含量[14-15]。
2.2 对消化系统的作用
2.2.1 修复溃疡及胃黏膜保护作用 TSPJ对葡聚糖硫酸钠诱导的溃疡性结肠炎起到修复与保护的作用,其机制可能与提高过氧化物酶增殖物激活受体-γ的表达,降低促炎因子白细胞介素(interleukin,IL)- 1β、IL-17、γ干扰素(interferon-γ,IFN-γ)的释放,提升IL-10水平有关[16]。TSPJ中已明确的能够修复小鼠溃疡、保护胃黏膜的物质为竹节参皂苷Ⅲ、齐墩果酸寡糖苷[17]。
2.2.2 保肝作用 肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-1β、IL-6等炎症介质的产生促进了酒精性肝损伤的发展,竹节参能降低小鼠血清IL-1β、IL-6水平从而抑制酒精性肝损伤的进展[18]。TSPJ可能通过微小核糖核酸miR-199-5p/肝细胞生长因子及其受体细胞间质上皮转换因子(hepatocyte growth factor-cellular-mesenchymal epithelial transition factor,HGF-c-Met)信号通路和微小核糖核酸miR-34a/沉默信息调节因子1(miR-34a/silent information regulator 1,SIRT1)途径有效改善肝细胞脂肪变性[19-20]。TSPJ能对氯化镉、异烟肼、利福平及乙酰氨基酚等诱导的肝损伤发挥显著的保护作用,药效物质可能主要为竹节参皂苷Ⅳa,作用机制可能与降低丙烯醇毒性,进而抑制肝损伤有关。TSPJ中的齐墩果烷型皂苷相对于达玛烷型三萜皂苷保肝作用更强[21]。
2.2.3 促胃肠动力作用 TSPJ中的齐墩果酸低聚糖苷衍生物能加快食物通过胃肠道的速度,还能减缓小鼠胃排空速度。此外,TSPJ还能抑制胰脂肪酶的活性,调节自主神经系统以延迟食物中的脂肪在肠内吸收的时间,加快食物通过胃肠道的速度,从而使体质量下降[22-23]。当药效成分中有3--单糖链配糖体或28-羧基基团时,其抑制作用加强[24]。因此,TSPJ有望成为肥胖的治疗药物。
2.3 对中枢神经系统的作用
2.3.1 镇静作用 ip给予小鼠TSPJ(100 mg/kg)85~95 min以及TSPJ(200 mg/kg)25~35 min均能起到较为显著的镇静作用,TSPJ能够协同戊巴比妥和硫贲妥钠使小鼠催眠时间有效延长[25]。
2.3.2 抗惊厥作用 TSPJ能有效对抗戊四氮引起的惊厥,其引起惊厥涉及的脑部结构为脑干和大脑[26],但不能对抗士的宁和印防己引起的小鼠惊厥,可能是由于这2种化学物质作用的部位不在脑干和大脑[25]。
2.3.3 改善神经功能作用 竹节参中的达玛烷型三萜皂苷(主要为人参皂苷Rb1、Rg1[4])能促进神经突触生长和增强胆碱功能,从而起到改善学习记忆功能的作用。此外,人参皂苷Rg1、Rg3、Re均能明显降低动物脑内的淀粉状β-蛋白沉积含量,从而改善记忆缺陷[27]。
2.4 对心脑血管系统的作用
2.4.1 调血脂 竹节参中起调血脂作用的化学物质主要为TSPJ和PSPJ,并存在一定的量效关系[28-29]。将竹节参皂苷Ⅴ、伪人参皂苷RT1、竹节参皂苷Ⅳ、竹节参皂苷Ⅳa及这4种皂苷组合物作用于急性高脂血症小鼠模型,观察调血脂作用疗效,发现4种皂苷成分组合物的调脂活性优于各竹节参皂苷单体化合物和TSPJ,竹节参皂苷Ⅴ、伪人参皂苷RT1、竹节参皂苷Ⅳ、竹节参皂苷Ⅳa,按2∶1∶1∶1比例组合物的调脂作用最为显著,按照此配比组合的竹节参皂苷组合物作用于急性高脂血症小鼠,其效果优于TSPJ[30]。
2.4.2 保护缺血损伤 TSPJ对心肌梗死大鼠具有良好的心脏保护作用,其机制可能是TSPJ能显著增强心肌Ca2+-ATPase与Na+, K+-ATPase的活力,抑制核因子-κB(nuclear factor kappa B,NF-κB)、细胞外调节蛋白激酶1/2和p38丝裂原活化蛋白激酶通路的激活,促进腺苷酸活化蛋白激酶/雷帕霉素靶蛋白/Unc-51样激酶1通路表达[31],增加SIRT1的表达,进而减轻心肌损伤和心肌细胞死亡[32]。TSPJ中去葡萄糖基竹节参皂苷Ⅳa为保护急性心肌缺血的主要化学物质[33]。
TSPJ可能通过抑制自噬的过度激活,从而减轻脑缺血再灌注损伤的发生[34]。抑制一氧化氮合酶和诱导型一氧化氮合酶的过度表达改善局灶性脑缺血再灌注损伤大鼠的脑损伤,抗氧化应激,改善毛细血管通透性,减轻脑缺血再灌注损伤[35-36]。
2.4.3 抗血栓 研究显示,PSPJ能显著抑制人源和血瘀证大鼠血小板的聚集,升高组织型纤维溶酶激活剂、6-酮前列腺素F1α的含量,降低大鼠体内血栓素B2、纤溶酶原激活物抑制因子的含量,发挥较强的抗血栓活性作用[37]。对6种人参属药材进行体外抗凝血活性差异进行分析研究,发现人参皂苷Rb2能有效延长凝血酶原时间,其药效与含量呈正相关[38]。通过研究竹节参根与茎叶,发现这些部位所含的TSPJ均有极显著的抗血栓作用[39]。从竹节参根茎中获取到的70%甲醇提取物,主要化学成分为竹节参皂苷Ⅲ、Ⅳ、Ⅴ,对纤溶系统的激活具有良好的促进作用,能够促进纤维蛋白的溶解,从而发挥抗血栓的作用[40]。
2.4.4 止血 《中国药典》中明确记载竹节参具有其同属药材类似的止血功效[1],多用于治疗吐血、倒经及功能性子宫出血,但目前尚缺乏对竹节参止血功效活性成分相关的基础研究。
2.5 镇痛作用
PSPJ与TSPJ均能够提高小鼠痛阈值和扭体反应次数,镇痛作用接近于非甾体抗炎药,是竹节参发挥镇痛作用的主要活性成分[41-42]。
2.6 免疫调节作用
在免疫功能亢进时竹节参可抑制免疫系统,减少功能亢进对自身造成的损伤,在免疫功能低下时能提高免疫系统的功能,故其具有双向调节作用[43]。目前已证实PSPJ、TSPJ对免疫作用的调节。PSPJ能调节淋巴细胞、吞噬细胞功能及IL、抗体水平功能,升高血清中IL-2和IFN-γ在机体中的含量[44]。以TSPJ为主要成分的复方竹节参片,能显著增强T细胞增殖效应、淋巴细胞转化率,提高脾指数与胸腺指数[45]。TSPJ和PSPJ的联合使用作用于免疫低下的小鼠,其对小鼠免疫系统的改善效果优于2种物质单独使用[46]。
2.7 抗肿瘤作用
现已证实竹节参中发挥抗肿瘤作用的活性物质为TSPJ、PSPJ以及人参皂苷Rg3[47]。TSPJ能抑制移植性S180小鼠肉瘤的生长发育,从而增加模型动物的生存时间[48-49]。TSPJ可增加顺铂耐药肺癌细胞的敏感性,其作用机制可能与抑制耐药相关蛋白多药耐药基因、P-糖蛋白和丝氨酸/苏氨酸激酶活性相关[50]。TSPJ能增加CD3+和CD4+免疫细胞数量,减少CD8+数量,降低血清中炎症因子水平从而有效抑制肿瘤生长,其作用机制可能与抑制toll样受体4(toll-like receptor 4,TRL4)/NF-κB信号通路表达有关[51]。
2.8 抗衰老作用
目前已知,衰老与炎症反应关系密切,后者与氧化应激、自噬及小胶质细胞活化密不可分。研究显示,TSPJ可能通过抑制丝裂原活化蛋白激酶、NF-κB信号通路、内质网应激、促进自噬恢复使衰老大脑中促炎细胞因子(如IL-1β和TNF-α)和炎症介质(如环氧化物酶-2和诱导型一氧化氮合成酶)的产生减少和显著抑制小胶质细胞的激活从而起抗衰老作用[52-54]。TSPJ能改善神经元损伤,减少氧化应激反应和抑制凋亡,最终改善脑衰老的认知功能,还可能与核因子E2相关因子2和SIRT1介导的抗氧化信号通路有关[55]。
2.9 抗炎作用
竹节参中目前已知的抗炎物质主要为TSPJ。刘玉萍等[56]将小鼠分为对照组、模型组、雷公藤多苷组、TSPJ高、中、低剂量组,结果显示高、中、低TSPJ不仅能有效抑制大鼠的原发性炎症,也明显地抑制佐剂关节炎大鼠的继发性炎症,中、高剂量的治疗效果优于雷公藤多苷,其机制可能与TSPJ减少炎性细胞浸润有关。进一步研究显示,TSPJ抗炎作用主要表现为抑制毛细血管通透性增强、抑制炎性肿胀,调控一氧化氮释放,降低诱导型一氧化氮合成酶、TNF-α和IL-1β的表达;还可能与减少炎症部位自由基产生、减少脂质过氧化反应有关[57-58]。
2.10 降糖作用
竹节参所含齐墩果烷型三萜皂苷有较强的降血糖作用[1],起作用的物质可能是竹节参皂苷V、竹节参皂苷Ⅳ、竹节参皂苷Ⅳa、伪人参皂苷RT1。
3 竹节参Q-Marker预测分析
中药的有效成分受品种、栽培种植及产地生态条件、采收加工、炮制加工、运输贮藏条件、提取纯化、药物传输途径、复方及各成分之间交互作用等多种因素的影响,为提升中药及其相关产品的质量标准,刘昌孝院士[59]提出了中药Q-Marker概念,即存在于中药材和中药产品(如中药饮片、中药煎剂、中药提取物、中成药制剂)中固有的或加工制备过程中形成的、与中药的功能属性密切相关的化学物质。笔者依据Q-Marker的基本条件,对竹节参的Q-Marker进行初步预测。
3.1 竹节参与亲缘性及化学成分特有性相关的Q-Marker预测
竹节参是人参属植物,与人参、假人参和三七同属,是同属植物中分布最广泛的植物,主要分布于北美、中亚和东亚。人参属植物有6种3变种,在我国有4种。我国人参属植物的分布情况为人参主要分布在中国东北地区;假人参主要分布于喜马拉雅山与西藏地区;竹节参主要分布江西省及中国北侧陕西秦岭、湖北鄂西地区;三七主要分布于云南和四川地区[60]。竹节参中含有多种化学成分,包含皂苷类、糖类、氨基酸类、挥发油类、核苷类及无机盐类,其中皂苷类成分主要是三萜类皂苷,被认为是竹节参的主要有效成分及主要次生代谢产物,同时也是目前研究最多的化学成分。目前已经分离出111个三萜类皂苷,其是人参属植物的重要化学标志物。采用HPLC测定湖北五峰、湖北恩施及四川峨眉山3个产地的三萜苷元齐墩果酸含量,发现各产地含量差异较大[7]。三萜类化合物的合成途径可能为甲羟戊酸形成异戊烯焦磷酸和二甲基丙烯基二磷酸盐,再通过异戊烯焦磷酸与二甲基丙烯基二磷酸盐结合形成异戊二烯,最后异戊二烯通过成环形成三萜类化合物。竹节参中含有的四环三萜皂苷与五环三萜皂苷都属于三萜类皂苷合成途径的下游成分,具有较强的特异性。人参属植物具有系统分类价值的三萜皂苷类成分有达玛烷型、齐墩果烷型、奥寇梯隆型。其中达玛烷型三萜皂苷是人参属植物典型的三萜皂苷类化合物。根据三萜皂苷不同结构类型的化合物在竹节参的不同种群中的分布差异性,种群之间的亲缘关系及进化状况可以被大致推测出。三七、人参和引进的西洋参主要含四环三萜皂苷,是人参属植物中最古老类群,而竹节参主要含有五环三萜皂苷,是比较进化的类群[61]。因此,初步筛选五环三萜皂苷类成分可作为竹节参的Q-Marker之一。
3.2 竹节参与传统功效相关的Q-Marker预测
中药功效是中医临床组方遣药的重要凭据,故其也是中药Q-Marker分析的重要依归。竹节参的传统功效主治为散瘀止血、消肿止痛、祛痰止咳、补虚强壮等[1]。现代药理研究表明,TSPJ具有抗溃疡、保肝(药效成分主要为竹节参皂苷Ⅳa)、调控胃肠蠕动力、镇静、镇痛、抗惊厥、改善学习记忆功能(药效成分主要为人参皂苷Rb、Rg1)、抗疲劳、保护缺血再灌注损伤(药效成分主要为去糖基竹节参皂苷Ⅳ)、促纤维蛋白溶解(药效成分主要为竹节参皂苷Ⅱ、Ⅳ、Ⅴ)、抗炎、调节免疫系统、延缓衰老(药效成分主要为竹节参皂苷Ⅳa)及抗肿瘤的功效。
研究表明,竹节参“活血散瘀”功效主要表现为能促进纤维蛋白溶解[40],进而发挥抗血栓的作用[41]。起促纤维蛋白溶解作用的物质主要是竹节参皂苷Ⅲ、Ⅳ、Ⅴ[40]。而竹节参“止痛”作用的化学物质基础则主要为PSPJ和TSPJ[14,41]。另外,竹节参的“消肿”作用与“抗炎”作用密切相关,物质基础除PSPJ外,还有TSPJ[63-64]。TSPJ中起镇痛作用的化合物主要为齐墩果烷型皂苷,其机制可能为TSPJ能降低炎症小鼠血清中IL-1和TNF-α水平[65]。综上所述,竹节参总皂苷中的竹节参皂苷Ⅲ、Ⅳ、Ⅴ、TSPJ、PSPJ与传统功效相符合,是竹节参传统功效的物质基础,可作为竹节参Q-Marker分析的重要参考依据。
3.3 竹节参与药性相关的Q-Marker预测
中药的性味归经是传统中医药的基本属性之一,是中药的特有属性,反映了中药的本质特征,也是临证治法及遣药组方的重要依据。竹节参味甘、微苦,性温,归肝、脾、肺经[1]。甘味药主要归肝、脾、肺、胃,苦味药主要归肝、肺、胃,这与竹节参的归经是相符的。甘味药的化学成分以糖类、蛋白质、氨基酸为主,其次为苷类[66]。因此,竹节参中甘味的物质基础主要为PSPJ、TSPJ和氨基酸。构成苦味的化学物质大致归为生物碱、苷类、挥发油及苦味质[67-68]。此外,苦味药大多具有抗炎、抗肿瘤、镇痛的现代药理作用[69],与竹节参的现代药理作用是相符的。故竹节参中的皂苷、核苷及挥发油类物质为竹节参表现出微苦性能的物质基础。
根据以上分析可知竹节参中多糖、皂苷、氨基酸类化学成分应为味甘的物质基础;皂苷、核苷和挥发油类化学成分为味苦的物质基础。故可将TSPJ、PSPJ、核苷、多糖、挥发油和氨基酸作为竹节参Q-Marker分析的重要参考依据。
3.4 竹节参与化学成分可测性相关的Q-Marker预测

皂苷类物质是竹节参的主要药效基础,故伪人参皂苷RT1、人参皂苷Rc、人参皂苷Rb2、竹节参皂苷Ⅳ、竹节参皂苷Ⅳa、竹节参皂苷Ⅴ、人参皂苷Re、人参皂苷Ro、人参皂苷Rb1及人参皂苷Rg1均可能作为竹节参Q-Marker的重要参考依据。
3.5 竹节参与入血化学成分相关的Q-Marker预测
中药药效作用的发挥与其入血化学成分密切相关。通过研究竹节参及竹节参复方在体内的代谢过程,基于化合物-靶点-通路分析竹节参复方显效方式,已初步筛选出竹节参的多种入血药效成分[78]。
通过对小鼠ig藤珠胃康颗粒,从小鼠的眼眶静脉丛采血,发现人参皂苷Re、Ro、Rb1和竹节参皂苷Ⅳa 4种成分均能在大鼠体内实现一次吸收及二次吸收[79]。此外,使用超高效液相色谱-质谱分析竹节参同属植物西洋参提取物中入血的化合物,鉴定出8个原型化合物,这8个化合物都存在于竹节参中,分别为人参皂苷Rb1、Rc、Rd、Rb3及七叶胆苷ⅩⅦ、伪人参皂苷F11[80]。同时,笔者还利用网络药理学技术进行了化合物-靶点-通路图研究,发现越南参皂苷R1、R2和竹节参皂苷Ⅳa 3种入血成分与类风湿关节炎靶点具有较高相关性。因此可以将人参皂苷Rb1、Rc、Rd、Rb3及七叶胆苷ⅩⅦ、伪人参皂苷F11、越南参皂苷R1、越南参皂苷R2及竹节参皂苷Ⅳa作为竹节参Q-Marker的选择。
目前已知,皂苷类化合物是竹节参最关键的药效物质基础。目前尚无直接对竹节参进行入血成分测定的全面研究,后续研究应深入探究竹节参的入血成分,并探明不同产地竹节参入血成分的差异,提高竹节参Q-maker分析体系的准确性和科学性。
3.6 竹节参与复方配伍相关的Q-Marker预测
中药复方配伍可起到协同增效的目的。竹节参具有散瘀止血、消肿止痛、祛痰止咳、补虚强壮之功,常配伍其他中药用于治疗跌打损伤、关节炎以及虚劳等气虚血瘀证[1]。竹节参片是临床用于治疗类风湿关节炎的复方制剂,其中竹节参与当归、淫羊藿、白芍、青风藤、地蜂子、穿山龙等进行配伍,共同发挥消肿止痛作用,其机制可能类似于肾上腺皮质激素[81]。竹节参中起抗炎镇痛作用的物质主要为PSPJ与TSPJ,因此可以将竹节参消肿止痛的成分(皂苷与多糖)作为方剂配伍的Q-Marker的重要参考依据。临床应用竹节参配伍治疗风湿关节炎疾病时,建议将起抗炎镇痛作用的PSPJ与TSPJ作为方剂配伍的Q-Marker之一。
竹节参兼具补虚之功,常多与党参、当归等配伍用于治疗虚劳,也可单独竹节参煎水当茶饮。其发挥药理作用可能与免疫系统调节有关[82],竹节参调节免疫系统的物质基础为PSPJ与TSPJ,故应将其作为免疫调节方剂配伍的Q-Marker的参考之一。
此外,竹节参兼具止血之功。竹节参配伍麦冬、丝茅根煎水服用治疗吐血;竹节参研粉水煎服用以治疗倒经、功能性子宫出血。竹节参中止血的化学成分亟待明确,并将其作为竹节参的Q-Marker的参考之一。
3.7 基于不同加工方法的竹节参Q-maker预测
不同加工炮制方法会影响中药有效成分的含量,选择合适的加工方法对保证中药药效至关重要,因此,加工方法对竹节参Q-Marker的预测亦具有重要意义。通过使用超高效液相色谱-四级杆-飞行时间串联质谱法对竹节参中的皂苷(三七皂苷R1、三七皂苷R2、人参皂苷Rg1、人参皂苷Rg2、人参皂苷Rd、人参皂苷Re、人参皂苷Rb1、人参皂苷Rb2、人参皂苷Rc、伪人参皂苷F11、伪人参皂苷RT1、竹节参皂苷V、竹节参皂苷Ⅳ、竹节参皂苷Ⅳa)、氨基酸(-组氨酸、-精氨酸、-丝氨酸、-丙氨酸、-天冬氨酸、-苏氨酸、-脯氨酸、-组氨酸、-精氨酸、-丝氨酸、-丙氨酸、-天冬氨酸、-苏氨酸、-脯氨酸、-异亮氨酸、-亮氨酸、-苯丙氨酸)及核苷(2′-脱氧胞苷、胞苷、腺苷、鸟苷、肌苷、尿苷、胸苷)含量进行测定,检测不同加工方法对竹节参药材中这些成分的影响,发现这些物质在一定浓度范围内均呈现良好的线性关系,发现皂苷中稳定性最好的为伪人参皂苷RT1、竹节参皂苷Ⅳ、竹节参皂苷Ⅳa、人参皂苷Rb1、人参皂苷Rb2[83];氨基酸中稳定性最好的为-组氨酸、-精氨酸、-天冬氨酸、-脯氨酸、-蛋氨酸、-异亮氨酸;核苷中稳定性最好的物质为腺苷和鸟苷。因此,可将上述物质作为不同加工条件下的竹节参Q-Maker预测分析的标准[84]。
3.8 基于新的药效用途的竹节参Q-maker分析
研究表明,TSPJ与PSPJ是竹节参调血脂作用的主要有效成分[28-29],目前已有专利将其运用于预防治疗多发性硬化疾病。TSPJ中调血脂有效成分为竹节参皂苷Ⅴ与人参皂苷[85]。TSPJ及PSPJ能降低小鼠血清中总胆固醇、三酰甘油及低密度脂蛋白胆固醇含量[86],可能通过白细胞分化抗原36-核苷酸结合寡聚化区域样受体家族3信号通路[87]和miR-34a/ SIRT1通路调血脂[19]。因此,可将TSPJ和PSPJ作为竹节参新的药效用途Q-Marker分析的重要参考。
4 结语与展望
竹节参又名竹节人参、白三七、竹节三七等,兼具北药人参和南药三七的功效,是土家族珍贵的草药,被民间誉为“草药之王”[88]。目前已从竹节参中分离出的化学成分主要为竹节参皂苷、多糖、氨基酸、无机盐、挥发油与核苷等。研究表明其药理作用在消化系统中主要起抗溃疡、保护肝损伤以及调节胃肠蠕动力作用,对中枢神经系统可以镇静、镇惊以及改善神经网络功能,还对心血管系统具有调血脂、保护缺血再灌注损伤、凝血和止血的作用。此外,竹节参还能抗疲劳、镇痛、抗炎、抗肿瘤及延缓衰老。其中TSPJ与多糖为其药理作用的主要物质基础。由于竹节参对生长环境要求严格,野生资源远远难以满足市场需求。近年来,随着人工栽培技术的突破,竹节参市场需求日趋扩大,在云南、四川和湖北等产区已出现人工种植竹节参,并形成一定的产业规模。但苗种选育、栽培、加工等因素导致其质量参差不齐,故亟需建立科学、合理的质量控制和评价方法,有利于对竹节参的质量进行全面地控制与评价。本文依据中药Q-maker概念,从竹节参的化学成分特有性、传统药效、传统药性、化学成分可测性等诸方面分析,发现竹节参最可能的质量控制标志物为TSPJ和PSPJ,在TSPJ中,进行网络药理学分析,已确定的Q-Marker有越南参皂苷R1、R2和竹节参皂苷Ⅳa;在《中国药典》2020年版中[1],竹节参皂苷Ⅴ(人参皂苷Ro)和竹节参皂苷Ⅳa作为竹节参的检测标准。综上所述,可确定为竹节参Q-Maker的具体化合物是越南参皂苷R1、越南参皂苷R2、竹节参皂苷Ⅳa和竹节参皂苷Ⅴ。该质量控制与评价方法对竹节参的资源利用与生药栽培,以及提高竹节参的利用效率,促进竹节参产业的良性发展具有重要意义。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 144.
[2] 欧阳丽娜, 向大位, 吴雪, 等. 竹节参化学成分及药理活性研究进展 [J]. 中草药, 2010, 41(6): 1023-1027.
[3] 武秋爽, 陈平, 张庆文. 竹节参化学成分、药理活性及分析方法研究进展 [J]. 亚太传统医药, 2016, 12(6): 46-54.
[4] 顿耀艳, 袁丁. 竹节参化学成分的研究进展 [J]. 时珍国医国药, 2006, 17(10): 1909-1911.
[5] 何毓敏, 艾可, 何春喜, 等. 竹节参中的三萜皂苷类成分及其13C-NMR谱特征 [J]. 中国中药杂志, 2019, 44(2): 249-260.
[6] 胡远浪, 袁丁, 何毓敏, 等. 竹节参HPLC-ELSD指纹图谱和化学成分分析 [J]. 中国中药杂志, 2010, 35(8): 1009-1013.
[7] 袁丁, 何毓敏, 鲁科明, 等. 竹节参中总皂苷和三萜苷元齐墩果酸的测定 [J]. 华西药学杂志, 2008, 23(6): 692-694.
[8] 蔡平, 邱晓星, 肖倬殷. 川产竹节参皂甙元的薄层光密度扫描测定 [J]. 四川医学院学报, 1984, 15(3): 237-242.
[9] 吴锦忠, 林如辉, 叶国维, 等. 人参属四种植物中糖类含量比较 [J]. 贵阳医学院学报, 1991, 16(2): 184-186.
[10] 张杰, 李春艳, 李劲平, 等. 蒽酮硫酸法与苯酚硫酸法测定竹节参多糖含量的比较研究 [J]. 中南药学, 2012, 10(6): 421-424.
[11] 陈永波, 饶斌, 沈艳芬, 等. 竹节人参中氨基酸和皂甙特征组分的分析鉴别 [J]. 色谱, 2003, 21(3): 248-250.
[12] 伍红年, 谭诗涵, 王元清, 等. 竹节参HPLC指纹图谱的建立及7种成分测定 [J]. 中成药, 2019, 41(5): 1074-1080.
[13] 吴锦忠, 易骏, 林晓峰, 等. 人参属四种植物中氨基酸和无机元素的比较研究 [J]. 贵阳医学院学报, 1992, 17(3): 230-232.
[14] 钱丽娜, 陈平, 李小莉, 等. 竹节参总皂苷成分的抗疲劳活性 [J]. 中国医院药学杂志, 2008, 28(15): 1238-1240.
[15] 刘桂林, 陈平, 张俊红, 等. 鄂产竹节参多糖成分抗疲劳作用的研究 [J]. 中国医院药学杂志, 2006, 26(12): 1459-1461.
[16] 唐倩, 杨治国, 刘娟, 等. 竹节参总皂苷对DSS诱导溃疡性结肠炎小鼠PPAR-γ信号通路及炎症因子的影响 [J]. 中药材, 2018, 41(3): 711-715.
[17] Borrelli F, Izzo A A. The plant kingdom as a source of anti-ulcer remedies [J]., 2000, 14(8): 581-591.
[18] 何志刚, 汪洋鹏, 刘磊, 等. 竹节参提取物对慢性酒精性肝损伤模型小鼠血清生化指标及炎症因子水平的影响 [J]. 浙江中西医结合杂志, 2018, 28(1): 21-24.
[19] 段丽, 刘朝奇, 吴利春, 等. 竹节参降脂复方对小鼠非酒精性脂肪性肝病的作用及机制研究 [J]. 解放军医学杂志, 2017, 42(9): 764-768.
[20] 熊海容, 李聪, 何春喜, 等. 竹节参总皂苷通过调节miR-199-5p改善小鼠脂肪性肝病的实验研究 [J]. 中国中药杂志, 2018, 43(17): 3525-3529.
[21] Liu J, Liu Y, Klaassen C D. The effect of Chinese hepatoprotective medicines on experimental liver injury in mice [J]., 1994, 42(3): 183-191.
[22] Shane-Mcwhorter L. Biological complementary therapies: A focus on botanical products in diabetes [J]., 2001, 14(4): 199-208.
[23] Li Y, Matsuda H, Yoshikawa M. Effects of oleanolic acid glycosides on gastrointestinal transit and ileus in mice [J]., 1999, 7(6): 1201-1205.
[24] Matsuda H, Li Y, Murakami T,. Structure-related inhibitory activity of oleanolic acid glycosides on gastric emptying in mice [J]., 1999, 7(2): 323-327.
[25] 陈淑清, 余立江, 江帆, 等. 竹节参总皂甙的镇痛、镇静、抗惊及解痉作用和毒性试验 [J]. 华西药学杂志, 1987, 2(2): 85-89.
[26] 贺海波, 石孟琼, 罗涛, 等. 珠子参总皂苷减弱炎症应答和对H2O2诱导新生大鼠心肌细胞损伤的保护作用 [J]. 中药药理与临床, 2012, 28(2): 51-55.
[27] Chen F, Eckman E A, Eckman C B. Reductions in levels of the Alzheimer’s amyloid beta peptide after oral administration of ginsenosides [J]., 2006, 20(8): 1269-1271.
[28] 杨小林, 陈平. 竹节参总皂苷对高血脂模型小鼠的影响作用 [J]. 中医药学报, 2010, 38(6): 22-24.
[29] 杨小林, 陈平, 王如锋, 等. 竹节参多糖对高血脂模型小鼠的影响作用 [J]. 中国医院药学杂志, 2011, 31(6): 433-435.
[30] 杨小林, 张春凤, 陈平, 等. 竹节参皂苷及其组合物的降脂活性比较研究 [J]. 上海中医药大学学报, 2020, 34(3): 57-61.
[31] Wang L P, Yuan D, Zheng J,. Chikusetsu saponin IVa attenuates isoprenaline-induced myocardial fibrosis in mice through activation autophagy mediated by AMPK/ mTOR/ULK1 signaling [J]., 2019, 58: 152764.
[32] Wei N, Zhang C C, He H B,. Protective effect of saponins extract fromon myocardial infarction: Involvement of NF-κB, Sirt1 and mitogen-activated protein kinase signalling pathways and inhibition of inflammation [J]., 2014, 66(11): 1641-1651.
[33] 孙桂波, 徐惠波, 温富春, 等. 去葡萄糖竹节参皂苷Ⅳa对缺氧复氧心肌细胞损伤的保护作用[J]. 中国药理学与毒理学杂志, 2005, 19(6): 424-427.
[34] 黄亚光, 欧炳金, 冯家腾, 等. 竹节参总皂苷调节大鼠海马区自噬减轻脑缺血再灌注损伤 [J]. 中成药, 2020, 42(7): 1721-1726.
[35] 贾占红, 赵晖. 竹节参总皂苷对脑缺血大鼠神经细胞凋亡和即早基因表达的影响 [J]. 中国实验方剂学杂志, 2011, 17(21): 168-172.
[36] 文德鉴, 张松, 张翠兰, 等. 竹节人参总皂苷对I/R损伤大鼠抗氧化作用的观察 [J]. 中国应用生理学杂志, 2008, 24(2): 195-196.
[37] 陈玲, 黄徐英. 竹节参多糖抗血栓活性的研究 [J]. 中华实验外科杂志, 2017, 34(8): 1380-1383.
[38] 舒盼盼, 朱鹏飞, 杨鑫龙, 等. 6种人参属药材体外抗凝血活性与皂苷含量的相关性研究 [J]. 中草药, 2019, 50(4): 918-924.
[39] 沈金阳, 杨中林. 竹节参根和茎叶中总皂苷抗血栓活性研究 [J]. 海峡药学, 2014, 26(3): 149-151.
[40] Matsuda H, Samukawa K, Fukuda S,. Studies offibrinolysis [J]., 1989, 55(1): 18-21.
[41] 王如锋, 陈平, 贾放, 等. 鄂产竹节参多糖的抗炎、镇痛活性 [J]. 中国医院药学杂志, 2012, 32(7): 491-494.
[42] 文德鉴, 张翠兰, 陈国栋, 等. 竹节参总皂苷镇痛作用的实验研究 [J]. 时珍国医国药, 2008, 19(8): 1983-1984.
[43] 郭哲, 冯知涛, 张浩然, 等. 竹节参及其制剂治疗类风湿关节炎研究进展 [J]. 中药材, 2019, 42(4): 941-944.
[44] 崔倩倩, 孙志伟, 张长城, 等. 竹节参多糖的免疫佐剂活性研究 [J]. 中国中医药信息杂志, 2014, 21(12): 88-91.
[45] 陈龙全, 刘杰书, 黄琼. 竹节参的主要药效与作用机制 [J]. 中华中医药杂志, 2009, 24(2): 197-198.
[46] 王洪武, 姜美杰, 赵海霞, 等. 竹节参皂苷与多糖组合物对免疫低下小鼠免疫功能的影响 [J]. 广东医学, 2010, 31(20): 2620-2622.
[47] 王洪羽, 金宏, 刘威, 等. 人参皂苷Rg3抗肿瘤作用的研究进展 [J]. 世界最新医学信息文摘, 2018, 18(68): 50-51.
[48] 邓旭坤, 米雪, 蔡俭, 等. 竹节参总皂苷的抗肿瘤作用和毒性研究 [J]. 中南民族大学学报: 自然科学版, 2013, 32(1): 47-49.
[49] 袁丁, 左锐, 张长城. 竹节参总皂苷抑制小鼠肿瘤生长的实验研究 [J]. 时珍国医国药, 2007, 18(2): 277-278.
[50] 高贵洲, 张宏瑞, 张涛, 等. 竹节参皂苷对顺铂耐药肺癌细胞敏感性的影响及机制研究 [J]. 中国现代应用药学, 2020, 37(22): 2715-2719.
[51] 高贵洲, 张宏瑞, 梁晓华, 等. 竹节参皂苷通过Toll样受体4/核因子-κB信号通路调控免疫功能对肺癌大鼠模型的影响 [J]. 陕西医学杂志, 2020, 49(12): 1539-1542.
[52] Deng L L, Yuan D, Zhou Z Y,. Saponins fromattenuate age-related neuroinflammation via regulation of the mitogen-activated protein kinase and nuclear factor kappa B signaling pathways [J]., 2017, 12(11): 1877-1884.
[53] 焦梦婷, 刘小慧, 刘朝奇, 等. 竹节参总皂苷对衰老大鼠肝脏内质网应激及自噬介导的炎症反应影响 [J]. 中国新药杂志, 2020, 29(16): 1886-1893.
[54] 王瑞, 王佳文, 王婷, 等. 竹节参总皂苷减轻衰老大鼠的神经细胞凋亡 [J]. 现代食品科技, 2020, 36(1): 8-15.
[55] Wang T, Di G J, Yang L,. Saponins fromattenuate-galactose-induced cognitive impairment through its anti-oxidative and anti-apoptotic effects in rats [J]., 2015, 67(9): 1284-1296.
[56] 刘玉萍, 王金萍, 郭志刚. 竹节参培养细胞提取的竹节参总皂苷对大鼠佐剂性关节炎的抑制作用 [J]. 天然产物研究与开发, 2013, 25(6): 762-766.
[57] 代艳文, 杨莉, 万静枝, 等. 竹节参醇提物对LPS诱导RAW264.7细胞炎症的保护作用 [J]. 中国实验方剂学杂志, 2014, 20(2): 163-166.
[58] 代艳文, 袁丁, 万静枝, 等. 竹节参总皂苷通过NF-κB通路对LPS致RAW264.7细胞炎症的保护作用研究 [J]. 中国中药杂志, 2014, 39(11): 2076-2080.
[59] 刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker): 中药产品质量控制的新概念[J]. 中草药, 2016, 47(9): 1443-1457.
[60] 鲁歧, 富力, 李向高. 人参属植物分类学的研究进展 [J]. 吉林农业大学学报, 1992, 14(4): 107-111,120.
[61] 杨世海, 方阵. 我国人参属植物分类研究概况 [J]. 人参研究, 1991, 3(4): 4-7.
[62] 杭传珍. 活血化瘀治则的药理学基础 [J]. 中医临床研究, 2019, 11(1): 34-35.
[63] 袁琴, 袁丁, 周志勇, 等. 竹节参齐墩果烷皂苷对RAW264.7巨噬细胞SIRT1活性影响及抗炎作用研究 [J]. 中国药理学通报, 2016, 32(3): 349-354.
[64] 吴孟华, 张伟, 邓建华, 等. 竹节参抗炎作用的研究进展 [J]. 中药材, 2015, 38(5): 1096-1098.
[65] 敖明章. 竹节参皂苷抗炎抗风湿作用及机理研究 [D]. 武汉: 华中科技大学, 2012.
[66] 严永清, 吴建新. 药物的甘味与归经、作用及化学成分的关系 [J]. 中药通报, 1988, 13(5): 52-55.
[67] 严永清, 吴建新. 药物的苦味与归经、作用及化学成分的关系 [J]. 现代应用药学, 1987, 4(5): 12-15.
[68] 吴安芝, 张引拖. 论述苦味药的药性特征及其配伍作用 [J]. 内蒙古中医药, 2011, 30(7): 85-86.
[69] 胡菊花. 研究中药临床药理的药性理论 [J]. 世界最新医学信息文摘, 2017, 17(94): 35-36.
[70] 陈佳丽, 谈梦霞, 邹立思, 等. 超快速液相色谱-三重四级杆/线性离子阱质谱法同时测定不同产地竹节参药材中多元成分 [J]. 中国药学杂志, 2019, 54(3): 226-233.
[71] 谭诗涵, 伍红年, 雷雅婷, 等. 一测多评法测定竹节参中7种皂苷类成分的含量 [J]. 中草药, 2019, 50(17): 4164-4169.
[72] 梁小飞, 白玮, 李玉泽, 等. 太白楤木指纹图谱及含量测定研究 [J]. 中药新药与临床药理, 2019, 30(12): 1528-1533.
[73] 邹海艳, 周丹, 赵晖, 等. HPLC同时测定竹节参中竹节参皂苷Ⅴ和Ⅳa含量 [J]. 辽宁中医药大学学报, 2015, 17(1): 52-54.
[74] 姜薇薇, 陈庚, 沈雁南, 等. HPLC法同时测定狭叶竹节参中4种皂苷成分的含量 [J]. 中国药师, 2020, 23(3): 585-587.
[75] 袁丁, 何毓敏, 鲁科明, 等. RP-HPLC法测定竹节参药材中齐墩果酸的含量 [J]. 中国药房, 2009, 20(15): 1151-1153.
[76] 林奇泗, 李京华, 王慧, 等. 分析比较竹节参两种不同提取方法所得挥发性成分 [J]. 沈阳药科大学学报, 2013, 30(10): 772-775.
[77] 张元杰, 钱正明, 陈肖家, 等. HPLC法同时测定补益中药中尿苷、腺嘌呤、鸟苷和腺苷的含量 [J]. 药物分析杂志, 2010, 30(1): 33-36.
[78] Ji W H, Zhang M M, Yan H J,. Selective extraction and determination of chlorogenic acids as combined quality markers in herbal medicines using molecularly imprinted polymers based on a mimic template [J]., 2017, 409(30): 7087-7096.
[79] 胡锦苹, 黎丹, 王小平, 等. 藤珠胃康颗粒中4种皂苷成分的大鼠体内药代动力学研究 [J]. 中南药学, 2017, 15(6): 790-793.
[80] 胡晒平, 严建业, 伍红年, 等. 基于UPLC-Q-TOF-MS的西洋参提取物及入血成分分析 [J]. 中南药学, 2019, 17(6): 825-830.
[81] 陈龙全, 袁德培, 孟卫星, 等. 复方竹节参片镇痛、抗炎作用的实验研究 [J]. 江苏中医, 1998, 30(9): 47-48.
[82] 高梅, 杜冠华. 中医扶正补益对现代药理学研究的启示[A] // 中国药理学会补益药药理专业委员会成立大会暨人参及补益药学术研讨会会议论文集[C]. 昆明:中国药理学会, 2011: 2.
[83] 陈佳丽, 谈梦霞, 邹立思, 等. 不同加工竹节参中多元活性成分同时测定及灰色关联度分析 [J]. 中国中药杂志, 2018, 43(21): 4274-4282.
[84] 张文丽, 吴浩, 梅宇晨, 等. 基于稳定同位素技术的竹节参产地识别研究 [J]. 中草药, 2020, 51(23): 6070-6076.
[85] 周丹菲, 宋文锋, 谭新睿, 等. 人参皂苷和氯米帕明对慢性应激小鼠糖代谢和脂代谢的影响 [J]. 西北药学杂志, 2010, 25(5): 361-363.
[86] 贾银芝, 杨中林. 竹节参总皂苷对Triton WR-1339诱发的高脂血症小鼠降血脂作用研究 [J]. 亚太传统医药, 2015, 11(12): 9-11.
[87] 熊海容. 基于CD36-NLRP3信号通路研究竹节参皂苷Ⅳa改善脂肪性肝病的实验研究 [D]. 宜昌: 三峡大学, 2019.
[88] 涂星, 徐新华, 张燕, 等. 恩施地区濒危野生竹节参生态环境及伴生植物群落特征研究 [J]. 中国中药杂志, 2016, 41(9): 1596-1601.
Research progress on chemical constituents and pharmacological effects ofand predictive analysis on quality markers
ZHOU Jing1, FU Xian-yun1, CAI San-jin1, YUAN Ding1, MEI Zhi-gang2, FENG Zhi-tao1
1. Third-Grade Pharmacological Laboratory on Chinese Medicine Approved by State Administration Chinese Medicine, College of Medicine, China Three Gorges University, Yichang 443002, China 2. Hunan Key Laboratory of Integrated Traditional Chinese and Western Medicine on Prevention and Treatment of Cardio-Cerebral Diseases, Hunan University of Chinese Medicine, Changsha 410208, China
Zhujieshen () belongs to thegenus of Acanthaceae,which is mainly distributed in Hubei, Yunnan, Guizhou, Sichuan and other places in China, with Enshi in Hubei being the most abundant. Because of its tonic effect asetand the activating effect aset, it is often used as an ethnic medicine to treat the syndrome ofdeficiency and blood stasis, such as traumatic injury, arthritis, and deficiency of fatigue. The main chemical constituents ofare saponins, sugars, amino acids, essential oils, nucleosides, and inorganic salts. Studies showed thathad anti-fatigue, liver protection, sedation, cardio-cerebrovascular protection, immune regulation, anti-tumor, anti-aging, and anti-inflammatory pharmacological effects. This paper reviewed the research progress on chemical constituents and pharmacological effects ofat home and abroad, and analyzed its quality markers (Q-marker). Vina-ginsenoside R1, vina-ginsenoside R2, chikusetsusaponin Ⅳa and chikusetsusaponin Ⅴ can be used as the main Q-markers of, which provide a basis for the establishment of quality evaluation system ofand a reference for the research and development of related new drugs.
C. A. Mey.; quality marker; vina-ginsenoside R1; vina-ginsenoside R2; chikusetsusaponin Ⅳa; chikusetsusaponin Ⅴ; polysaccharides of; total saponins of; cardio-cerebrovascular system regulation; immune regulation; anti-inflammation
R282.71
A
0253 - 2670(2021)09 - 2819 - 12
10.7501/j.issn.0253-2670.2021.09.029
2020-12-08
湖北省医学青年拔尖第一层次人才项目(EWT2019-48)
周 静(1998—),女,四川资阳人,本科在读,主要从事中药药理研究。Tel: (0717)6396558 E-mail: 44486482@qq.com
冯知涛,副教授,硕士生导师。Tel: (0717)6396558 E-mail: fengzhitao2008@126.com
梅志刚,教授,硕士生导师,Tel: (0731)88458285 E-mail: zhigangmei@139.com
[责任编辑 崔艳丽]

