番茄青枯菌遗传多样性及砧木品种抗性评价
袁远国, 黄 露, 段正凤, 白明松, 李慧娟, 吴石平, 佘小曼
(1.贵州省园艺研究所, 贵阳 550006; 2.贵州省植物保护研究所, 贵阳 550006;3.贵州金农科技有限责任公司, 贵阳 550006; 4.黄平县农业农村局, 贵州 黄平 556100;5.广东省农业科学院植物保护研究所,广东省植物保护新技术重点实验室, 广州 510640)
番茄是重要的经济作物,贵州常年种植面积约1.4万hm2,外销率70%左右,是贵州重要的外销蔬菜。近年来,由茄科雷尔氏菌(Ralstoniasolanacearum(Smith) Yabuuchi)侵染引起的番茄青枯病在贵州各番茄种植基地普遍发生,连作地块发生更为严重。青枯病发病时植株迅速萎蔫枯死,造成严重减产甚至绝收。目前暂无高效、低毒、无污染的化学杀菌剂应用于生产,而生物防治效果偏低、持效性短[1],在热带及亚热带地区,青枯病是限制番茄生产发展的重要因素[2]。在贵州番茄主产区黔南布依族苗族自治州、贵阳市、安顺市发现,许多种植户与合作社也因为番茄青枯病难以防治、损失过大而放弃继续生产。防治青枯病最根本的方法是选用抗病品种,但番茄青枯病抗性遗传因为调控一些不良经济性状的基因与之连锁等问题限制了青枯病抗病育种的进程[3]。在生产上,利用抗病砧木品种开展嫁接栽培是目前行之有效的综合防治方法。据调查,贵州独山县、关岭县近年使用较广泛的抗番茄青枯病嫁接砧木品种为广西玉林市振兴蔬菜开发部生产的“刘振兴新一代特种砧木”,品种比较单一,抗性退化严重。由于茄科雷尔氏菌具有十分广泛的寄主范围[4],且具有明显的生理分化现象和致病性差异[5-6],容易导致砧木品种的抗性丧失。应用贵州本地番茄青枯菌株系筛选出抗病砧木品种,不仅丰富抗青枯病砧木品种资源,更有利于番茄青枯病的综合防治。
在我国,已经有15个省份对番茄青枯病进行报道[7]。Xue等[8]曾报道了贵州5株番茄青枯菌株分属演化型I,其中3株菌株为生化变种4,2株菌株为生化变种3,并明确其中1株菌株为序列变种14。徐莉莉等[9]报道,贵州分离自番茄、茄子、辣椒和烟草的22株青枯菌中有17株青枯菌属于生化变种3,3株青枯菌属于生化变种4,2株青枯菌属于生化变种5。此外,番茄青枯菌生理生化及致病性相关报道较少。基于此,本研究从独山县和开阳县采集病株样本,组织分离获得8株番茄青枯病菌株,分析了菌株的遗传多样性,并应用分离的菌株对17个番茄砧木品种进行抗性评价,为其在贵州番茄产区推广应用提供参考。
1 材料与方法
1.1 材 料
在独山县和开阳县番茄种植青枯病严重发病地块,分别随机采集病株。对照青枯菌株Ssf-4和Hz-1,感病对照番茄品种东茄和抗病对照番茄品种LS-89,由广东省农业科学院植物保护研究所提供。供试番茄砧木品种:2号、强根1号、强根3号、强根8号和强根9号(酒泉市众禾农业发展有限责任公司);野生樱桃番茄(美国引进的野生番茄材料);果砧1号(北京京研益农科技发展中心);番茄砧木1号(西安金鹏种苗公司);千叶、萨瓦(北京育正泰种子有限公司);ATM 053番茄砧木(沈阳克粒思丰种苗商行);西大砧木1号(广西大学);桂砧1号(广西农业科学院蔬菜研究所);沪砧2号(上海沃尔农业科技有限公司);刘振兴新一代特种砧木(玉林市振兴蔬菜开发部);黔砧3号、GY 20-33(贵州省园艺研究所)。
1.2 病原菌分离
采用常规植物病原细菌组织分离法分离青枯菌[10]。切取番茄病株的茎基部或根部维管束组织约3 mm ×5 mm,在75%乙醇和0.1%升汞溶液中表面消毒各1 min,用无菌水清洗3次后用灭菌吸水纸吸干水分。在灭菌的培养皿中加入50 μL无菌水,将上述表面消毒处理的组织放入其中,切碎,静置10 min。用接种环蘸取菌液在含1% 2,3,5-氯化三苯基四氮唑(TZC)琼脂平板划线分离,挑取单菌落进行纯化。菌株置于无菌水中20 ℃恒温保存备用。
1.3 病原菌致病性测定
取20 ℃保存的番茄青枯菌株(分离自开阳县的番茄青枯菌株编号分别为GZ 01~GZ 04,分离自独山县的番茄青枯菌株编号分别为GZ 05~GZ 08),在含1% TZC的LB琼脂培养基平板划线上,30 ℃培养2 d后,选取白边宽中间粉红色的单菌落接种于100 mL LB液体培养基中,30 ℃培养24 h。采用注射接种或伤根接种2种方法,将上述8株菌株分别接种番茄(东茄)、茄子(紫霸长茄)、辣椒(汇丰二号)、姜(大肉姜 )、烟草(大黄烟 )和香蕉(广东香蕉 2号)等植株,测定番茄青枯病菌株对这些植物的致病性。番茄、茄子、辣椒和烟草分别接种30株,姜和香蕉分别接种15株;接种菌液的浓度为3×108CFU ·mL-1。Ssf-4菌株为对照。根据茄科雷尔氏菌生理小种划分标准鉴定出各菌株所属生理小种[5,11-12]。每周调查1次各处理发病情况,并从各处理中随机取新发病植株3~5株进行病原菌分离。接种试验期间网室内气温为25~36 ℃。试验重复2次。
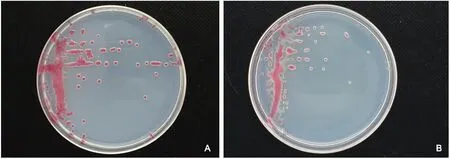
注:A为GZ 01;B为Ssf-4。
1.4 生化变种测定
生化变种的测定参照方中达[10]的方法。所用基本培养基成分(1 000 mL):(NH4)H2PO41.0 g、KCl 0.2 g、MgSO4·7 H2O 0.2 g、酵母提取物0.2 g、溴百里酚蓝指示剂(1.6%酒精溶液) 2 mL,pH值为7.0。将乳糖、麦芽糖、纤维二糖、甘露醇、山梨醇、甜醇分别配制成10%溶液,过滤灭菌后加入基本培养基至终浓度1.0%,3次重复。根据茄科雷尔氏菌生化变种划分标准明确菌株的生化变种归属[13-16]。
1.5 分子特征分析
16 SrRNA序列分析:应用细菌16SrDNA基因的通用引物27 f(5′-AGAGTTTGATCCTGGCTCAG-3′)和1 541 r(5′-AAGGAGGTGATCCAGCCGCA-3′)[17]扩增青枯菌的16SrDNA序列。PCR反应体系为PremixTaq25 μL、DNA模板50 ng、引物27 f和1 541 r各6 pmol,加灭菌的双蒸水至50 μL。反应程序为:96 ℃预变性5 min;94 ℃ 1 min,50 ℃ 1 min,72 ℃ 3 min,35个循环;72 ℃延伸10 min。对PCR产物进行测序,利用NCBI中BLAST程序进行序列同源性搜索。
演化型鉴定:参照Fegan等[18]的方法测定上述8株菌株的演化型,所用PCR鉴定引物分别为Nmult:21:1 F(5′-CGTTGATGAGGCGCGCAATTT-3′)、Nmult:21:2 F(5′-AAGTTATGGACGGTGGAAGTC-3′)、Nmult:22:InF(5′-ATTGCCAAGACGAGAGAAGTA-3′)、Nmult:23:AF(5′-ATTACSAGAGCAATCGAAAGATT-3′)、Nmult:22:RR(5′-TCGCTTGACCCTATAACGAGTA-3′)以及青枯菌特异性引物759 f(5′-GTCGCCGTCAACTCACTTTCC-3′)和760 r(5′-GTCGCCGTCAGCAATGCGGAATCG-3′)[19]。PCR扩增体系为:引物Nmult:21:1 F、Nmult:21:2 F和Nmult:22:InF各6 pmol,Nmult:23:AF和Nmult:22:RR各18 pmol,759 f/760 r各4 pmol,PremixTaq25 μL,DNA模板50 ng,加灭菌的双蒸水至50 μL。反应程序为96 ℃预变性5 min;94 ℃15 s,59 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃延伸10 min。取10 μL PCR 产物在2.5%琼脂糖凝胶中电泳,根据带型确定供试菌株的演化型归属。
序列变种鉴定:应用引物eglF(5′-ATGCCGCTGGTTGCCGCTTCGATG-3′)和eglR(5′-TTACTTCAGGTACGGCGCCAGCAC-3′)PCR扩增青枯菌内葡聚糖(egl)基因,PCR扩增采用50 mL反应体系,其中Premix ExTaq25 μL,模版50 ng,引物Endo-F和Endo-R各6 pmol,5%DMSO。反应程序为96 ℃预变性9 min,94 ℃ 1 min,70 ℃ 1 min和72 ℃ 2 min,30个循环;72 ℃延伸20 min。将PCR扩增产物进行序列测定。应用MEGA-X[19]软件对egl基因序列进行系统进化分析,确定菌株的序列变种。
1.6 番茄品种抗性评价
用GZ 01和GZ 05这2株菌株1∶1混合菌液接种,接种菌液浓度为1×108CFU·mL-1。采用浸根法接种番茄品种,每处理30株,4次重复,随机排列。接种后每周调查一次,记录各处理的发病情况。当各处理的病情基本稳定、无新病株出现时,统计其病株率,评价各品种对青枯病的抗性水平。番茄对青枯病的抗性标准[20]:高抗(HR):病株率 ≤20%;抗病(R):20%<病株率 ≤40%;耐病(MR): 40%< 病株率 ≤60%;感病(S):60%< 病株率。
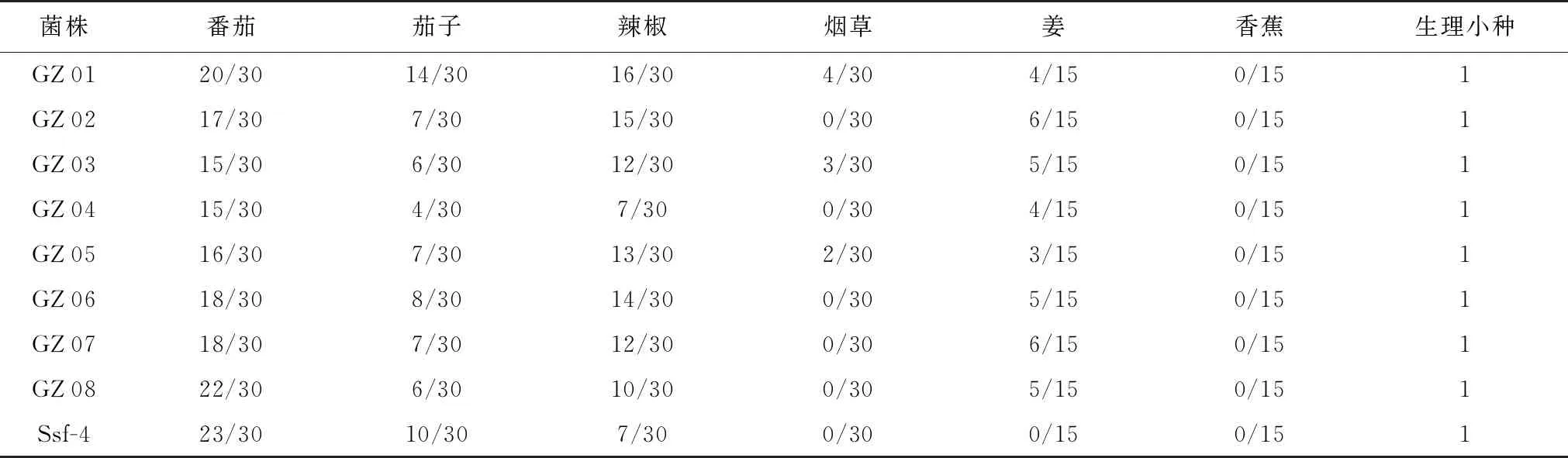
表1 分离的青枯菌致病性测定

注:A为番茄青枯病田间症状;B为番茄青枯病温室接种症状。
2 结果与分析
2.1 青枯菌分离及培养性状
在添加1% TZC的选择性琼脂平板上, 30 ℃培养72 h后,分离自番茄病株茎基部或根部维管束组织的菌落呈近圆形或梭形,隆起,中间粉红色,周围乳白色(图1)。这些性状与对照的茄科雷尔氏菌Ssf-4菌株的菌落特征一致。
2.2 致病性测定结果
分离的8株番茄青枯菌株接种健康的番茄植株7 d后,番茄植株产生了番茄青枯病的典型症状(图2);此外,这8株番茄青枯菌株还可侵染茄子和辣椒,弱侵染烟草和姜,不侵染香蕉。对照菌株Ssf-4可侵染番茄、茄子和辣椒,不侵染姜、烟草和香蕉。根据茄科雷尔氏菌生理小种划分标准[5,11-12], 8株番茄青枯菌株应属茄科雷尔氏菌1号生理小种(表1)。
2.3 生化变种鉴定结果
碳水化合物利用试验结果表明,8株番茄青枯菌株均可以利用麦芽糖、乳糖、纤维二糖、山梨醇、甘露醇和卫矛醇等6种碳水化合物,根据茄科雷尔氏菌生化变种划分标准[13-16], 8株番茄青枯菌株均属茄科雷尔氏菌生化变种3(表2)。
2.4 分子特征分析
2.4.116SrDNA序列分析
应用细菌16SrDNA通用引物27 f和1 541 r进行PCR,从8株番茄青枯菌株中均能扩增出约1 500 bp特异片段。序列测定结果表明,8株番茄青枯菌株16SrDNA近全长均为1 497 bp(GenBank登录号:MT 367723~MT 367730),序列间同源率为99.1%~100%。BLAST比对结果显示,这8个序列与茄科雷尔氏菌R.solanacearumGMI 1 000[21](GenBank登录号:AL 646052)16SrDNA的同源率为99.3%~99.9%。
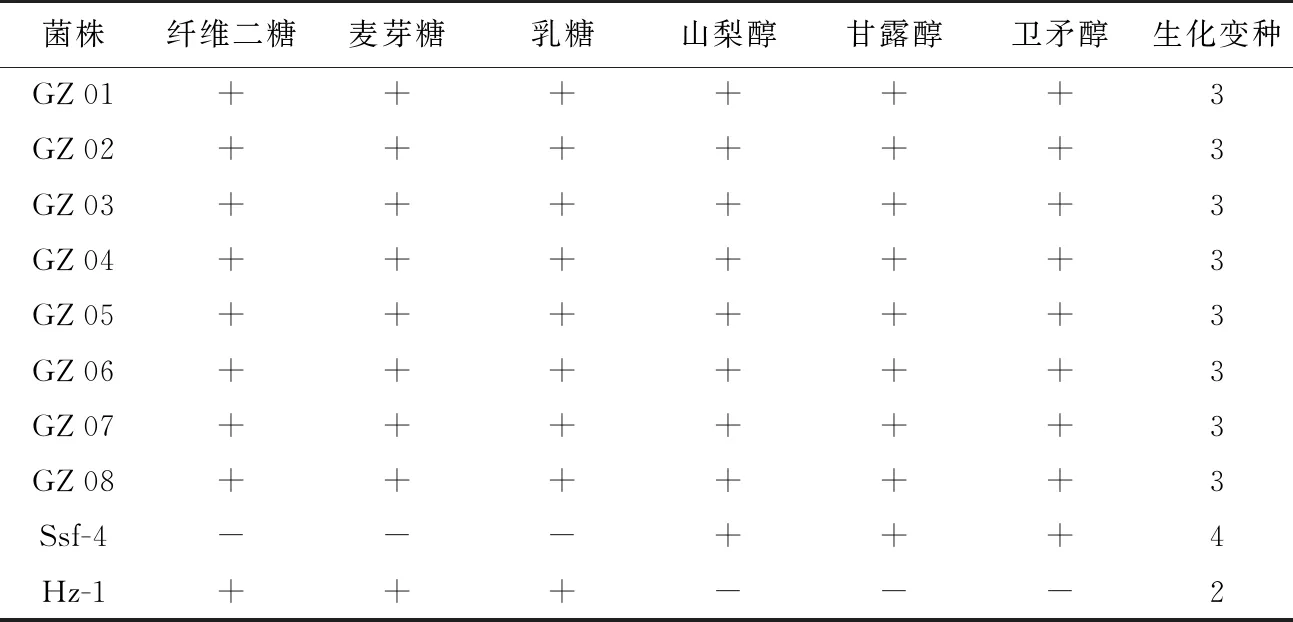
表2 8株分离自番茄的青枯菌株的碳水化合物利用试验
2.4.2演化型鉴定结果
8株番茄青枯菌株及对照菌株Ssf-4均可扩增得到144 bp的演化型Ⅰ特异条带和280 bp的茄科雷尔氏菌特异性条带,而对照菌株Hz-1可扩增到280 bp 和372 bp的条带;其中144 bp 片段为演化型Ⅰ的特异性扩增条带,372 bp片段为演化型Ⅱ的特异性扩增条带,280 bp 片段为青枯菌特异性扩增条带(图3)。因此,8株番茄青枯菌株均属茄科青枯菌演化型Ⅰ,即亚洲组。
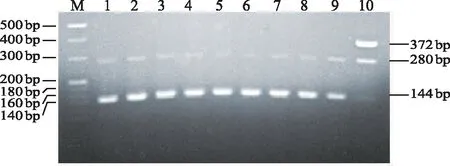
注:M为20 bp Marker;从上往下,500 bp,400 bp,300 bp,200 bp,180 bp,160 bp,140 bp,120 bp and 100 bp;泳道1~8为GZ 01、GZ 02、GZ 03、GZ 04、GZ 05、GZ 06、GZ 07、GZ 08;泳道9为Ssf-4;泳道10为Hz-1。
2.4.3序列变种分析结果
应用eglF和eglR引物,从8株番茄青枯菌株DNA中均能扩增出约1 000 bp特异条带。序列测定结果表明,8株番茄青枯菌株的egl基因部分序列长为698 bp(GenBank登录号:MT 376744~MT 376751)。BLAST结果显示,这8个egl基因序列与R.solanacearumGMI 1 000 菌株egl基因的同源率为98.9%~99.6%。利用MEGA X软件将8株番茄青枯菌株与GenBank中40个青枯菌代表菌株的egl基因序列进行进化分析,结果(图4)显示,分离自开阳县的青枯菌株GZ 01、GZ 02、GZ 03和GZ 04 属于序列变种54,而分离自独山县的青枯菌株GZ 05、GZ 06、GZ 07和GZ 08属于序列变种17。
2.5 番茄抗性评价结果
供试的17个砧木品种分别接种番茄青枯病菌(菌株GZ 01和GZ 05混合液),接种后第5周各处理病情基本稳定,统计出各处理的病株率。调查结果显示,对照感病番茄品种东茄的病株率为96.25%,抗病番茄品种LS 89病株率为17.58%;供试17个品种中,番茄砧木1号品种病株率最高,为100%,西大砧木1号品种病株率最低,为13.66%。参照上述番茄品种对青枯病的抗性水平标准可以得出:参试的番茄砧木1号、野生樱桃番茄、果砧1号、GY 20-33和刘振兴新一代特种砧木等5个品种对番茄青枯病抗性水平表现为感病;强根1号和强根3号2个品种对番茄青枯病抗性水平表现为耐病;ATM 053番茄砧木、沪砧2号、千叶和萨瓦等4个品种对番茄青枯病抗性水平表现为抗病;黔砧3号、2号、强根9号、桂砧1号、强根8号和西大砧木1号等6个品种对番茄青枯病抗性水平表现为高抗(表3)。
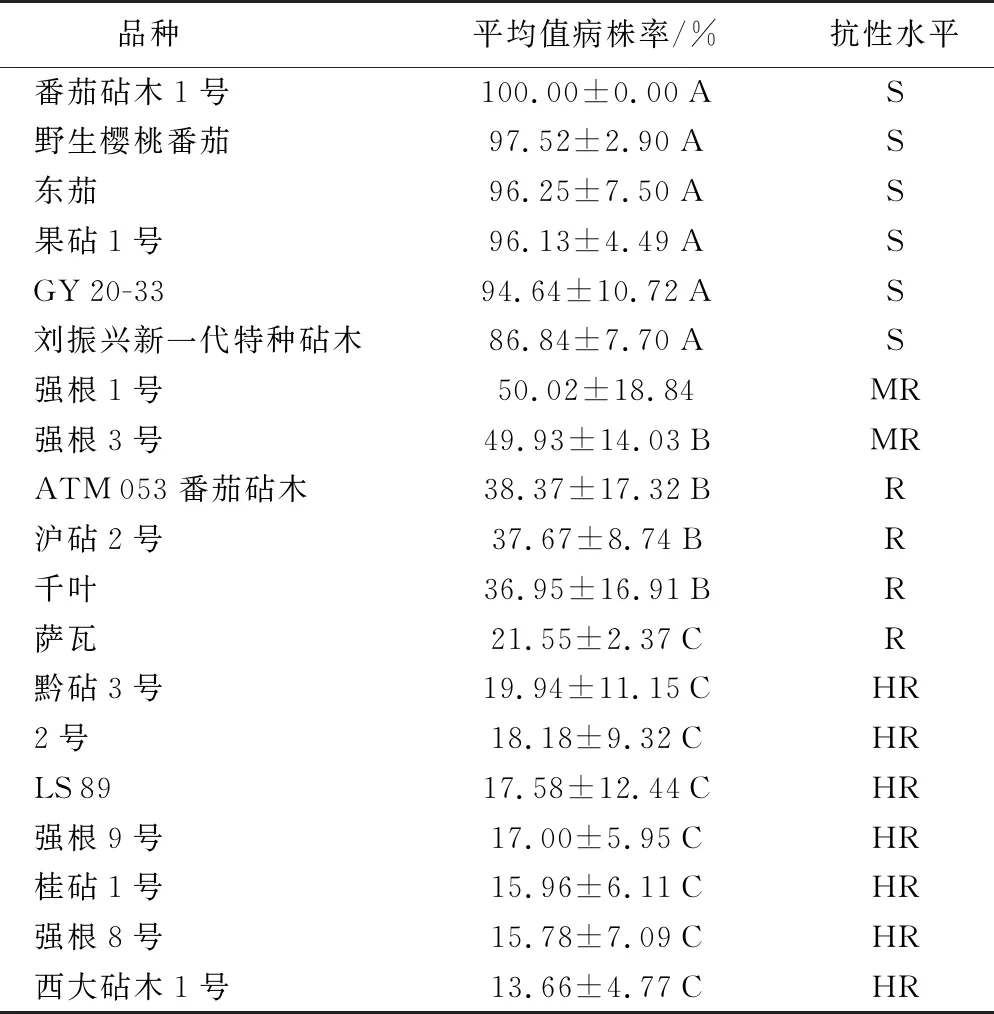
表3 17个砧木品种对番茄青枯菌的抗性评价

图4 8株分离菌株和40株青枯菌基于部分egl基因序列系统进化树
3 讨 论
贵州番茄连作种植青枯病发病严重,本实验对两个试验点的番茄青枯病病株分离菌株进行研究,证明了引起贵州番茄青枯病的菌株属于茄科雷尔氏菌演化型Ⅰ,1号生理小种,生化变种3,存在序列变种17和54。
茄科雷尔氏菌具有明显的生理分化现象和致病性差异[5-6]。目前已有报道的番茄青枯菌存在相同的生理小种,不同的演化型、生化变种和序列变种。国外番茄青枯菌属于茄科雷尔氏菌1号生理小种,演化型Ⅰ、Ⅱ、Ⅲ和Ⅳ[4,22],生化变种Ⅰ、2、3和4[4,23-24],存在1、4、5、6、7、8、9、10、11、13、14、15、18、20、29、31、35、41、38、39、46、52等22个序列变种[4,22,25-27]。而在我国已报道的番茄青枯菌属于茄科雷尔氏菌1号生理小种[28],演化型Ⅰ,生化变种2、3和4,存在13、14、15、16、17、18、34、44、48和54[8,28-30]等10个序列变种。本研究明确了引起独山县和开阳县8株青枯菌株可侵染番茄、茄子、辣椒,弱侵染烟草和姜,不侵染香蕉,属于茄科雷尔氏菌1号生理小种,与Xue等[8]、Xu等[28]研究结果一致。8株青枯菌株属茄科雷尔氏菌生化变种3,与Xue等[8]曾报道分离自贵州番茄茄科雷尔氏菌属于生化变种3和生化变种4不同,其原因可能是不同菌株间差异引起的。演化型鉴定结果和egl基因部分序列系统进化分析结果表明,8株番茄青枯菌株均属于茄科雷尔氏菌演化型Ⅰ,该结果符合Fegan等[18]认为的亚洲起源的茄科雷尔氏菌属于演化型Ⅰ分类框架,同时也与我国报道的番茄青枯菌属于茄科雷尔氏菌演化型Ⅰ的结果一致。目前国际上已经鉴定出了63个序列变种[29],本研究明确了分离自贵州番茄青枯病菌存在序列变种54(菌株GZ 01~GZ 04)和序列变种17(菌株GZ 05~GZ 08)。Xue等[8]曾报道分离自贵州番茄青枯菌存在序列变种14,本研究未鉴定到序列变种14的菌株,其原因可能是由于采集分离的菌株来自不同地区所引起。
番茄青枯病是番茄生产上重要的土传病害,发病严重时使番茄生产遭受巨大损失,迄今为止尚未找到防治番茄青枯病的有效方法,而利用抗病砧木进行嫁接防治青枯病是最经济、有效、方便的措施之一。日本从美国引进BF兴津101作为砧木用于生产,20 世纪80 年代,日本又培育了LS 89、BFM-R、Tsueeze 等抗青枯病砧木品种[31]。我国番茄砧木的研究起步较晚,但近年来,国内蔬菜育种单位相继选育出优良的番茄砧木品种,如西大砧木1号[32]、桂砧1号[33]、果砧1号[34]等。本研究进一步应用分离到的青枯菌菌株接种17个番茄砧木品种,筛选出高抗青枯病番茄砧木品种6个,抗青枯病番茄砧木品种4个,其中西大砧木1号和桂砧1号属于高抗番茄青枯病,该结果与孙岚明等[32]和黄天云等[33]报道的田间抗性一致。而郑康等[35]认为,桂砧1号对GMI 1000番茄青枯菌株免疫,该结果与本研究结果不同,可能是由于应用不同番茄青枯菌株接种引起的。果砧1号是由柴敏等[36]选育出来的抗线虫砧木,李颖仪等[34]利用果砧1号嫁接珍美番茄品种,番茄植株田间自然发病病株率在10%以下,而本研究中果砧1号对贵州番茄青枯菌株表现为高感,其原因可能是李颖仪等[34]利用田间栽培试验方法评价果砧1号抗性,而评价时由于田间土壤青枯菌分布不均匀或浓度较低导致田间番茄植株发病较低;而本研究利用2株不同来源青枯菌株混合液接种,增加了鉴定结果的准确性和普遍性。
本研究筛选出12个抗耐番茄青枯菌砧木品种,这些结果对于番茄青枯病防控以及抗病砧木在贵州番茄主产区的分布利用有着重要的指导意义。

