复方益肝灵片联合替诺福韦治疗肺结核合并慢性乙肝疗效观察
万丽红,汪敬杰,刘 恒
(秦皇岛市第二医院 感染科,河北 秦皇岛 066000)
肝纤维化是指各种致病因子长期作用于肝细胞,导致肝细胞结构与功能发生改变,出现肝内组织异常增生[1],若各种致病因子不能及时去除,肝纤维化会进一步发展为肝硬化,甚至演变为肝癌[2]。肺结核合并慢性乙肝相比于单纯肺结核或乙肝患者更容易发生肝损伤,且损伤程度更为严重。停药后肝损伤仍不易恢复,是肺结核合并慢性乙肝患者临床治疗的一大难题[3]。中医药在治疗肺结核及慢性乙肝中积累了大量经验[4-5],复方益肝灵片具有解毒祛湿、益肝滋肾之功效,常用于慢性肝炎患者的临床治疗[6];替诺福韦则能够有效抑制乙型肝炎病毒(HBV)的复制过程,减轻机体的炎症反应[7]。本次研究旨在探讨复方益肝灵片联合替诺福韦对肺结核合并慢性乙肝患者肝肾功能、肝纤维指标及HBV-DNA 转阴率的影响,为肺结核合并慢性乙肝患者临床科学用药提供一定的理论依据。
1 材料与方法
1.1 一般资料
选取2017 年1 月至2019 年1 月在秦皇岛市第二医院诊断初治肺结核抗酸染色阳性的合并慢性乙肝携带者HBV-DNA 阳性、既往未曾服用抗病毒药物患者120 例,通过随机数表法分为三组,各40 例。A 组:男23 例,女17 例,年龄(42.51 ± 3.63)岁;B 组:男21 例,女19 例,年龄(41.86 ± 3.54)岁;C 组:男20 例,女20 例,年龄(42.33 ± 3.67)岁。对三组患者乙肝携带病史、肺结核病史等一般资料进行分析比较,结果无明显差异(P >0.05)。诊断标准:肺结核诊断参考《中国结核病防治规划实施工作指南(2008 年版)》[8],慢性HBV 携带者诊断参考《慢性乙型肝炎防治指南(2010 年版)》[9]。纳入标准:(1)HBSAg 阳性且HBV-DNA 阳性,符合初治痰抗酸染色阳性,胸部CT 提示肺结核;(2)未曾使用抗病毒药物治疗;(3)成年患者年龄<60 岁;(4)自愿加入本次研究。排除标准:(1)合并肝癌、肝硬化等其它肝病;(2)近6 个月内使用过抗病毒或损肝药物;(3)合并其它严重的系统性疾病;(4)严重酗酒。本研究经本院伦理委员会批准,并已获得所有被纳入研究患者的同意。
1.2 方法
所有患者均采用2HRZE/4HR 化疗方案[10],治疗周期为6 个月。前2 个月采用异烟肼(国药准字:H14022402,生产批号:180914,山西汾河制药有限公司),每日300 mg;利福平(国药准字:H44020771,生产批号:180902,广东华南药业集团有限公司),每日450 mg;乙胺丁醇(国药准字:H44020758,生产批号:181003,广东华南药业集团有限公司),每日750 mg;吡嗪酰胺(国药准字:H32023303,生产批号:180624,常州制药厂有限公司),每日1 500 mg。后4 个月服用异烟肼与利福平,剂量同上,每周3 次。治疗期间采用葡醛内酯(国药准字:H14020789,生产批号:180722,山西云鹏制药有限公司)护肝,必要时采用双环醇(国药准字:H20040467,生产批号:181106,北京协和药厂)、异甘草酸镁(国药准字:H20051942,生产批号:181220,正大天晴药业集团股份有限公司)加强护肝,患者出现严重肝损害时必须替换治疗方案,并采用阿米卡星(国药准字:H32021407,生产批号:181216,江苏吴中医药集团有限公司苏州制药厂)、左氧氟沙星[国药准字:H20000655,生产批号:181004,第一三共制药(北京)有限公司]等药物辅助化疗。B 组在A 组的基础上加用复方益肝灵片(国药准字:Z22025133,生产批号:180527,吉林紫鑫药业股份有限公司)进行治疗,每次84 mg,每日3 次。C 组在B 组的基础上加用替诺福韦[批准文号:H20130589,生产批号:170623,Aspen Port Elizabeth(Pty) Ltd.],每次300 mg,每日1 次。三组患者均随访6 个月。
1.3 观察指标
(1)肝功能损害:参考《肺结核中西医诊断治疗学》[11],40 U/L <ALT ≤120 U/L 或38 μmol/L <TBIL ≤57 μmol/L 记 为 轻 度 损 害;120 U/L <ALT ≤200 U/L 或57 μmol/L < TBIL ≤ 95 μmol/L 记为 中 度 损 害;ALT >200 U/L 或TBIL >95 μmol/L记为重度损害。(2)肝功能指标:采用C-8000 型全自动生化分析仪(美国雅培)检测患者肝肾功能评估患者肝肾功能受损情况及丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总胆红素(TBIL)水平。(3)肝纤维指标检测:采用Architecti2000SR型全自动免疫分析仪(美国雅培)检测血清透明质酸(HA)、Ⅲ型前胶原氨基末端肽(P ⅢNP)、Ⅳ型胶原(Ⅳ-C)、层黏蛋白(LN)水平。(4)免疫指标检测:采用CytoFLEX 型流式细胞仪(贝克曼库尔特公司)通过酶联免疫吸附法检测患者治疗前与治疗6 个月后T 淋巴细胞亚群CD4+、CD8+与CD4+/CD8+比值。(5)血清细胞因子水平检测:采用酶联免疫吸附法检测血清肿瘤坏死因子(TNF-α)、白细胞介素2(IL-2)、白细胞介素6(IL-6)水平,试剂盒均购自上海晶抗生物工程有限公司(TNF-α:JKSJ-1857;IL-2:JKSJ-2035;IL-6:JKSJ-2176)。(6)采 用 胸 部CT检查患者病灶吸收情况,具体参考《肺结核诊断和治 疗 指 南》[12];CSY-ZW 型HBV-DNA 定 量 检 测采用荧光定量PCR 检测系统(深圳市芬析仪器制造有限公司),试剂盒购自安徽达健医学科技有限公司(TGFQ01-002);通过痰涂片检测患者痰菌转阴情况。
1.4 统计学方法
用SPSS 21.0 软件进行数据分析,计量资料以均数 ± 标准差(±s)表示,多组间比较采用方差分析,多组间两两比较采用SNK 法。计数资料以例与百分数[n (%)]表示,采用χ2检验与秩和检验。以P <0.05为差异具有统计学意义。
2 结果与分析
2.1 三组患者肝、肾功能损害情况比较
采用秩和检验对三组患者肝功能损害程度进行对比分析,结果发现C 组患者肝功能损害程度明显轻于A 组(Z = 2.276,P = 0.017);各组肾功能损害情况比较,差异无统计学意义(P >0.05),见表1、2。
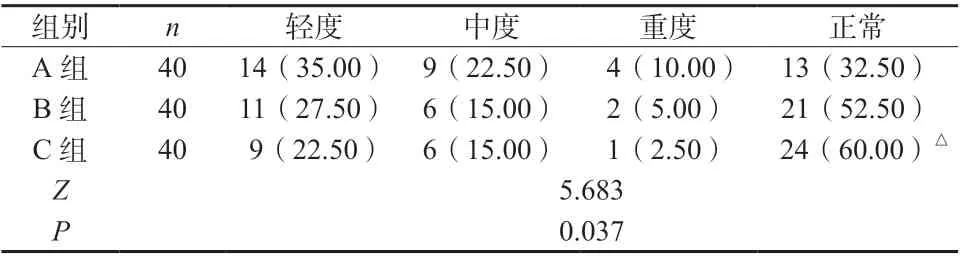
表1 三组患者肝功能损害情况比较[n(%)]Tab. 1 Comparison of liver function impairment among the three groups [n (%)]
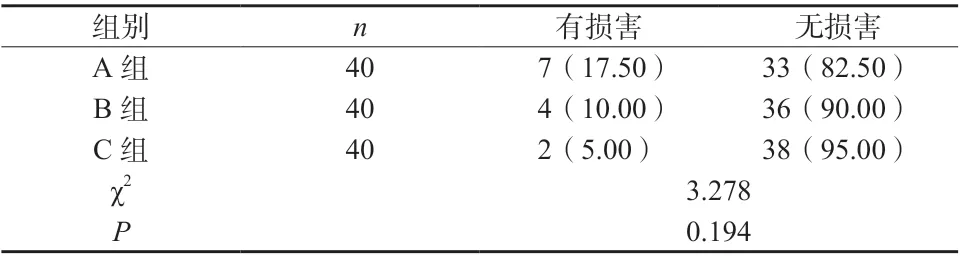
表2 三组患者肾功能损害情况比较[n(%)]Tab. 2 Comparison of renal impairment among the three groups [n (%)]
2.2 三组患者肝功能指标比较
治疗前,三组患者肝功能各指标水平比较均无明显差异(P >0.05);治疗后,C 组ALT、AST、TBIL水平均明显低于A、B两组(ALT:qAC=33.230,P <0.05;qBC=19.078,P <0.05;AST:qAC=40.884,P <0.05;qBC=26.749,P <0.05;TBIL:qAC=24.609,P <0.05;qBC=9.736,P <0.05),B 组ALT、AST、TBIL 水平均明显低于A 组(ALT:qAB= 14.152,P <0.05;AST:qAB=14.135,P <0.05;TBIL:qAB=14.873, P <0.05),差异具有统计学意义,见表3。
表3 三组患者肝功能指标比较(±s)Tab. 3 Comparison of liver function indexes among the three groups(±s)
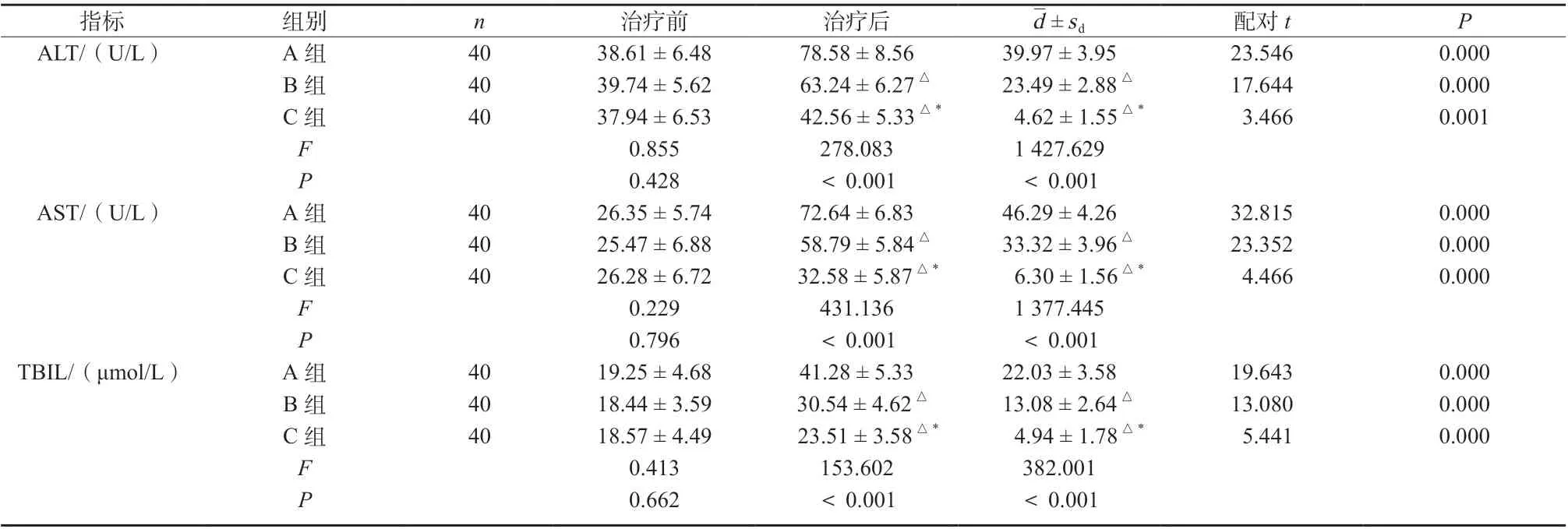
表3 三组患者肝功能指标比较(±s)Tab. 3 Comparison of liver function indexes among the three groups(±s)
注:与A 组比较,△P <0.05; 与C 组比较,*P <0.05
d±sd 配对t P ALT/(U/L) A 组 40 38.61 ± 6.48 78.58 ± 8.56 39.97 ± 3.95 23.546 0.000 B 组 40 39.74 ± 5.62 63.24 ± 6.27△ 23.49 ± 2.88△ 17.644 0.000 C 组 40 37.94 ± 6.53 42.56 ± 5.33△* 4.62 ± 1.55△* 3.4 0.855 278.083 1 427.629 0.428 <0.001 <0.001 26.35 ± 5.74 72.64 ± 6.83 46.29 ± 4.26 32.8 25.47 ± 6.88 58.79 ± 5.84△ 33.32 ± 3.96△ 23.3 26.28 ± 6.72 32.58 ± 5.87△* 6.30 ± 1.56△* 4.4 0.229 431.136 1 377.445 0.796 <0.001 <0.001 19.25 ± 4.68 41.28 ± 5.33 22.03 ± 3.58 19.6 18.44 ± 3.59 30.54 ± 4.62△ 13.08 ± 2.64△ 13.0 18.57 ± 4.49 23.51 ± 3.58△* 4.94 ± 1.78△* 5.4 0.413 153.602 382.001 0.662 <0.001 <0.001 66 0.001 F P AST/(U/L) A 组 40 15 0.000 B 组 40 52 0.000 C 组 40 66 0.000 F P TBIL/(μmol/L) A 组 40 43 0.000 B 组 40 80 0.000 C 组 40 41 0.000 F P指标 组别 n 治疗前 治疗后
2.3 三组患者肝纤维指标比较
治疗前,三组患者肝纤维各项指标比较均无明显差异(P >0.05);治疗后,C 组HA、P ⅢNP 均明显低于A、B 两组(HA:qAC= 8.952,P <0.05;qBC=3.968,P <0.05;P ⅢNP:qAC= 14.926,P <0.05;qBC= 9.999,P <0.05);Ⅳ-C、LN 水平均明显低于A 组(Ⅳ-C:qAC= 5.376,P <0.05;LN:qAC= 6.381,P <0.05);B 组HA、P ⅢNP、LN 水平均明显低于A 组(HA:qAB= 4.984,P <0.05;P ⅢNP:qAB= 4.927,P <0.05;LN:qAB= 3.892,P <0.05),两组Ⅳ-C水平比较,差异无统计学意义(P >0.05),见表4。
表4 三组患者肝纤维指标比较(±s,μmol/L)Tab. 4 Comparison of liver fiber indexes among the three groups(±s,μmol/L)
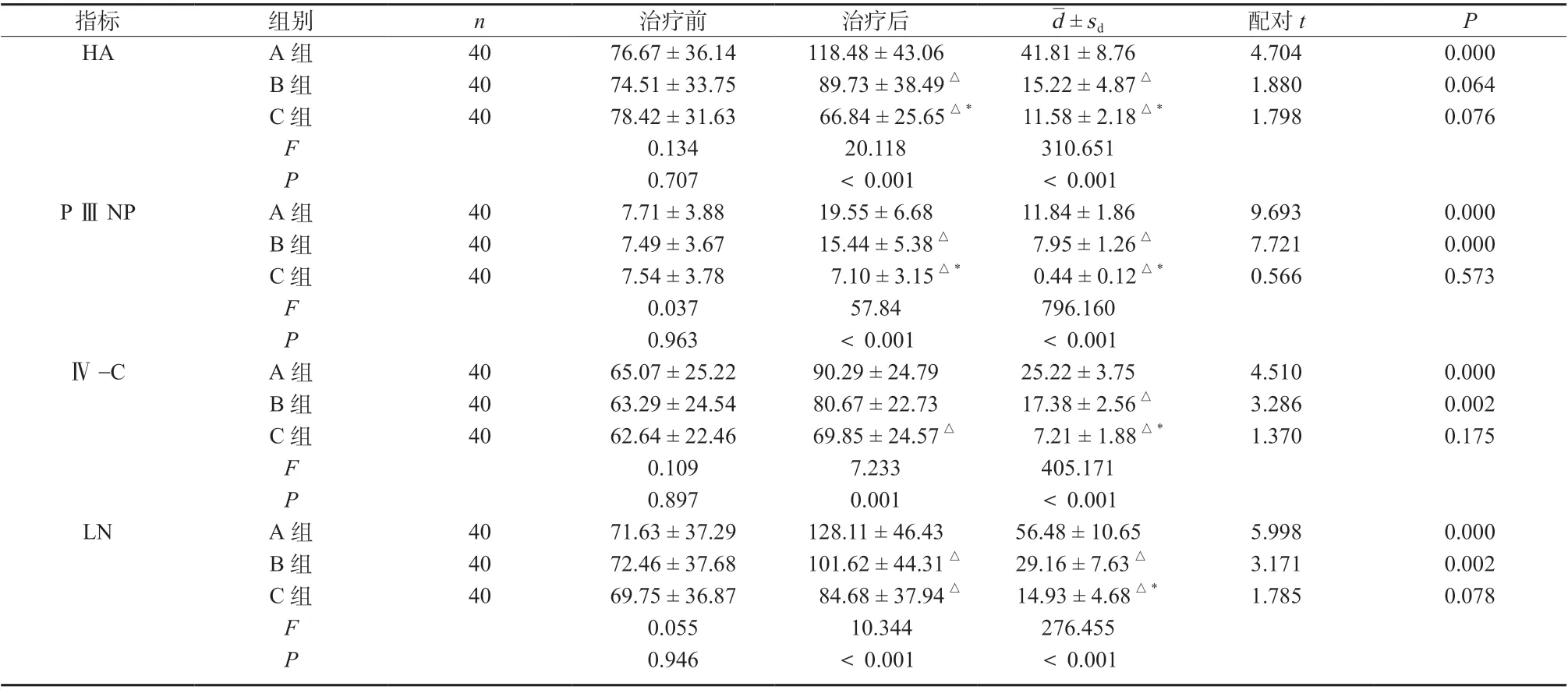
表4 三组患者肝纤维指标比较(±s,μmol/L)Tab. 4 Comparison of liver fiber indexes among the three groups(±s,μmol/L)
注:与A 组比较,△P <0.05; 与C 组比较,*P <0.05
d±sd 配对t P HA A 组 40 76.67 ± 36.14 118.48 ± 43.06 41.81 ± 8.76 4.704 0.000 B 组 40 74.51 ± 33.75 89.73 ± 38.49△ 15.22 ± 4.87△ 1.880 0.064 C 组 40 78.42 ± 31.63 66.84 ± 25.65△* 11.58 ± 2.18△* 1.798 0.076 F 0.134 20.118 310.651 0.707 <0.001 <0.001 7.71 ± 3.88 19.55 ± 6.68 11.84 ± 1.86 77..45 94±±33..67 78 1 5 7..4140±± 53..3185△△*70..9454 ±± 10..2162△△*0.037 57.84 796.160 0.963 <0.001 <0.001 65.07 ± 25.22 90.29 ± 24.79 25.22 ± 3.75 63.29 ± 24.54 80.67 ± 22.73 17.38 ± 2.56△62.64 ± 22.46 69.85 ± 24.57△ 7.21 ± 1.88△*0.109 7.233 405.171 0.897 0.001 <0.001 71.63 ± 37.29 128.11 ± 46.43 56.48 ± 10.65 72.46 ± 37.68 101.62 ± 44.31△ 29.16 ± 7.63△69.75 ± 36.87 84.68 ± 37.94△ 14.93 ± 4.68△*0.055 10.344 276.455 0.946 <0.001 <0.001 P P ⅢNP A 组 40 9.693 0.000 B 组 40 7.721 0.000 C 组 40 0.566 0.573 F PⅣ-C A 组 40 4.510 0.000 B 组 40 3.286 0.002 C 组 40 1.370 0.175 F P LN A 组 40 5.998 0.000 B 组 40 3.171 0.002 C 组 40 1.785 0.078 F P指标 组别 n 治疗前 治疗后
2.4 三组患者免疫功能指标比较
治疗前,三组患者CD4+、CD8+、CD4+/CD8+比值比较,差异无统计学意义(P >0.05);治疗后,B、C 组CD4+、CD4+/CD8+比值明显高于A 组(P <0.05);B、C组CD8+水平明显低于A组(qAB= 3.035, P <0.05;qAC= 5.259,P <0.05),差异具有统计学意义,见表5。
表5 三组患者免疫功能指标比较(±s)Tab. 5 Comparison of immune function indicators among the three groups(±s)
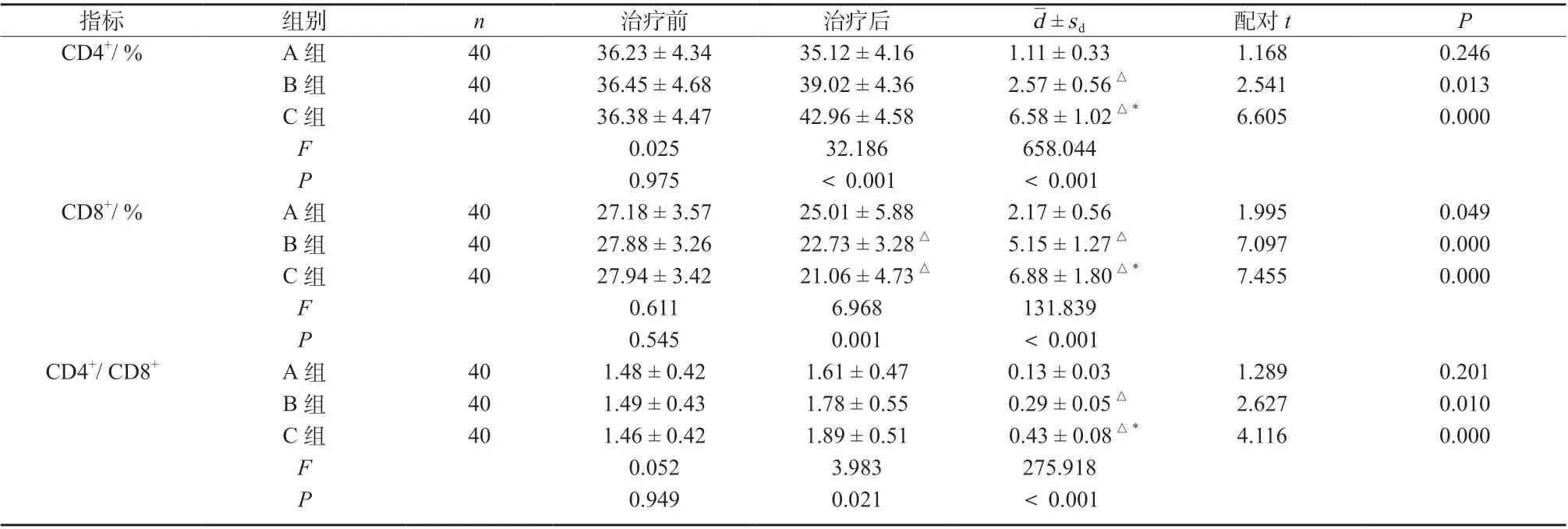
表5 三组患者免疫功能指标比较(±s)Tab. 5 Comparison of immune function indicators among the three groups(±s)
注:与A 组比较,△P <0.05; 与C 组比较,*P <0.05
d±sd 配对t P CD4+/ % A 组 40 36.23 ± 4.34 35.12 ± 4.16 1.11 ± 0.33 1.168 0.246 B 组 40 36.45 ± 4.68 39.02 ± 4.36 2.57 ± 0.56△ 2.541 0.013 C 组 40 36.38 ± 4.47 42.96 ± 4.58 6.58 ± 1.02△* 6.605 0.000 F 0.025 32.186 658.044 0.975 <0.001 <0.001 27.18 ± 3.57 25.01 ± 5.88 2.17 ± 0.56 27.88 ± 3.26 22.73 ± 3.28△ 5.15 ± 1.27△27.94 ± 3.42 21.06 ± 4.73△ 6.88 ± 1.80△*0.611 6.968 131.839 0.545 0.001 <0.001 1.48 ± 0.42 1.61 ± 0.47 0.13 ± 0.03 1.49 ± 0.43 1.78 ± 0.55 0.29 ± 0.05△1.46 ± 0.42 1.89 ± 0.51 0.43 ± 0.08△*0.052 3.983 275.918 0.949 0.021 <0.001 P CD8+/ % A 组 40 1.995 0.049 B 组 40 7.097 0.000 C 组 40 7.455 0.000 F P CD4+/ CD8+ A 组 40 1.289 0.201 B 组 40 2.627 0.010 C 组 40 4.116 0.000 F P指标 组别 n 治疗前 治疗后
2.5 三组患者血清细胞因子水平比较
治疗前,三组患者血清TNF-α、IL-2、IL-6 水平比较均无明显差异(P >0.05);治疗后,三组患者TNF-α、IL-6 水平有所降低,IL-2 水平相对升高。C 组TNF-α、IL-6 水平明显低于A、B 两组(TNF-α:qAC= 6.941,P <0.05;qBC= 3.698,P <0.05;IL-6:qAC= 9.907,P <0.05;qBC= 6.927;P <0.05),B 组TNF-α、IL-6 水平明显低于A 组(TNF-α:qAB= 3.243,P <0.05;IL-6:qAB= 2.980,P <0.05),差异具有统计学意义,见表6。
2.6 三组患者治疗情况比较
B、C 组病灶吸收率、HBV 转阴率、痰菌转阴率均明显高于A 组,结核耐药率均明显低于A 组,差异具有统计学意义,见表7。
3 讨论
肝纤维化是指机体在HBV 的长期侵害之下,肝细胞外基质成分过度增生,导致肝脏组织出现循环障碍、炎性细胞浸润并诱导肝细胞变性导致弥散性肝纤维组织增生的一种病理过程,阻碍肝纤维化进程甚至使之逆转是治疗肝纤维化的关键。有研究指出[13-14],替诺福韦与其它抗病毒药物在抑制肝纤维化方面的效果类似,均存在一定的局限性。
表6 三组患者血清细胞因子水平比较(±s,μmol/L)Tab. 6 Comparison of serum cytokine levels among the three groups(±s,μmol/L)
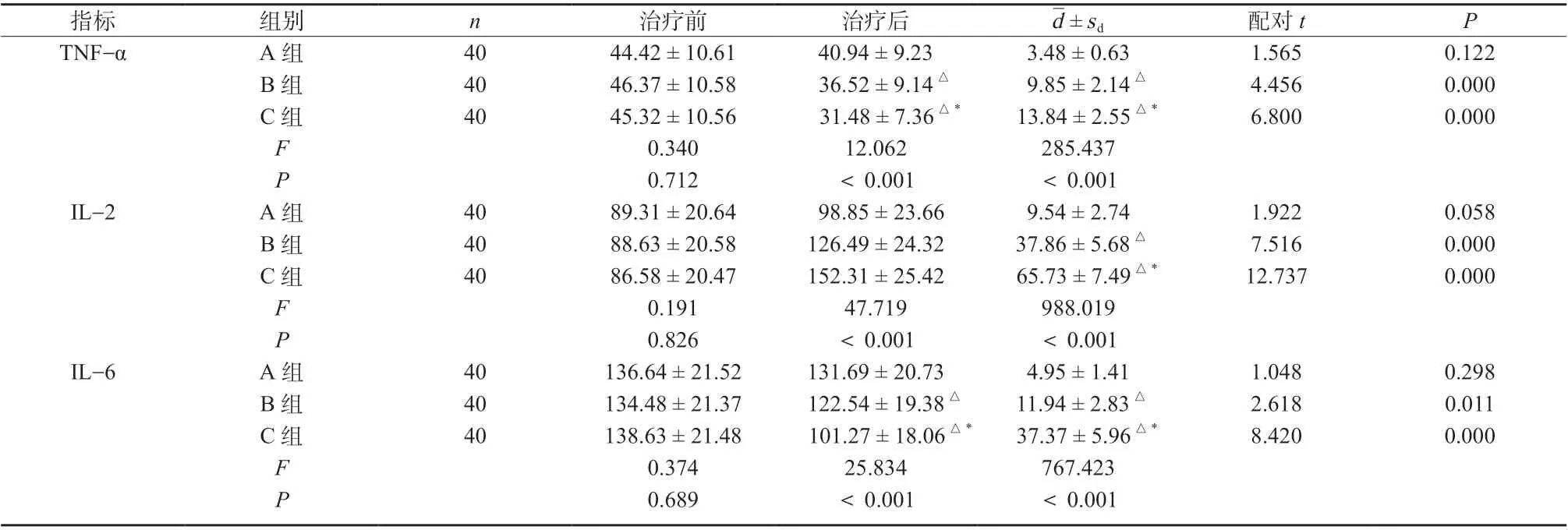
表6 三组患者血清细胞因子水平比较(±s,μmol/L)Tab. 6 Comparison of serum cytokine levels among the three groups(±s,μmol/L)
注:与A 组比较,△P <0.05; 与C 组比较,*P <0.05
d±sd 配对t P TNF-α A 组 40 44.42 ± 10.61 40.94 ± 9.23 3.48 ± 0.63 1.565 0.122 B 组 40 46.37 ± 10.58 36.52 ± 9.14△ 9.85 ± 2.14△ 4.456 0.000 C 组 40 45.32 ± 10.56 31.48 ± 7.36△* 13.84 ± 2.55△* 6.800 0.000 F 0.340 12.062 285.437 0.712 <0.001 <0.001 89.31 ± 20.64 98.85 ± 23.66 9.54 ± 2.74 88.63 ± 20.58 126.49 ± 24.32 37.86 ± 5.68△86.58 ± 20.47 152.31 ± 25.42 65.73 ± 7.49△*0.191 47.719 988.019 0.826 <0.001 <0.001 136.64 ± 21.52 131.69 ± 20.73 4.95 ± 1.41 11 33 48..46 83±±22 11..34 78 1120 21..5247±± 1198..3086△△*1317..9347 ±± 25..8936△△*0.374 25.834 767.423 0.689 <0.001 <0.001 P IL-2 A 组 40 1.922 0.058 B 组 40 7.516 0.000 C 组 40 12.737 0.000 F P IL-6 A 组 40 1.048 0.298 B 组 40 2.618 0.011 C 组 40 8.420 0.000 F P指标 组别 n 治疗前 治疗后
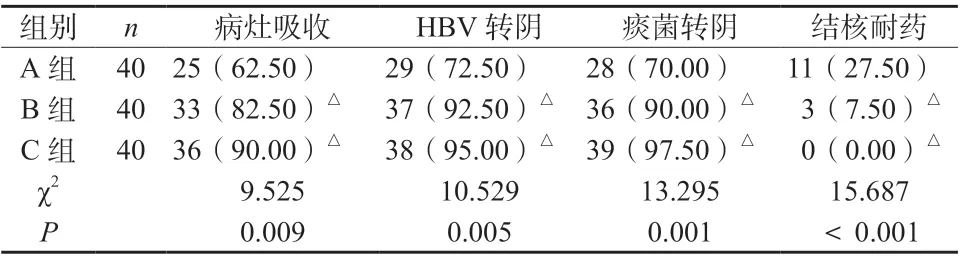
表7 三组患者治疗情况比较[n (%)]Tab. 7 Comparison of treatment among the three groups [n (%)]
有研究指出[15-16],肝纤维化与细胞免疫有密切关联,改善患者的肝功能能够有效延缓肝纤维化的疾病进程,避免肝硬化等症状的发生。HA、P ⅢNP、Ⅳ-C 与LN 是反映肝细胞外基质代谢的重要指标,其水平变化情况能有效反映肝纤维化程度。本研究结果显示,复方益肝灵片联合替诺福韦能有效改善患者肝功能,正性调节HA、P ⅢNP、Ⅳ-C 与LN 水平,延缓肝纤维化进程。
ALT、AST、TBIL 是肝功能损伤的重要观察指标,肝功能受损时,ALT 会大量释放到血液之中, AST 也会从线粒体中释放出来,导致二者在血清中的含量明显上升。肝细胞是TBIL 转化的场所,肝细胞损伤可导致其转化过程受阻,使其在血液中大量积聚。通常情况下,T 淋巴细胞亚群各细胞水平处于动态平衡状态,其中CD4+介导免疫反应,用于抵御各种不良刺激,CD8+抑制免疫。一旦CD4+/CD8+比值失衡,CD8+水平上调,CD4+水平下降,机体对于病原菌侵害能力减弱,肝细胞就更容易受到HBV 的损害[17]。在免疫应答过程中,辅助性T 细胞释放的IL-6 会促进HBV 感染,加速肝纤维化进程;TNF-α 则会参与病理过程,扩大炎症反应;IL-2 则可介导免疫反应,促进B 细胞的增殖分化过程[18]。本研究结果显示,复方益肝灵片联合替诺福韦能有效改善患者肝功能、提高患者机体免疫功能。对比各组病灶吸收率、HBV 转阴率、痰菌转阴率及结核耐药情况可知,复方益肝灵片联合替诺福韦可以显著提高结核合并慢性乙肝患者的临床治疗效果,控制患者的疾病进程。
4 结论
复方益肝灵片联合替诺福韦可以通过调节T 淋巴细胞亚群各细胞动态平衡改善患者的免疫功能,下调患者血清TNF-α、IL-2、IL-6 等炎性细胞因子水平减轻机体的炎症反应,从而改善患者肝功能,下调肝纤维化指标表达水平,减轻肝纤维化症状,提高HBV-DNA 的转阴率,且药物联用可以降低患者的结核耐药率,具有较高的临床应用价值。

