miR-193a-5p靶向VASP干扰PI3K/AKT信号通路抑制胃癌细胞增殖和诱导细胞凋亡的机制研究
殷玉敬,高 辉,岳 林,杨文涛,薛丽英
胃癌是多因素参与的复杂病变过程,是人类常见的恶性肿瘤[1-2]。miRNA可参与多种信号通路调节,通过激活或抑制相关信号通路影响胃癌细胞的增殖、侵袭、转移、凋亡等生物学功能,与胃癌的发生发展密切相关。miR-193a-5p在肺癌、膀胱癌、食管鳞状细胞癌等癌症中显著下调[3]。Xiao等[4]证实miR-193a-5p作为抑癌miRNA已被用于胃间质瘤的诊治靶点研究。PI3K/AKT信号通路活化可以抑制多种刺激诱发胃癌细胞凋亡,促进细胞周期进展、血管生成和转移[5]。VASP是一种和肌动蛋白调节相关的多功能蛋白,研究表明miR-4455通过下调VASP可抑制PI3K/AKT信号通路活化,进而抑制胃癌细胞增殖、迁移和侵袭[6]。通过生物信息学分析发现VASP可能是miR-193a-5p的靶基因,但miR-193a-5p是否靶向VASP调控PI3K/AKT信号通路,进而影响胃癌细胞增殖和凋亡尚不清楚。因此,本研究旨在探讨miR-193a-5p对胃癌细胞增殖和凋亡的影响,并分析VASP和PI3K/AKT信号通路的潜在作用,以期为治疗胃癌提供有价值的靶点。
1 材料与方法
1.1细胞和主要试剂 人胃黏膜上皮细胞株GES-1购自美国细胞培养收藏中心;人胃癌细胞株BGC-823和SGC7901购自中国科学院上海细胞研究所。DMEM培养基、RPMI-1640培养基、青霉素、链霉素购于Hyclone公司,胎牛血清购于Gibco公司,CCK-8试剂和胰蛋白酶购于Sigma公司,miRNeasy Mini Kit试剂盒、miRNAeasy提取试剂盒购于Qiagen公司,RT-qPCR购于宝生物工程(大连)有限公司,miR-NC、miR-193a-5p mimics、anti-miR-193-5p购于上海拓然生物科技有限公司。VASP干扰RNA和对照干扰RNA均由上海生物工程有限公司合成构建。RIPA裂解液、结晶紫染色液、BCA试剂盒、ECL化学发光试剂盒、辣根过氧化酶标记的二抗均购于碧云天公司,p-PI3K、PI3K、p-AKT、AKT、β-actin一抗购于美国CST公司,pcDNA3.1空载体、VASP过表达载体pcDNA3.1-VASP由上海吉玛生物科技有限公司合成构建,LipofectamineTM2000购于赛默飞公司。荧光素酶报告基因检测试剂盒购于美国Promega公司。Annexin V/PI细胞凋亡试剂盒购于BD生物科学公司。所有引物由上海铂尚生物科技有限公司设计合成。
1.2主要方法
1.2.1胃癌组织标本:采用胃癌患者60例的石蜡包埋标本,其中男37例,女23例;年龄32~80岁,中位年龄54岁;病理分期:早期14例,中晚期46例;分化程度:高分化13例,中分化28例,低分化19例。所有患者术前未接受过放化疗。本研究经我院医学伦理委员会批准,且患者知情并签署知情同意书。
1.2.2细胞培养与转染:人胃黏膜上皮细胞株GES-1常规培养于DMEM培养基中,内含10%胎牛血清、1.5×105U/L青霉素及50 mg/L链霉素;人胃癌细胞株BGC-823和SGC7901培养于RPMI-1640培养基中,内含10%胎牛血清、1.0×105U/L青霉素及100 mg/L链霉素。所有细胞置于37℃、5%二氧化碳的恒温培养箱中培养。待BGC-823和SGC7901细胞生长至80%融合度,以适当密度接种至6孔细胞板中,按照LipofectamineTM2000转染试剂使用说明将转染miR-193a-5p mimics(miR-193a-5p)、转染anti-miR-193a-5p(anti-miR-193a-5p)、转染VASP干扰RNA(si-VASP)、共转染miR-193a-5p mimics和pcDNA3.1-VASP(miR-193a-5p+VASP)转染至细胞,同时转染无义序列或空载体作为阴性对照组(NC组)。
1.2.3RT-qPCR检测miRNA和mRNA表达:按照实验要求将60例胃癌组织、癌旁组织及GES-1、BGC-823、SGC7901细胞根据Trizol试剂说明提取细胞或组织中总RNA,使用miRNAeasy提取试剂盒提取miRNA。使用M-MLV逆转录酶以总RNA为模板逆转录成cDNA。MiR-193a-5p和U6引物来源于MicroRNA RT-qPCR试剂盒。以U6和β-actin为内参,计算miRNA和mRNA的相对表达水平。β-actin引物为:β-actin-F:5'-GGACCTGACTGACTACCTC-3',β-actin-R:5'-TACTCCTGCTTGCTGAT-3'。
1.2.4CCK-8法检测细胞增殖:将转染后细胞以每孔4×103个的密度接种至96孔细胞板中,每孔加10%胎牛血清的RPMI-1640培养基,每6孔为一组,分别于培养24、48、72和96 h时加入CCK-8溶液10 μl,置于37℃、5%二氧化碳培养箱中继续培养2 h,采用酶标仪检测各组细胞在450 nm波长处的吸光度值。取每天6孔平均值绘制细胞生长曲线。
1.2.5流式细胞术检测细胞凋亡率:收集各组转染48 h后的BGC-823和SGC7901细胞,并以1×109/L的浓度将细胞重悬于磷酸盐缓冲溶液中,加Annexin V 5 μl和PI 5 μl室温避光孵育15 min后,使用Accurri C6流式细胞仪检测各组细胞凋亡情况,检测结果使用FlowJo 7.6.2软件分析,实验重复3次。
1.2.6双荧光素酶报告基因实验检测miR-193a-5p与VASP的靶向作用关系:生物信息学TargetScan软件预测miR-193a-5p与VASP-3'-UTR结合位点。参照转染试剂说明书将构建好的野生型VASP-3'-UTR-WT和突变型VASP-3'-UTR-WT的荧光素酶报告质粒及miR-con、miR-193a-5p mimics转染至BGC-823和SGC7901细胞,6 h后换新鲜培养液并继续培养24 h,按照双荧光素酶报告基因实验试剂盒操作步骤检测各组细胞荧光素酶活性,实验重复3次。
1.2.7Western blot检测蛋白表达:收集胃癌组织和癌旁组织研磨液、胃癌细胞BGC-823和SGC7901,用细胞裂解液提取总蛋白,BCA试剂盒检测细胞中的总蛋白浓度。取20 μg变性蛋白上样行10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳。采用湿转法将蛋白凝胶转至聚偏二氟乙烯(PVDF)膜后,置于含5%去脂奶粉的封闭液中4℃孵育过夜。以PBST洗膜后,再在4℃下将PVDF膜转入1︰2000稀释的一抗(VASP、p-PI3K、PI3K、p-AKT、AKT)中反应过夜,经TBST洗膜后,加入1︰10 000稀释的二抗于37℃下孵育1 h后行化学发光显影,Image J分析目的条带的灰度值,以β-actin为内参,以目的条带灰度值与β-actin灰度值的比值表示目的蛋白的表达情况。
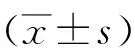
2 结果
2.1miR-193a-5p在胃癌组织和胃癌细胞BGC-823、SGC7901中的表达 以60例胃癌匹配癌旁组织和人胃黏膜上皮细胞株GES-1为对照,RT-qPCR检测发现,60例胃癌组织和胃癌细胞BGC-823、SGC7901中miR-193a-5p的表达均显著下调,且BGC-823细胞中表达下调更为显著,差异有统计学意义(P<0.05)。见图1。
2.2miR-193a-5p对胃癌细胞生长活力和凋亡的影响 通过瞬时转染技术,在胃癌细胞BGC-823和SGC7901中上调或下调miR-193a-5p表达,采用RT-qPCR检测其在BGC-823和SGC7901细胞中的转染效果。结果显示,与NC组相比,miR-193a-5p组miR-193a-5p表达显著升高,anti-miR-193a-5p组显著降低,差异有统计学意义(P<0.05)。见图2。CCK-8法检测BGC-823和SGC7901细胞生长活力,结果显示,与NC组相比,miR-193a-5p组细胞生长活力明显降低,anti-miR-193a-5p组细胞生长活力显著提高,差异有统计学意义(P<0.05)。见图3。流式细胞术检测细胞凋亡,结果表明miR-193a-5p可使BGC-823和SGC7901细胞的凋亡率显著升高,而anti-miR-193a-5p组的细胞凋亡率呈现降低趋势,差异有统计学意义(P<0.05)。见图4。上述结果表明, miR-193a-5p过表达能够抑制胃癌细胞的增殖,同时诱导其凋亡。

图2 RT-qPCR检测BGC-823、SGC7901细胞中miR-193a-5p转染效果
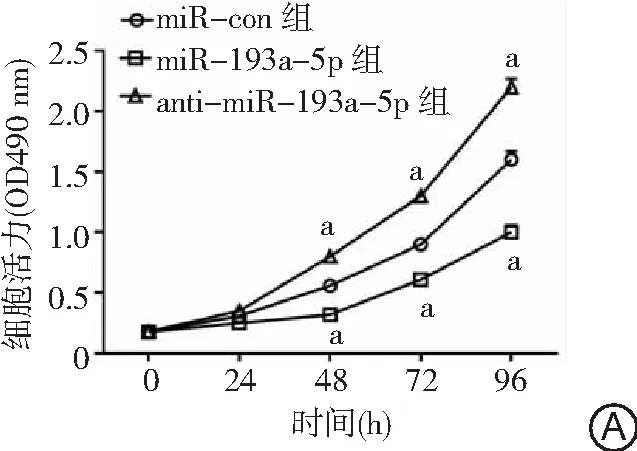
图3 CCK-8法检测BGC-823和SGC7901细胞增殖率

图4 流式细胞术检测BGC-823和SGC7901细胞凋亡率
2.3VASP与miR-193a-5p的靶向作用关系 通过TargetScan对miR-193a-5p和VASP结合进行预测,示意图见图5。双荧光素酶报告基因实验结果显示,miR-193a-5p能够明显降低VASP-3'UTR-WT的荧光素酶活性(P<0.05),而不影响VASP-3'UTR-MUT的荧光素酶活性(P>0.05),见图6A和B;miR-193a-5p过表达可负调控BGC-823和SGC7901细胞中VASP蛋白表达(P<0.05),而anti-miR-193a-5p使VASP蛋白表达显著上调(P<0.05),见图6C和D。提示VASP是miR-193a-5p的靶基因。

图5 miR-193a-5p与VASP的3'UTR结合位点示意图

图6 VASP与miR-193a-5p的靶向作用关系
2.4VASP对胃癌细胞增殖和凋亡的影响 RT-qPCR和Western blot法检测发现,与癌旁组织相比,胃癌组织VASP mRNA和蛋白的表达显著上调(P<0.05),见图7,这与miRNA-193a-5p在胃癌组织中的表达相反,二者呈负相关(图8)。转染si-VASP后,BGC-823和SGC7901细胞中的mRNA和蛋白水平均显著下调(P<0.05),见图9。CCK-8法检测细胞生长活力,结果显示si-VASP转染后,细胞生长活力较si-con组显著降低,细胞凋亡率显著升高,差异有统计学意义(P<0.05);反之转染pcDNA3.1-VASP细胞使VASP蛋白过表达,细胞增殖显著增加且细胞凋亡率显著降低,差异有统计学意义(P<0.05)。见图10。提示VASP可促进BGC-823和SGC7901细胞的增殖和诱导其凋亡。

图7 RT-qPCR和Western blot检测胃癌组织中VASP的mRNA和蛋白表达
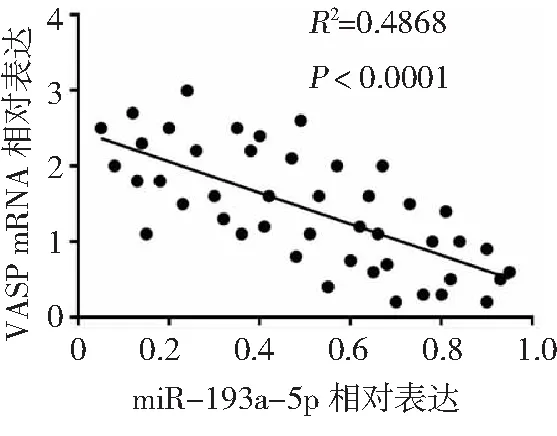
图8 胃癌组织中miR-193a-5p与VASP表达水平的相关性

图9 RT-qPCR和Western blot检测VASP转染效果
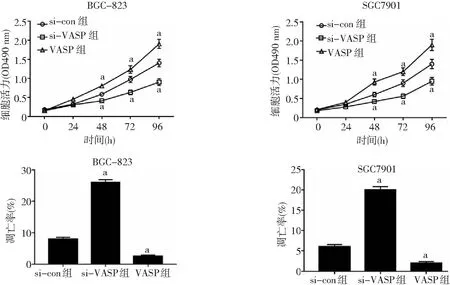
图10 CCK-8法检测BGC-823和SGC7901细胞的增殖
2.5miR-193a-5p对PI3K/AKT信号通路的影响 Western blot检测结果显示,与未转染的Ctrl组相比,miR-193a-5p组对BGC-823细胞中p-PI3K、p-AKT蛋白表达有明显抑制作用,而PI3K、AKT总蛋白表达变化不明显,miR-193a-5p+VASP组则恢复了miR-193a-5p对p-PI3K、p-AKT蛋白表达的抑制作用,差异有统计学意义(P<0.05)。见图11。表明miR-193a-5p可干扰PI3K/AKT信号通路的活化。

图11 miR-193a-5p抑制PI3K/AKT信号通路的活化
3 讨论
胃癌是全球最常见的消化道恶性肿瘤,具有较高的发病率和病死率。miR-193a-5p是miRNA家族中的一员,既往研究证实乳腺癌中miR-193a-5p表达降低,miR-193a-5p过表达显著抑制乳腺癌细胞的增殖和转移能力[7]。还有学者指出肝癌细胞miR-193a-5p过表达显著抑制肝癌细胞体外增殖和侵袭能力,促进细胞凋亡,并抑制体内肿瘤生长[8]。此外,干扰长链非编码RNA TTN-AS1对前列腺癌细胞凋亡起促进作用,分析原因与上调miR-193a-5p表达有关[9]。本研究结果发现与癌旁组织相比,癌组织miR-193a-5p表达显著下降;miR-193a-5p过表达则BGC-823和SGC7901细胞的生长活力明显下降,细胞凋亡率显著升高,而沉默miR-193a-5p则可使细胞生长活力提高,细胞凋亡率降低,这与Chou等[10]研究结论基本吻合。表明miR-193a-5p通过抑制胃癌细胞增殖和诱导凋亡参与胃癌的发生发展。
肿瘤细胞迁移能力与肿瘤的侵袭转移密切相关。VASP是和肌动蛋白调节相关的多功能蛋白,能调节细胞黏附和伸展过程中肌动蛋白重排,在细胞迁移过程中起重要作用[11]。Liu等[12]研究表明,缺氧可诱导VASP表达上调,并通过改变上皮间质转化表型和基质金属蛋白酶表达,在体内外激活AKT信号通路,促进肝癌细胞迁移和侵袭。Tian等[13]证实VASP表达增加与乳腺癌患者预后不良呈正相关,干扰VASP表达可抑制乳腺癌细胞迁移能力。有研究指出,miR-22、苦参碱抑制胃癌细胞增殖和侵袭作用与下调VASP表达相关[14-15]。本研究RT-qPCR和Western blot检测发现,与癌旁组织相比,胃癌组织VASP蛋白表达显著上调,而VASP过表达可提升胃癌细胞生长活力和降低细胞凋亡率,沉默VASP则相反,故VASP具有致癌功能。经TargetScan预测发现VASP可能是miR-193a-5p的靶基因,双荧光素酶报告基因实验进一步验证了VASP与miR-193a-5p的靶向作用关系;miR-193a-5p过表达可负调控BGC-823和SGC7901细胞中VASP蛋白表达,而anti-miR-193a-5p过表达则可显著上调VASP蛋白表达,证实VASP是miR-193a-5p的靶基因,且miR-193a-5p经调控VASP表达影响胃癌细胞增殖和凋亡。PI3K/AKT信号通路通过磷酸化作用激活或抑制下游靶蛋白,进而调节细胞增殖分化、转移、侵袭、凋亡和血管生成等,与多种癌症的发生发展有密切关系[16-20]。PI3K介导信号通路异常激活,可致AKT信号传导,最后使肿瘤细胞增殖和迁移[21-22]。p-AKT水平增加可致PI3K/AKT信号通路活化,促进肿瘤细胞生长、增殖,抑制肿瘤细胞凋亡[23-24]。
近年来研究发现,胃癌组织中PI3K/AKT信号通路上关键基因存在异常表达,同时该信号通路异常激活与肿瘤分化、淋巴结转移及预后密切相关[19,25-26]。据报道,干扰miR-92b表达可抑制PI3K-AKT信号通路,从而导致胃癌细胞增殖减少和细胞凋亡增加[27]。miR-150-3p、miR-21-5p等miRNA通过抑制PI3K/AKT信号通路抑制胃癌细胞增殖、迁移和侵袭[28-29]。但胃癌组织中miR-129a-5p、VASP和PI3K/AKT信号通路间的相关性仍未知。本研究发现miR-129a-5p对胃癌细胞BGC-823中p-PI3K、p-AKT蛋白表达有明显抑制作用,而VASP过表达显著减弱miR-129a-5p对p-PI3K、p-AKT的抑制作用;p-PI3K、p-AKT表达高低直接影响PI3K/AKT信号通路活性。表明miR-193a-5p通过靶向VASP干扰PI3K/AKT信号通路活化。故靶向miR-193a-5p/VASP途径进而阻断PI3K/AKT信号通路可能为胃癌治疗提供新思路。
综上,miR-193a-5p通过靶向VASP干扰PI3K/AKT信号通路,进而影响胃癌细胞的增殖和凋亡,具有抑癌作用。

