乳腺肿块为首发症状的直肠癌1例*
苑克慧 符珍敏 施彦坤 胡蓉蓉 黄江山 杨超 陈亮 王卉
患者女性,61岁。2019年7月自查发现左侧腋下及左侧乳腺痛性肿块,就诊于解放军总医院海南医院。查体:左侧腋窝触之多发结节、左侧乳腺外上象限一2 cm×2 cm结节,质硬,触之痛,活动度差,无乳头溢液,既往无乳腺相关病史,无乳腺癌家族史,一般情况良好。实验室检查:癌胚抗原(CEA)72.220 μg/L。超声提示:1)左侧乳腺不均质低回声区,考虑BI-RADS 4类;2)左侧腋下多发低回声结节及团块,考虑异常淋巴结,转移灶不除外。MRI提示:1)左侧乳腺外上象限斑片状长T2信号,DWI呈高信号,ADC值约为3.0×10-3mm2/s,增强扫描呈Ⅱ型曲线(平台型,图1);2)左侧腋窝多发约20 mm×28 mm 以下增大淋巴结影,DWI 呈明显高信号,ADC 值约为1.05×10-3mm2/s,增强扫描明显不均匀强化。全身PET/CT(图2)提示:1)左乳外上象限结节代谢未见明显升高,SUVmax:1.6;2)左侧锁骨上区、左侧腋窝、腹膜后多发形态异常淋巴结,伴异常高代谢,SUVmax:5.7。行超声引导下穿刺左侧乳腺2点及左侧腋下低回声结节,病理提示:左侧乳腺见多量坏死具有腺癌轮廓的实体组织(图3),免疫组织化学:CDX2(+)(图3A)、CK20(+)(图3B)、ER(-)、PR(-)、HER-2(0)、CK7(-)、Ki-67(+70%)。左侧腋窝淋巴结见中分化腺癌浸润伴坏死,考虑转移性腺癌(图4),胃肠道来源可能性大。再次追问病史,患者既往无排便节律及性状改变,无便血及腹痛症状,无肠癌家族史。鉴于病理提示胃肠道来源可能性大,回顾PET/CT 影像资料,结直肠肠壁代谢弥漫轻度增高,乙状结肠与直肠交界肠壁稍增厚伴代谢轻度增高,与其他肠壁生理性代谢相仿。建议患者行胃肠镜检查。胃镜未见明显异常。肠镜提示:距肛门18 cm直肠见一糜烂,大小约6 mm×6 mm,余结肠内未见异常结构。病理为腺癌,免疫组织化学:CDX2(+)(图5A)、CK20(+)(图5B)、Ki-67(+50%)。

图1 左侧乳腺病灶MRI增强曲线
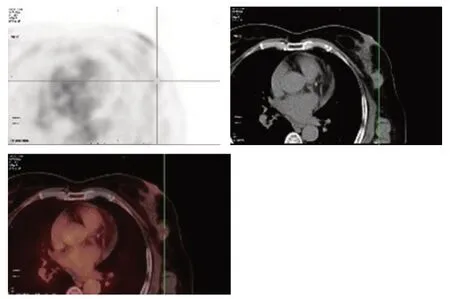
图2 左侧乳腺病灶PET/CT检测
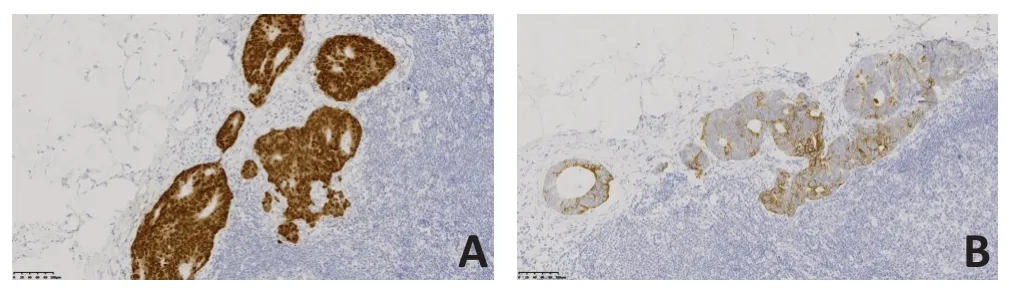
图3 左侧乳腺外上象限结节免疫组织化学检查

图4 左侧腋窝淋巴结(H&E×200)
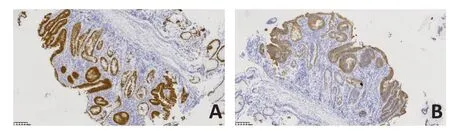
图5 患者免疫组织化学检查
经过多学科讨论,诊断直肠癌伴左侧乳腺及淋巴结转移,分期为ypTxNxM1 Ⅳ期、Duckes C 期,制定新辅助化疗方案,行一线6 周期贝伐珠单抗+XELOX(奥沙利铂+卡培他滨)方案治疗。治疗后复查:CEA 逐渐减低至正常值;全身PET/CT:左侧腋窝、颈根部、腹腔内淋巴结较前缩小,代谢明显减低;直肠病灶、左侧乳腺转移病灶范围较前相仿,代谢稍减低。评价为疾病稳定,并口服卡培他滨单药维持治疗1 周期后,行腹腔镜辅助下直乙交界处肠癌根治术,病理诊断为直肠溃疡型中分化腺癌,20%为黏液腺癌,部分为印戒细胞癌;大小10 mm×10 mm×10 mm,浸润肠壁全层,脉管未见癌栓;两侧切缘及环周切缘均未见癌;肠周淋巴结癌转移(1/7),腹腔内2、3、5组淋巴结癌转移(2/3)。免疫组织化学:Ki-67(+80%)、MSH6(+80%)、PDGFR-α(+)、CD34(血管+)、MSH2(+80%)、PMS2(+70%)、MLH1(+70%)、CEA(+)。行左侧乳腺切除及左侧腋窝淋巴结清扫术,术后病理可见乳腺组织呈灰白间灰黄色,局部稍粗糙,未见癌组织;腋窝淋巴结转移(12/17),其中3枚淋巴结伴坏死及钙化,形态符合直肠癌转移,免疫组织化学:CK20(部分+)、CDX2(+)、CK7(-)、Ki-67(+80%)。
结合病史、病理组织形态学特点以及免疫组织化学结果,明确诊断为直肠中分化腺癌,部分印戒细胞癌(cT3N1M1)Ⅳ期。术后1个月后腹部增强CT发现肝左外叶新增一枚类圆形稍低密度影,直径约5.6 mm,增强后呈弱对比强化,考虑转移癌。经多学科讨论,鉴于目前为晚期直肠癌多发转移,患者体能状态良好,二线治疗更换为静脉滴注贝伐珠单抗+FOL⁃FIRI(伊立替康+亚叶酸+氟尿嘧啶),目前已完成2 个周期治疗,疗效评价为疾病稳定。以左侧乳腺转移为首发症状随诊10个月余,患者状态尚可。
小结肺癌、黑色素瘤、淋巴瘤是乳腺转移最常见乳腺外原发肿瘤[1],而直肠癌乳腺转移鲜有报导,且途径尚未明确,推测有以下途径:1)随直肠淋巴回流至左、右腰干后汇入乳糜池回流至胸导管,汇入上腔静脉后进入体循环而致转移[2];2)随肠系膜上静脉进入门脉系统;3)从上痔静脉引流到门脉系统;后两者可经门静脉与肋间静脉的交通支到达乳腺组织[3]。直肠癌早期经淋巴途径转移为主,转移至不常见部位表明已发生广泛转移且预后不良[1]。
回顾文献概括直肠癌乳腺转移有以下特点:1)通常在生殖年龄组即35~45岁[4-5],女性多见。2)男性直肠癌乳腺转移发生率明显高于男性原发性乳腺癌[3]。3)异时性转移,乳腺转移距原发癌的时间多低于5年,在12 个月以内者占41%。4)极少数乳腺转移出现乳头溢液、皮肤橘皮样改变,多位于外上象限[6]。5)伴有同侧腋窝淋巴结受累。6)伴肝、肺转移。7)CEA常阳性。8)常见病理组织类型为黏液腺癌或印戒细胞癌,侵袭性高,多以低分化为主。
随着影像诊断方式不断丰富,超声及钼靶检查可作为筛查乳腺手段。对于进一步鉴别良恶性,MRI 动态增强扫描及联合DWI 发挥重要作用,动态增强曲线Ⅰ型(持续型)多为良性病变,Ⅱ型(平台型)、Ⅲ型(廓清型)恶性可能[7]。DWI中乳腺良性病变的ADC 值平均为1.335×10-3mm2/s,高于恶性病变平均ADC 值0.965×10-3mm2/s[8]。PET/CT 可反映大多恶性肿瘤及全身播散范围,在直肠癌术前评估与分期、预后评估、疗效监测中发挥重要作用[9]。回顾该患者PET/CT 图像,其转移淋巴结代谢明显增高,而对于原发病灶却无明显异常高代谢,这与原发部位肿瘤较小可能有关,且内含较多黏液成分时,会影响病灶代谢,出现PET/CT显像假阴性。乳腺转移临床表现与影像学表现无特异,常与原发性乳腺癌无法区分,病理诊断为金标准。原发性乳腺癌大多是CK7 阳性和CK20、CDX2 阴性,而直肠癌乳腺转移灶通常是CDX2、CK20 阳性和CK7 阴性,CDX2、CK20阳性与胃肠源性腺癌高度相关[1,10]。
直肠癌乳腺转移中位生存期为12个月,大多1年内广泛转移后死亡。采用新辅助治疗后切除转移瘤病灶,可有效延长患者生存期[4]。使用化疗联合靶向药物作为一线治疗,有研究表明对直肠癌转移治疗有效[10],但尚缺乏大样本研究,该治疗方式是否能延长生存时间仍需探讨。
综上所述,临床诊断直肠癌时,应判断有无远处转移,尤其是罕见转移途径。若出现单个或多个乳腺包块及皮肤结节,可行PET/CT评估全身情况,并穿刺行病理检查,对合理、优化治疗具有重要的意义,也便于与二重癌鉴别,可避免不必要的根治术。部分文献时间跨度长,少数病例其原发性灶和预后的某些信息不全面,但仍有一定的参考价值,有助于诊断直肠癌乳腺转移,提高生存率,为今后研究乳腺转移癌提供帮助。

