小麦面筋蛋白基因克隆及序列分析
牛志伟,汪晓璐,徐文竞,刘爱峰,李豪圣,李洪振,韩冉,刘成,刘建军
(1.山东省农业科学院作物研究所/农业部黄淮北部小麦生物学与遗传育种重点实验室/小麦玉米国家工程实验室,山东 济南 250100;2.烟台大学生命科学院,山东 烟台 264000;3.武城县农业农村局,山东 武城 253300)
小麦是世界上最重要的三大粮食作物之一,其因出色的加工特性受到人类的青睐。小麦面粉常被加工成面包、馒头和面条等,为人们提供了主要能量和营养。Osborne[1]根据溶解特性将小麦籽粒蛋白分为清蛋白、球蛋白、醇溶蛋白和麦谷蛋白4种类型,其中醇溶蛋白和麦谷蛋白统称为面筋蛋白,约占小麦总蛋白的80%~85%,是小麦面筋的主要成分,决定着小麦的品质特性[2]。小麦醇溶蛋白根据在酸性聚丙烯酰胺凝胶中迁移率分为α、β、γ和ω4种类型,其中,α和β类醇溶蛋白存在结构同源性,往往被统称为α类醇溶蛋白[3]。醇溶蛋白主要影响面团的延展性和黏性[4]。麦谷蛋白根据分子量大小可分为高分子量麦谷蛋白(HMW-GS)和低分子量麦谷蛋白(LMW-GS)。其中低分子量麦谷蛋白占全部麦谷蛋白的60%,决定着面团的强度和粘度,对面粉的加工品质起着重要作用[5]。
乳糜泻(celiac disease,CD)是一种自身免疫性疾病,是因摄入小麦、大麦或黑麦中的面筋蛋白而引发的慢性小肠炎症性疾病,该病由Th1型细胞(T helper cell 1,Th1)介导并具有基因易感性。小麦α-和γ-醇溶蛋白内存在多种肽段与CD诱发有关。迄今为止,已经从普通小麦及其近缘物种中检测到31种具有免疫活性的致乳糜泻表位[6],由9个核心区氨基酸组成。其中有5个高频率免疫活性的抗原表位[7],分别是DQ2.5-gliaγ1(PQQSFPEQQ)、DQ2.5-glia-α1(PFPQPQLPY)、DQ2.5-glia-α2(PQPQLPYPQ)、DQ2.5-glia-α3(FRPQQPYPQ)和DQ8-gliaα1(QGSFQPSQQ)。
济南17、济麦229和济麦262的高分子量麦谷蛋白亚基分别为(1、7+8和4+12)、(1、7+8和5+10)和(1、4+15和2+12)。但是,三个品种的低分子量麦谷蛋白和醇溶蛋白尚未有相关信息。鉴于此,本研究对上述品种的低分子量麦谷蛋白和醇溶蛋白基因进行克隆和序列分析,以期发掘新的面筋蛋白等位基因,同时为小麦加工品质的分子改良提供参考资料。
1 材料与方法
1.1 试验材料
优质强筋小麦品种济南17和济麦229以及抗旱节水小麦新品种济麦262,由山东省农业科学院作物所小麦遗传育种团队育成并提供。
1.2 试验方法
1.2.1 基因组DNA提取 小麦基因组DNA的提取参照文献[8]。
1.2.2 低分子量麦谷蛋白、α-和γ-醇溶蛋白基因克隆 利用表1引物对三个小麦品种的低分子量麦谷蛋白、α-和γ-醇溶蛋白基因进行克隆。

表1 基因克隆所需引物
PCR反应体系为50μL,含有DNA模板50 ng,4种dNTP各200μmol·L-1,2×GC BufferⅠ25μL,上下游引物各0.2μmol·L-1,2.5 U Fastpfu DNA聚合酶。PCR反应程序为:95℃预变性2 min;95℃变性20 s,55~65℃退火20 s,72℃延伸2 min,30个循环;72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测后,对目的片段进行切胶回收和纯化,纯化产物连接到pEASY-Blunt载体上,并转化到大肠杆菌DH5α感受态细胞。挑取单菌落并通过菌落PCR鉴定阳性克隆,送青岛擎科生物技术有限公司进行双向测序。
1.3 序列分析、CD毒性肽识别和系统进化树构建
用DNAMAN软件进行基因结构分析和氨基酸序列预测。根据van Herpen等[13]的方法识别克隆基因所编码的5种主要的T-细胞毒性抗原表位,同时分析LGQGSFRPSQQN和LGQQQPFPPQQPYPQPQ毒性肽的分布[14]。在NCBI数据库中下载相关序列,用MEGA 6.0软件(Neighbor-Joining法)构建麦谷蛋白系统进化树。
2 结果与分析
2.1 低分子量麦谷蛋白的克隆及序列分析
利用Glu-A3F/R、Glu-B3F/R、Glu-D3F/R三对引物对济南17、济麦262和济麦229基因组总DNA进行PCR扩增(图1A)并测序,结果共获得9个麦谷蛋白基因。三品种A位点PCR片段大小均为1 382 bp,其中包括ATG上游197 bp和TAA下游51 bp的序列。序列比对发现三个品种之间的扩增序列完全相同,且其编码区序列与NCBI登录号KJ152523.1序列完全一致。济南17、济麦262和济麦229的B位点扩增片段大小分别为1 344、1 341 bp和1 195 bp,ATG上游均为174 bp片段,TAA下游分别为111 bp(济麦262和济南17)和106 bp片段(济麦229)。序列比对发现济南17和济麦262的序列相似性较高,为99.5%,仅存在3个SNP和1个三碱基的插入/缺失。济麦229与其他两个品种之间的序列差距较大。济南17、济麦262和济麦229的D位点扩增片段大小均为1 594 bp,包括ATG上游605 bp片段和TAA下游71 bp片段。三个序列中仅济南17存在1个SNP位点的差异。
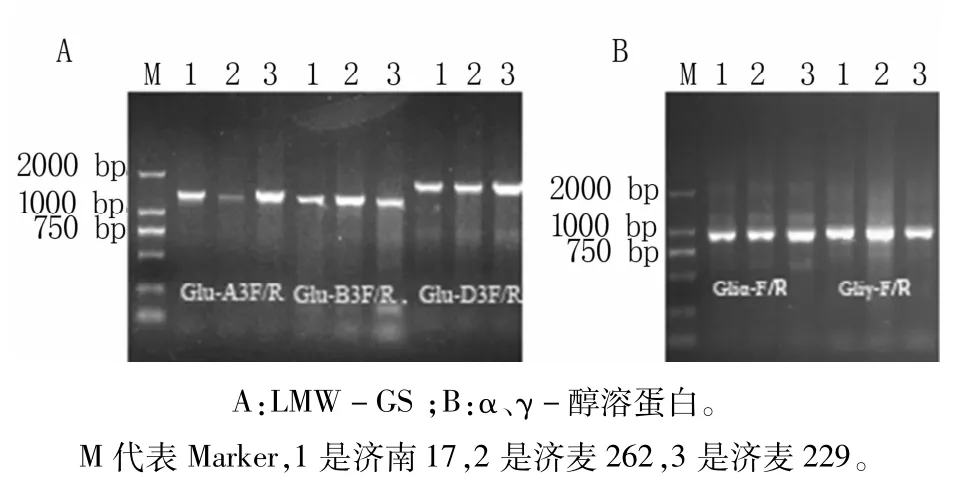
图1 供试材料LMW-GS和α、γ-醇溶蛋白PCR结果
利用DNAMAN软件将扩增得到的麦谷蛋白基因核酸序列翻译成蛋白序列,发现A位点的蛋白序列在三个品种间无差异,其翻译的氨基酸数目为376,N端第一个氨基酸均为异亮氨酸(I)。D位点蛋白序列在三个品种间也无差异,其翻译的氨基酸数目为304,N端第一个氨基酸均为甲硫氨酸(M)。在B位点济南17和济麦262翻译的氨基酸个数分别为351和350,济麦229翻译后的氨基酸数目为303(图2),三条序列N端第一个氨基酸均为M。从图2可以发现三条氨基酸序列均含有8个半胱氨酸(C),其中7个半胱氨酸的位置相同,济南17和济麦262第一个半胱氨酸位于重复区;而济麦229的第一个半胱氨酸位于N端区,剩余7个半胱氨酸均位于C端区。
2.2 醇溶蛋白基因的克隆与序列分析
三个品种中共获得6条α-醇溶蛋白基因和8条 γ-醇溶蛋白基因,gli-α的片段大小为841~896 bp,gli-γ的片段大小为976~1 098 bp。通过序列分析发现所克隆的醇溶蛋白基因中包括8个假基因(gli-α3条,gli-γ5条)和6个含有完整编码区的醇溶蛋白基因(gli-α3条、gliγ3条)。对6条醇溶蛋白基因(图1B)进行序列比对发现,3条gli-α序列相似性为96%,3条gli-γ序列的相似性为94%。
利用DNAMAN软件将扩增得到的醇溶蛋白基因序列翻译成蛋白序列发现,济南17、济麦262和济麦229的gli-α氨基酸个数分别为287、297和297,其中济南17的α-醇溶蛋白在多聚谷氨酰胺区Ⅰ的位置少了10个Q。gli-γ的氨基酸个数分别为295、327和327。分析CD诱发因子发现,克隆得到的gli-α蛋白均含有T-细胞毒性抗原表位(图3),其中济南17含有DQ2.5-gli-α3,位于N-端重复区。济麦262和济麦229含有DQ2.5-gli-α1和DQ2.5-gli-α3,位于N-端重复区。另外,克隆获得的三个品种的gli-α 中 均 未 发 现LGQGSFRPSQQN和LGQQQPFPPQQPYPQPQ毒性肽。gli-γ蛋白序列分析未发现DQ2.5-gli-γ1,但发现了DQ8.5-gli-γ1(PQQSFPQQQ)的存在,位于重复Ⅱ区。
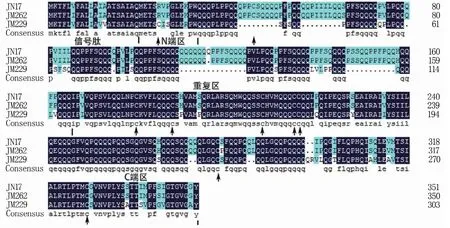
图2 B位点LMW-GS蛋白序列比对
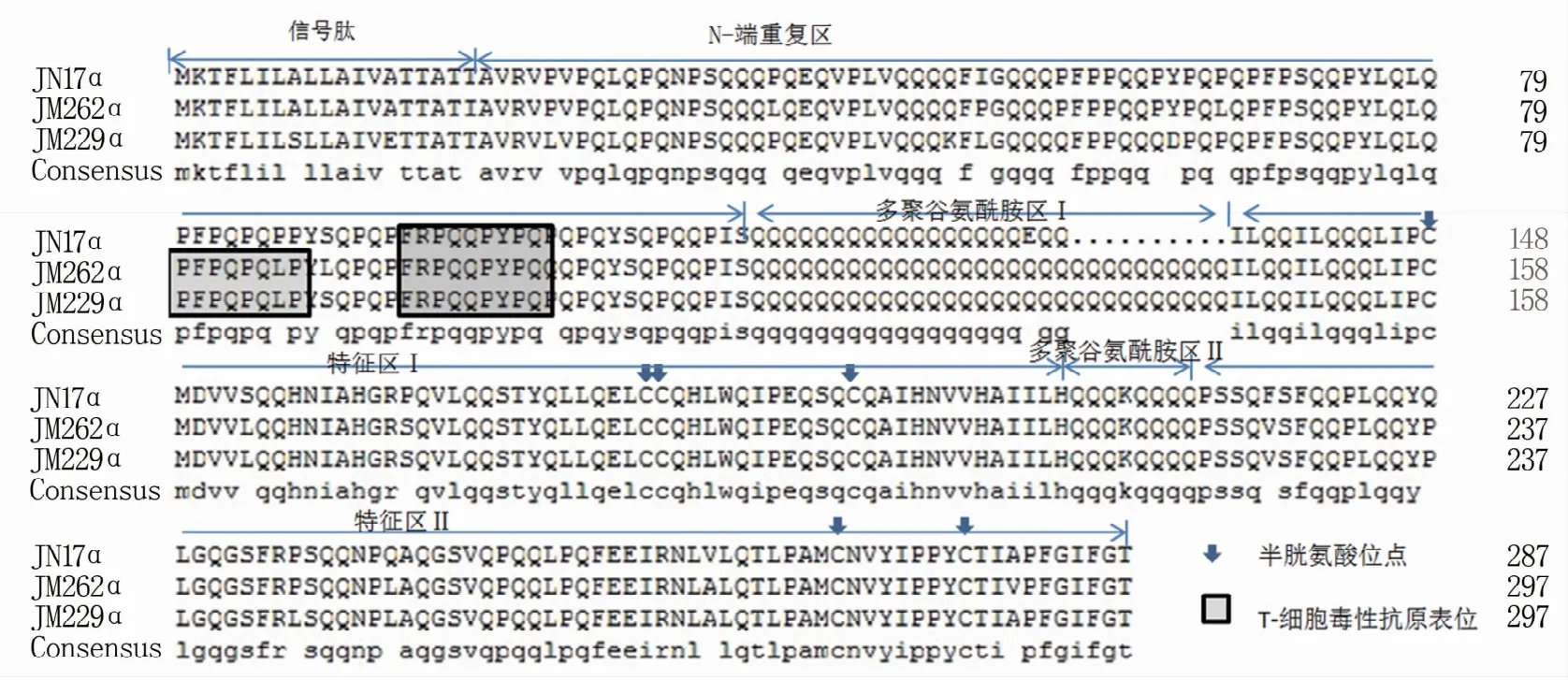
图3 gli-α蛋白序列比对
2.3 B位点低分子量麦谷蛋白的进化分析
基于三个品种B位点低分子量麦谷蛋白序列差异较大,在NCBI中搜索小麦B位点的完整低分子量麦谷蛋白序列(共18个)与本试验推导的三个B位点蛋白序列进行比对。结果发现,所有序列中的半胱氨酸(C)的位置相对比较保守,其中第2、3、4、5、6和8位的C位置一致,但第1和7位置的C位置不固定,第1个C位于N端区的共 有2个 (登 录 号 为AAQ63839.1和AAP87371.1)。
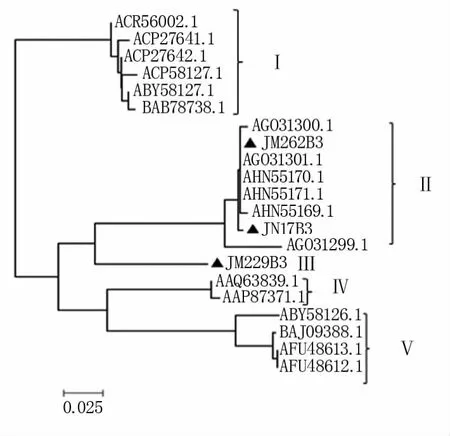
图4
系统进化树构建结果发现,所有低分子量麦谷蛋白序列共分为5组(图4)。其中,济麦229的B位点低分子量麦谷蛋白独自成第Ⅲ组。Ⅰ、Ⅱ和Ⅴ组序列的第1个C的位置位于重复区,其中Ⅰ、Ⅴ组C的位置后于Ⅱ组20个氨基酸;Ⅲ和Ⅳ组的第一个C的位置位于N端区。对于第7个C的位置,Ⅳ和Ⅴ组的位置前于Ⅰ、Ⅱ和Ⅲ组16个氨基酸。
3 讨论与结论
根据成熟低分子量麦谷蛋白N端序列的第一个氨基酸,可以将LMW-GS分为m-type、stype和i-type,分别对应的氨基酸为甲硫氨酸(M)、丝氨酸(S)和异亮氨酸(i)[15,16]。Ikeda等[17,18]从Norin 61中分离出12类LMW-GS基因,其中2类i-type、2类s-type和8类mtype,利用中国春缺四体将这些基因分别定位到A位点(3类)、B位点(2类)和D位点(7类)。Huang等[19]从Glenlea中获得12个具有完整开放阅读框的LMW-GS基因,其中1个编码itype、2个编码s-type、9个编码m-type蛋白。通过对供试材料LMW-GS基因的克隆及蛋白翻译发现,供试三个品种A位点蛋白均为i-type型蛋白、B位点为m-type型蛋白、D位点为mtype型蛋白。该结果丰富了三个品种的谷蛋白信息。
研究表明α-、γ-醇溶蛋白中存在的T-细胞毒性抗原表位是诱发CD的重要原因。在普通六倍体小麦A、B、D基因组中,B基因组含有较少数量的毒性多肽,D基因组中含有的毒性多肽相对较多,李文旭等[20]对郑麦366的9个α-醇溶蛋白进行CD分析发现,ZM366-1和ZM366-2中存在LGQGSFRPSQQN毒性态,并发现4种T-细胞毒性抗原表位在9个α-醇溶蛋白中差异分布。Li等[21]在Zhengmai 004中共发现39个T-细胞毒性抗原表位。本研究克隆的α-醇溶蛋白分别含有1~2个T-细胞毒性抗原表位,位于N-端重复区,在获得的α-醇溶蛋白序列中未发现LGQGSFRPSQQN和LGQQQPFPPQQPYPQPQ毒性肽。由于本研究只是克隆了三个品种的部分α-醇溶蛋白,所以该结果并不能表明这三个品种不含有以上两个毒性态。γ-醇溶蛋白基因序列含有1个T-细胞毒性抗原表位,位于重复Ⅱ区。研究发现γ-醇溶蛋白Ⅱ重复区和Ⅲ非重复区附近乳糜泻毒性相对较强,该结果表明在普通小麦品种中也有足够导致乳糜泻发生的潜力,与前人研究结果基本一致[22]。
低分子量麦谷蛋白亚基通常都含有8个半胱氨酸(C)残基,第1和第7个能形成分子间二硫键。两个C残基在位点上存在显著变异,可能是导致LMW-GS结构和功能差异的主要因素;其余6个半胱氨酸残基所形成的分子内二硫键对LMW-GS的结构变异也有不同的作用,其中第2和第5个半胱氨酸残基的结合对分子折叠是至关重要的[23,24]。本研究将获得的B位点LMW-GS蛋白序列进行比对,发现第1和7位C的位置存在较大变异,其中济麦229的B位点LMW-GS、AAQ63839.1和AAP87371.1第一个C位于N端区,不同于其他序列,且济麦229 B位点蛋白序列中1和7位的C位置组合不同于其他序列并独自分为一组,表明该序列在进化上不同于其他序列,其是否会影响小麦籽粒蛋白的结构和功能需要进一步研究。

