鸡血血红蛋白酶法提取血红素工艺优化
吴文锦,汪兰,孙静,丁安子,乔宇,石柳,李新*
(1.湖北省农业科学院农产品加工与核农技术研究所,湖北 武汉 430064;2.湖北省农业科学院畜牧兽医研究所,湖北 武汉 430064)
我国是家禽养殖大国,近年来家禽屠宰加工业得到了快速发展,产生大量的禽血副产物。目前禽血转化利用率不到10%,通常加工为血豆腐、血粉等初级加工产品,大部分以污水的形式排放丢弃,导致蛋白质资源流失,造成严重的环境污染[1]。禽血中含有丰富的血浆蛋白与血红蛋白,如进行深度开发利用,制备具有功能特性的食品辅料,可以显著提高家禽产业经济效益。缺铁性贫血是全世界最常见的营养缺乏症,约20%的人口尤其是妇女、儿童存在这种症状[2]。血红素铁吸收优于非血红素铁,可以通过补充富含血红素铁强化食品来解决缺铁性贫血[3]。血红素与珠蛋白通过四键相结合构成血红蛋白,其中两个是丙酸基与珠蛋白的结合键,另两个是通过铁与珠蛋白中组氨咪唑环的氮环或配位键结合[4]。血红素是由卟啉和一分子的亚铁离子结合的铁卟啉类化合物,具有非常重要的生理生化功能,可以广泛应用于营养补铁剂和色素添加剂[5]。
目前关于血红素提取制备主要采用冰醋酸法、酸性丙酮法,当pH值低于3.5时,二价铁离子与组氨酸配位键离解,导致血红素分子断开,这是酸性试剂分离血红素的原理,但存在有机物污染的风险[6-8]。应用蛋白酶酶解提取分离血红素,具有效果高、反应条件温和、环境影响小等优点[9-10]。有研究表明,采用超声波、冻融、均质等方法破坏血红细胞形态,使血红素更加彻底地分离,提高血红素得率,然而这些方法不适合大批量的动物血液处理[11-13]。本研究以新鲜鸡血为原料,采用蛋白酶水解血红蛋白,结合离心、冻干等方法制备血红素,为提高禽血资源的高值转化利用、减少禽血排放造成的污染提供了可行途径。
1 材料与方法
1.1 材料与试剂
新鲜鸡血:武汉市洪山区南湖生鲜市场。鸡宰杀时收集鸡血,添加0.2%乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt,EDTA-2Na),搅拌均匀,置于冰盒中备用,离心处理(4 000 r/min,20 min),收集沉淀,冻干即为血红蛋白粉。
EDTA-2Na、硝酸、高氯酸、硫酸、硼酸、盐酸、氢氧化钠、甲醛、乙醇、甲酸、邻苯二甲酸氢钾、硫酸铜、硫酸钾、甲基红、溴甲酚绿、酚酞、硫酸铁铵(分析纯)、氯化血红素(标准品,纯度>99.99%):国药集团化学试剂有限公司;酸性蛋白酶(酶活力≥50 U/mg)、中性蛋白酶(酶活力≥100 U/mg)、碱性蛋白酶(酶活力≥200 U/mg):合肥博美生物科技有限公司;以上试剂均为分析纯。
1.2 仪器与设备
GL-25MS高速冷冻离心机:上海卢湘仪离心机仪器有限公司;L5S紫外分光光度计:上海仪电分析仪器有限公司;TAS-990原子吸收分光光度计:北京普析通用仪器有限责任公司;SH220F石墨消解仪:济南海能仪器股份有限公司;SIM FDS-2.5E真空冷冻干燥机:美国SIM公司;LC-30AD液相色谱:日本SHIMMADZU公司;Qtrap 4500质谱仪:美国AB SCIEX公司。
1.3 方法
1.3.1 试验设计
以血红蛋白粉为酶解底物,分别选用酸性蛋白酶、中性蛋白酶、碱性蛋白酶酶解,根据蛋白酶最适反应温度、pH值调整酶解体系温度与pH值。底物浓度分别设定为 1.0、2.0、3.0、4.0、5.0 g/100 mL,蛋白酶添加量分别设定为 0.5、1.0、1.5、2.0、2.5 g/100 mL,酶解时间分别设定为 3、4、5、6、7 h。研究分析蛋白酶种类、底物浓度、酶添加量、酶解时间对血红蛋白水解度、血红素得率、血红素纯度的影响。
通过单因素试验结果分析,确定适宜的蛋白酶种类,并选取底物浓度(A)、酶添加量(B)、酶解时间(C)为试验因素,以血红素得率、纯度为考核指标,采用L9(34)正交试验确定最佳试验条件。因素水平见表1。

表1 正交试验水平因素表Table 1 Factors and levels of orthogonal test
采用最优酶解工艺参数酶解,离心(4 000 r/min,20 min),收集沉淀,经冷冻干燥得到血红素产品,采用液相色谱-串联质谱(lipid chromatography-tandem mass spectrometry,LC-MS/MS)分析确定血红素浓度。
1.3.2 营养成分检测
水分含量测定参照GB 5009.3—2016《食品安全国家标准食品中水分的测定》[14];蛋白质含量测定参照GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》[15];脂肪含量测定参照 GB 5009.6—2016《食品安全国家标准食品中脂肪的测定》[16];灰分含量测定参照GB 5009.4—2016《食品安全国家标准食品中灰分的测定》[17];铁含量测定参照GB 5009.90—2016《食品安全国家标准食品中铁的测定》[18]。
1.3.3 水解度(degree of hydrolysis,DH)测定
按照式(1)计算水解度。
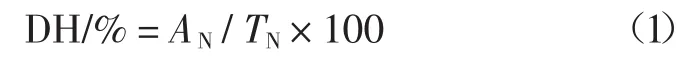
式中:AN为甲醛电位滴定法测定[19]的氨基态氮含量,g/100 mL;TN为凯氏定氮法测定[15]的总氮量,g/100 mL。
1.3.4 血红素得率测定
采用原子吸收分光光度法测定血红素得率。准确称取样品0.5 g~3.0 g于带刻度的消化管中,加入10 mL硝酸和0.5 mL高氯酸,在电热炉上消解(120℃/0.5 h~1 h、180℃/2 h~4 h、220℃/0.5 h~1 h),冷却后将消化液转移至25 mL容量瓶中,用少量水洗涤2次~3次,合并洗涤液于容量瓶中并定容,混匀备用。将铁标准溶液按质量浓度由低到高的顺序分别导入原子吸收分光光度计,测定吸光度,以铁质量浓度为横坐标,吸光度为纵坐标,制作标准曲线,铁标准曲线为:y=0.27x+0.07(R2=0.962 9)。将样品溶液分别导入原子吸收分光光度计测定吸光度,根据铁质量浓度换算成血红素质量浓度(铁的质量浓度×11.0),按式(2)计算血红素得率。

1.3.5 血红素纯度测定
采用紫外分光光度法测定血红素纯度。血红素标准品溶液于波长385 nm处测定光吸收值,以血红素浓度为横坐标,吸光值为纵坐标,制作标准曲线,血红素标准曲线为:y=82.556 x-0.004(R2=0.999 3)。称取样品20mg于10mL容量瓶中,加入0.1mol/L NaOH溶解并定容,于波长385 nm处测定吸收值,按式(3)计算样品中血红素纯度。

1.3.6 血红素产品的质谱分析
称取一定量的血红素产品,用5%氨水+75%水溶解,用0.22 μm微滤膜过滤,超声波脱气后进行定性半定量分析。
色谱条件为色谱柱:采用 C18柱(1.8 μm,2.0 mm×75 mm);流动相:A相,纯甲醇溶液;B相,0.02%甲酸-水溶液(体积分数);流速:0.25 mL/min;进样量:1 μL;色谱柱温度:40℃;采用梯度洗脱,流速保持不变,初始 B 相为 80%,0~2 min;B 相 60%,2 min~4 min;B相 50%,4 min~6 min;A 相 100%,保持 8 min~9 min;B相80%,保持1 min。
质谱条件:采用电喷雾离子源(electron spray ionization,ESI)离子化;正离子模式扫描;多反应监测模式(multiple reaction monitoring,MRM),电喷雾电压(ionspray,IS)5 500 V,离子化温度(temperature,TEM)300℃;雾化气压力(gas1,GS1)50psi(1psi=6.895kPa),辅助气压力(gas 2,GS2)50 psi,气帘气压力(curtain gas,CUR)35 psi;定量离子对 616.1>557.2、去簇电压(declustering potential,DP)175 V、碰撞电压(collision energy,CE)51 V;定性离子对 616.1>498.2、DP 175 V、CE 69 V。
按式(4)计算产品中血红素含量。

1.4 数据处理
试验数据采用平均值±标准差表示,试验重复3次,使用Excel、Origin 8.0进行数据处理和制图,采用SPSS统计分析软件检验组间差异显著性(P<0.05)。
2 结果与分析
2.1 鸡血营养成分
鸡血营养成分见表2。

表2 鸡血营养成分Table 2 Nutrition of chicken blood
由表2可知,新鲜鸡血主要成分是水,含量达到94.94%;其次是蛋白质,含量为5.03%,主要包含血红蛋白、肌红蛋白、血浆蛋白;鸡血脂肪含量非常少,仅为0.18%;鸡血灰分含量为 0.38%,主要为 Na、Fe、Mg、Ca等矿物质元素;鸡血中铁含量为148.78 mg/kg,铁与卟啉环络合,结合在卟啉环中央构成血红素,而血红素是血红蛋白、肌红蛋白和红细胞的辅基,是重要的天然卟啉铁化合物[20]。鸡血中含有绝大部分水,从鸡血中分离提取血红素,去除水分是关键,亦是影响血红素得率、纯度的主要因素。因此本文采用离心提取血液中血红蛋白,再通过冷冻干燥得到血红蛋白粉,以血红蛋白粉为酶解底物,便于后续酶解工艺,也有利于提高血红素得率和纯度。
2.2 蛋白酶种类对血红蛋白水解度的影响
以血红蛋白为底物,选用碱性蛋白酶、中性蛋白酶与酸性蛋白酶酶解,水解度见图1。

图1 3种蛋白酶水解度随时间变化趋势Fig.1 Changes of DH of 3 proteases with time
由图1可知,随着酶解时间延长,水解度呈增加趋势,其中酶解2 h,水解度增加显著,2 h后,水解度呈缓慢上升趋势;中性蛋白酶、碱性蛋白酶水解度高于酸性蛋白酶,水解度与蛋白酶的酶活力呈正相关。考虑碱性蛋白酶酶解过程中添加碱液调整pH值,且不利于酶解液后期处理,因此确定中性蛋白酶为鸡血血红素酶解提取专用酶。胰蛋白酶、木瓜蛋白酶、胃蛋白酶等蛋白酶都可以用于血液中血红素提取,单一酶解或复合酶解取决于酶活力与酶解目的[21]。
2.3 底物浓度对血红蛋白水解度与血红素得率、纯度的影响
不同底物浓度下的水解度、血红素得率、血红素纯度见表3。

表3 不同底物浓度下的水解度、血红素得率、血红素纯度Table 3 Changes of DH,heme yield and heme purity with different contents of substrate
由表3可知,随着血红蛋白浓度增加,水解度呈增加趋势。酶解反应液中底物浓度较低时,底物可以与酶充分接触发生降解反应,水解度显著增加,随着底物浓度增加,而酶浓度恒定时,与酶接触发生反应的底物只能是一定的,另外随着酶解进行,酶解产物与底物处于竞争关系,导致底物不能被完全水解,水解度趋于稳定。结果表明,底物浓度1.0 g/100 mL~5.0 g/100 mL时,均处于有效底物浓度范围,即均能被蛋白酶有效降解。
底物浓度为2.0 g/100 mL时,血红素得率达到最高值52.08%,底物浓度为3.0 g/100 mL~5.0 g/100 mL时,血红素得率下降并趋于稳定,分别为32.31%、32.60%、30.30%,由此可以说明,底物浓度在2.0g/100mL时,血红蛋白中珠蛋白可以被有效降解,使血红素游离出来。底物浓度超过2.0 g/100 mL,虽然珠蛋白与酶发生降解反应,水解度随之增加,但珠蛋白没有被完全降解,使血红素仍处于与珠蛋白(或肽)结合的状态,血红素得率下降。
血红素纯度随底物浓度变化趋势与血红素提取率变化基本一致,底物浓度为2.0 g/100 mL时,血红度纯度达到最高值53.72%,随着底物浓度增加,血红度纯度显著下降,底物浓度为3.0 g/100 mL~5.0 g/100 mL时,血红度纯度分别为26.87%、25.09%、19.58%。由此可以表明,底物浓度2.0 g/100 mL时,血红蛋白可以被彻底降解,血红素纯度最高。
2.4 酶添加量对血红蛋白水解度与血红素得率、纯度的影响
不同酶添加量下的水解度、血红素得率、血红素纯度见表4。

表4 不同酶添加量下的水解度、血红素得率、血红素纯度Table 4 Changes of DH,heme yield and heme purity with different contents of enzyme
由表4可知,随着酶添加量增加,血红蛋白水解度整体呈缓慢增加趋势,酶添加量为1.5 g/100 mL时,水解度为10.54%,酶添加量2.0 g/100 mL~2.5 g/100 mL时,水解度增加不明显。由此可以推断添加1.5 g/100 mL的酶可以有效降解底物,酶浓度继续增加,处于过饱和状态,而血红蛋白浓度一定,因此底物水解度上升不明显。酶解开始时,底物浓度、酶浓度较高,酶活性也最大,随着酶解反应进行,底物浓度降低,酶活性也降低,表现为水解度几乎不增加[22-23]。
随着酶添加量增加,血红素得率先缓慢上升后略下降,其中酶添加量为1.5 g/100 mL时,血红素得率为最高值37.70%;酶添加量为1.5 g/100 mL~2.5 g/100 mL时,血红素得率呈下降趋势。当底物浓度、酶解反应时间一定时,酶与底物发生竞争性水解反应,使底物水解不彻底,导致血红素得率下降。
随着酶添加量增加,血红素纯度先增加后降低,变化趋势与血红素得率基本一致。酶添加量为1.5g/100 mL时,血红素纯度达到最高值31.95%,酶添加量为1.5 g/100 mL~2.5 g/100 mL时,血红素纯度下降。由此表明,酶浓度过饱和时,酶与底物发生竞争反应,使底物水解不完全,导致血红素纯度降低。
2.5 酶解时间对血红蛋白水解度与血红素得率、纯度的影响
不同酶解时间下的水解度、血红素得率、血红素纯度见表5。

表5 不同酶解时间下的水解度、血红素得率、血红素纯度Table 5 Changes of DH,heme yield and heme purity with different hydrolysis time
由表5可知,随着酶解时间的延长,血红蛋白水解度呈平缓增加趋势,由此表明,酶解初始阶段,即酶解3 h之前,底物浓度较高,酶活性也较强,水解度迅速增加,当酶解3 h后,底物浓度降低,酶活性也降低,水解度缓慢增加。延长酶解时间有利于提高水解度,但综合考虑生产周期、能耗等问题,确定酶解时间5 h比较适宜。血红素得率随酶解时间增加呈缓慢上升后略有降低趋势,酶解3h,血红素得率已达到33.54%,酶解5h,血红素得率达到最高值39.52%。由此可以推断,血红素得率随着酶解时间增加达到稳定值,表明酶解体系中底物已被彻底水解,血红蛋白中血红素已游离出来,再增加酶解时间,只会导致血红蛋白中的珠蛋白进一步降解成小肽或氨基酸,而这一阶段对血红素得率无影响。另外,血红蛋白自动氧化是不可以避免的,血红素中的亚铁与氧气结合生成三价铁,使血红素呈黑褐色,因此有必要控制酶解时间以保证血红素品质[24-25]。
血红素纯度随酶解时间变化趋势与血红素得率变化基本一致。酶解3 h,血红素纯度达到27.47%,酶解5 h,血红素纯度达到最高值33.80%,酶解7 h,血红素纯度降低。由此表明,随酶解时间延长,酶解体系中底物已被完全水解,使血红素释放出来,血红素纯度达到稳定值,再增加酶解时间,血红素中的铁离子与小肽结合生成小肽铁螯合盐,使血红素纯度降低[26]。
2.6 正交试验
正交试验设计与结果见表6。

表6 正交试验设计与结果Table 6 Orthogonal array experimental design and results
由表6 R值分析可知,影响血红素得率、纯度的因素主次顺序均为A>B>C,即底物浓度是主要因素,其次是酶添加量,而酶解时间影响最小。k值结果表明,最优酶解工艺条件是A3B3C3,即血红蛋白粉浓度为4.0 g/100 mL,酶添加量 2.0 g/100 mL,酶解 6 h,在此条件下,血红素得率与纯度分别为52.76%、50.17%。鉴于酶解时间对血红素得率与纯度影响不明显,且考虑生产周期问题,选择酶解工艺条件为A3B3C1,此条件下血红素得率与纯度分别为52.23%、49.26%,与最优工艺条件下血红素得率、纯度差异不明显。
2.7 血红素产品的质谱分析
血红素标品与血红素产品色谱图见图2、图3。

图2 血红素标准品色谱图Fig 2 Chromatogram of heme standard

图3 血红素产品色谱图Fig 3 Chromatogram of heme product
血红素标准品与血红素产品峰面积见表7。

表7 血红素标准品与血红素产品峰面积Table 7 Peak area of heme standard and product
根据确定的最优酶解工艺水解鸡血血红蛋白,离心后沉淀经冷冻干燥获得鸡血血红素产品,采用液相色谱质谱联用仪鉴定产品中血红素含量。血红素保留时间分别为6.70、6.68 min,血红素产品中血红素保留时间与标准品相对应,由此可以判定产品中血红素以氯化血红素形式存在。根据血红素标准品、血红素产品质量浓度与峰面积(表7)分析计算,确定产品中血红素含量为50.24%。产品中血红素主要以血红素单体形式存在,血红素与肽或蛋白类物质结合物较少,验证了优化后的酶解工艺可以有效水解血红素-珠蛋白之间肽键,使血红素释放出来。
3 结论
通过单因素试验探讨蛋白酶种类、底物浓度、酶添加量、酶解时间对血红蛋白水解度、血红素得率与纯度的影响,结果表明,鸡血中含有大量的水分,因此酶法提取血红素有必要以干燥血红蛋白为底物,有利于提高血红素得率与纯度;中性蛋白酶、碱性蛋白酶酶解水解度高于酸性蛋白酶,中性蛋白酶因不需调整底物pH值更方便于血红素提取;中性蛋白酶酶解提取鸡血血红素最优工艺条件:血红蛋白粉浓度4.0 g/100 mL,酶添加量2.0 g/100 mL,酶解4 h,血红素得率与纯度分别为52.23%、49.26%。应用液相色谱一串联质谱方法确定血红素产品中血红素以氯化血红素形式存在,含量为50.24%。鸡血血红素得率、纯度与血红蛋白中血红素含量直接相关,而血红素含量与屠宰过程中鸡的个体差异直接相关,因此必须采用血红蛋白大批量制样来减少血红素得率与纯度差异变化。在工业生产中,家禽屠宰副产物——血液比较集中,因此相关设备必须与处理量相匹配,如离心、冻干、酶解等设备。本文为禽血蛋白酶水解提取血红素提供理论数据与技术参考,实现家禽屠宰血液高值转化应用,有效解决对外排放导致的环境污染问题。

