肺癌细胞微团的低温保存实验
周新丽 李嘉慧 杜羽琨
(上海理工大学生物系统热科学研究所 上海 200093)
体外模型的建立对于肿瘤发病基因的筛查以及抗肿瘤新药的研发至关重要。二维细胞培养模型广泛应用于各种药物筛选研究,但肿瘤的发生与肿瘤所处周围的微环境密切相关[1],体内肿瘤呈现的立体结构、内外酸碱度平衡以及需氧平衡并不能在二维模型中充分体现,导致临床治疗效果与二维细胞的实验结果具有较大差异。人源肿瘤异种移植模型(PDX,patient-derived tumor xenograft)是指将手术切除的病人肿瘤组织接种于免疫缺陷鼠体内而建立的新一代肿瘤模型,药效学结果与临床有较好的相关性,但是存在不可用于高通量筛选,不能完全模仿人体的自然生物反应[2],且造价昂贵等问题。由细胞微团、细胞聚集体构建的三维细胞模型,能够复制体内细胞的分化、增殖和体外功能,相比于二维培养的细胞具有高度生理相关性[3],相比于PDX 模型,其建立更为方便且廉价,逐渐成为肿瘤研究领域中更合适的体外研究模型[4-5]。
目前在肿瘤细胞三维模型的培养方面已取得显著成绩。徐红等[6]在体外通过使用胶原支架材料复合乳腺癌细胞成功构建乳腺癌三维模型并用于耐药性筛选。J.F.Cadavid-Vargas 等[7]使用琼脂糖铺板制作低黏附底面的孔板并接种肺癌细胞,在体外成功培养了用于药物筛选的肺癌细胞微团。但由于细胞微团的培养需要较长时间,需要时再进行培养会导致试验周期过长,药物筛选的效率大大降低。对细胞微团进行标准化生产并进行有效的长期保存,异地使用或者需要使用时对微团复温培养并保持活性及功能,将会大大提高使用效率。此外,类器官技术作为近年发展迅速的三维体外培养技术,是未来作为药物筛选的完美模型,对细胞微团有效长期保存的探索也是为类器官样本库的建立做好技术准备。
低温保存是生物样本长期保存及运输最为常用的方法[8]。常规慢速冷冻已广泛应用于细胞株以及细胞微团的保存[9-11],玻璃化冷冻是指使液相不发生结晶而直接转化成玻璃态固相的冷冻方法。相比于慢速冷冻,玻璃化冷冻可以有效阻止冰晶的形成,目前已成功应用于生殖细胞的保存[12-13]。S.Sart等[14]使用慢速冷冻对胚胎干细胞微团进行低温保存,复苏后细胞微团的存活率为65%~68%,慢速冷冻降温过程中因为冰晶的形成造成细胞及微团的损伤。Li Tao 等[15]使用直接接触液氮的玻璃化方法对胚胎干细胞微团进行低温保存,复苏后细胞微团存活率为94.3%。但目前对于肿瘤细胞微团的低温保存研究较少,对于其最适宜的冻存方法、保护剂体积浓度尚无定论。此外,当前玻璃化冷冻保存的另一个局限性在于样本直接接触液氮而造成污染,因此选择合理的玻璃化冷冻载体也非常重要。
本文采用低黏附率U 型96 孔板培养肺癌细胞A549 细胞微团,研究培养天数和接种密度对细胞微团尺寸的影响;其次,采用冻存管、塑料麦管、玻璃毛细管作为冷冻载体,采用不同浓度的保护剂对细胞微团进行低温保存,对复苏后细胞微团相对新鲜组细胞微团活力以及增殖率进行检测,筛选低温保存肺癌细胞微团的最佳方法;最后对冷冻载体的降温速率以及保护剂的临界降温速率进行测定,对细胞微团低温保存的热力学机理进行分析。
1 实验与材料
1.1 主要试剂和药品
细胞株:人肺腺癌细胞株A549,购于中国上海富恒生物科技有限公司;胎牛血清(FBS,fetal bovine serum)、胰蛋白酶、DMEM 培养基、青霉素、链霉素、AO/PI 溶液、CCK-8 试剂盒(上海励瑞生物科技有限公司);二甲基亚砜(dimethyl sulfoxide,Me2SO,艾普力,德国);乙二醇(EG,ethylene glycol)、海藻糖(中国医药集团上海化学试剂公司);阿尔玛蓝试剂盒(上海懋康生物科技)。
1.2 三维细胞模型培养
使用液体覆盖法构建三维细胞微团模型[16],低黏附率U 型96 孔板(上海迪盼生物科技有限公司)是在96 孔板中注入特殊处理的聚苯乙烯等相关材料,在表面张力作用下形成凹液面,材料冷凝后即形成利于细胞聚集生长但不利于细胞贴壁的低黏附率表面。细胞悬液加入孔中,重力作用下大部分细胞自然沉降至凹面最低处,细胞由于不能贴壁生长被迫聚集生长成肿瘤球。
将肺癌细胞A549 重悬于细胞培养液(含有体积分数为10%的FBS、青霉素100 U/mL、链霉素100 μg/mL 的DMEM 试剂)并接种于培养瓶中,置于37℃、5% CO2、70%湿度的培养箱(上海博讯)中培养。取生长于对数期的细胞直至达到80%~90%汇合时,胰酶消化并重悬至完全培养基中计数,分别稀释细胞悬液浓度为1×104个/mL、2×104个/mL、5×104个/mL、1×105个/mL,并分别接种于低黏附率U 型96 孔板中,每孔加入100 μL 细胞悬液,置于37 ℃、5%CO2细胞培养箱中孵育。连续培养5 d,在显微镜下对微团形成过程进行拍照,并统计尺寸,每隔一天用新鲜的培养基替换一半培养基。
1.3 肺癌细胞微团的慢速冷冻
以DMEM 作为基础溶液,由基础溶液配置体积分数为10%的Me2SO 作为低温保护剂,将配制好的低温保护剂用0.22 μm 针式滤器过滤除菌,用封口膜封住瓶口放置于4 ℃冰箱中备用。选取状态良好的细胞微团,使用20 uL 移液枪将细胞微团转移至1.8 mL 冻存管(康宁)中,添加1 mL 低温保护剂,在4 ℃平衡5 min。
细胞微团慢速冷冻分为两组:一组冻存管放入4℃预冷的程序降温盒(5100-0001C,上海励瑞生物科技有限公司)中,再放入-80 ℃冰箱,在此条件下程序降温盒中的冻存管降温速率为1 ℃/min,24 h 后将冻存管放入液氮进行低温保存;另一组冻存管放入程控降温仪(Kryo360,Planer,英国),设置降温程序:从4℃以0.5 ℃/min 速度降至-40 ℃后,再以1 ℃/min降至-80 ℃后,直接放入液氮中进行低温保存。
复温时从液氮中取出冻存管,37 ℃水浴复温,当冻存管里液体及微团全部融化后,吸取细胞微团至1.5 mL 离心管中,并加入1 mL 细胞培养液轻轻吹匀,平衡10 min 后进行后续检测。
1.4 肺癌细胞微团的快速及玻璃化冷冻
以DMEM 作为基础溶液,配置三种低温保护剂VS1、VS2、VS3。VS1 为基础溶液配置体积分数为10%的EG、体积分数为10%的Me2SO 及0.5 mol/L海藻糖,溶液摩尔浓度为3.68 mol/L;VS2 为基础溶液配置体积分数为15%的EG、体积分数为15%的Me2SO 及0.5 mol/L 海藻糖,溶液摩尔浓度为5.27 mol/L,VS3 为基础溶液配置体积分数为20%的EG、体积分数为20%的Me2SO 及0.5 mol/L 海藻糖,溶液摩尔浓度为6.86 mol/L。将保护剂溶液稀释一倍作为对应的平衡溶液ES1、ES2、ES3。配置两种复温溶液TS1、TS2,TS1 为基础溶液配置1 mol/L 蔗糖溶液,TS2 为基础溶液配置0.5 mol/L 蔗糖溶液。
采用塑料麦管、玻璃毛细管作为冷冻载体,选取状态良好的细胞微团,在平衡溶液(ES1、ES2、ES3)中平衡3 min,然后在对应的保护剂溶液(VS1、VS2、VS3)中平衡30 s,再利用塑料麦管、玻璃毛细管的虹吸作用,快速将细胞微团连同玻璃化溶液移入麦管或玻璃毛细管,该过程中应保证尽量少吸入保护剂。将加载好细胞微团及低温保护剂的塑料麦管/玻璃毛细管迅速投入液氮中进行低温保存。
复温时将塑料麦管、玻璃毛细管从液氮中分批次取出,迅速将含有细胞微团的一端插入37 ℃ TS1中,保证装载细胞微团的一端完全浸没在TS1 中,完全融化待微团流出后平衡1 min,转移至TS2 中平衡3 min。最后转移至细胞培养液中,平衡10 min 进行后续检测。
1.5 AO/PI 染色检测
使用AO/PI 溶液对细胞微团进行染色,取新鲜组以及冻存复苏后的细胞微团悬液和AO/PI 溶液各10 μL 滴加至载玻片上,黑暗处孵育5 min 后,在荧光显微镜下观察并拍照,正常细胞被染色为绿色或黄绿色,晚期凋亡细胞或死细胞被染色为红色。
1.6 细胞微团活力检测
使用cell count kit-8(CCK-8)对细胞微团的活力测定,将新鲜及复苏后的细胞微团在96 孔板中加入细胞培养液培养,每24 h 将孔中溶液更换为100 μL 含有体积分数为10% CCK-8 的细胞培养液,37℃培养1 h 后,使用酶标仪在450 nm 处测量OD 值。计算使用不同低温保存细胞微团相对新鲜组细胞微团活力。
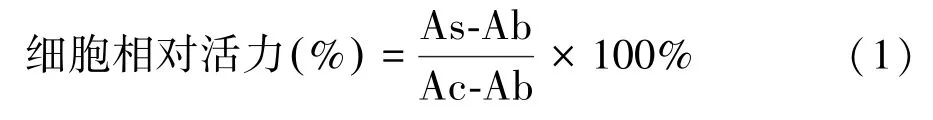
式中:As 为实验孔(含有复温并洗脱后细胞微团、培养基以及CCK-8 溶液);Ac 为对照孔(含有新鲜组细胞微团、培养基以及CCK-8 溶液);Ab 为空白孔(含有培养基以及CCK-8 溶液)。
1.7 Alamar blue 增殖检测
Alamar blue 是一种氧化还原指示剂,能根据代谢活性产生吸光度变化和荧光信号。对于微团增殖的测定,将新鲜及复苏后的细胞微团在96 孔板中加入完全培养基培养,每24 h 将孔中溶液更换为100 μL 含有体积分数为10% Alamar blue 的完全培养基,37 ℃培养4 h,使用酶标仪测量570 nm、600 nm 处OD 值。连续测量3 d,并计算细胞微团相对于新鲜组细胞微团的增殖率。
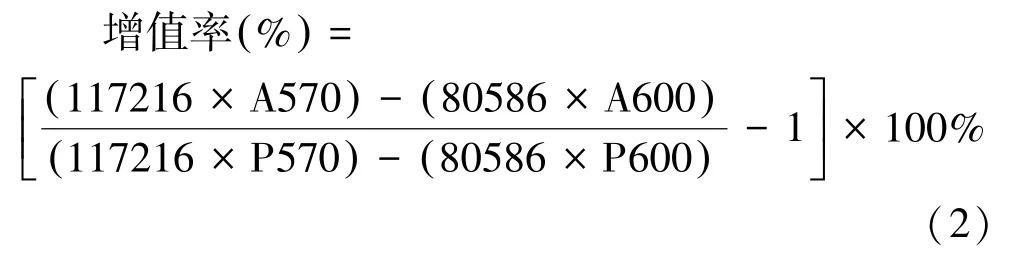
式中:A570 为检测孔在570 nm 波长的吸光度;A600 为检测孔在600 nm 波长的吸光度;P570 为第0 天检测孔在570 nm 波长的吸光度;P600 为第0 天检测孔在600 nm 波长的吸光度。
1.8 细胞微团冻存的热力学分析
将适量VS2、VS3 保护剂加载于塑料麦管、玻璃毛细管内,将测温元件T 型热电偶插入塑料麦管、玻璃毛细管内的液体中固定并连接数据采集仪(Agilent 34972 A,美国),设置数据采集仪测温时间间隔为0.045 s,将麦管、玻璃毛细管立即浸入液氮,并使用数据采集仪读取温度变化曲线,选取温度开始降低的时间段,计算冷冻载体的降温速率。
董轶锋等[17]推导了结晶动力学的模型,采用差示量热扫描仪DSC(DSC8500,PE,美国),选取一组从小到大的降温速率vi(i=1,…,n),测出相应的结晶放热量qi(J/g),若((qi-1-qi)/qi-1)<1%,则可取vi-1所对应qi-1为qmax,若定义临界结晶率xg为0.05,根据式(3)~式(5)计算低温保护剂临界降温速率vcr。
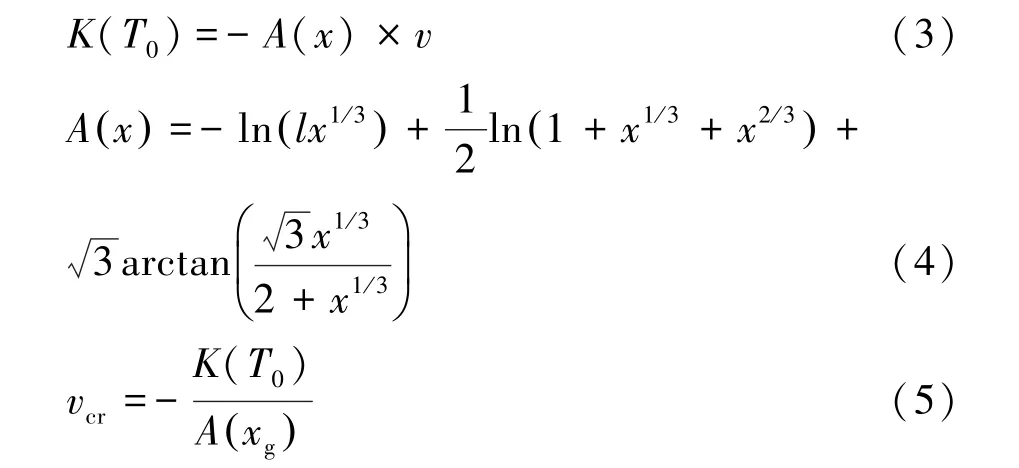
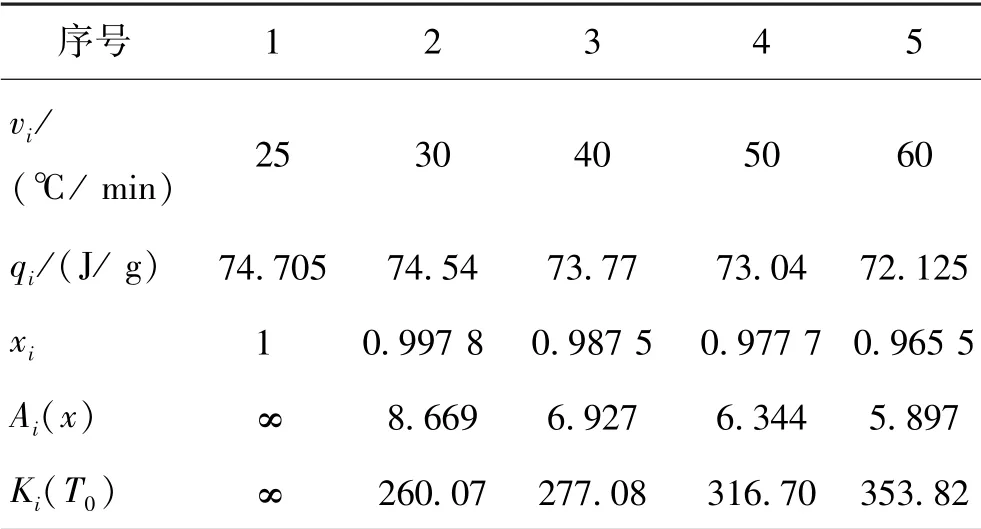
式中:T0为结晶起始温度,℃;v为某次的降温速率,℃/min;x为结晶放热量q与最大可能结晶放热量qmax的比例(0 根据上述计算方法,对VS1、VS2、VS3 的临界降温速率进行计算,将三种溶液的玻璃化临界降温速率与冷冻载体可实现的降温速率进行对比,对使用不同冷冻载体低温保存细胞微团降温过程的现象进行分析。 采用SPSS 18.0 软件中ANOVA(analysis of variance)过程对数据进行方差分析、 Duncan 氏多重比较。使用Origin 9.0 对数据进行作图。 在显微镜下观察,二维培养的细胞呈现梭形及多角形贴壁生长,而在三维细胞模型培养条件下,细胞生长情况如图1所示(文中插图中的黑色或灰色线段代表长度100 μm)。以接种密度为2×104个/mL为例,A549 细胞呈圆形在完全培养基中悬浮生长,并出现相互黏附的趋势,在培养第2 天可见由多个细胞黏附在一起并呈团块状生长的现象。培养至第3 天时,细胞微团开始形成致密的结构,微团直径为344.24±0.74 μm。培养至第4 天、第5 天时,细胞微团立体结构越来越明显,形状更加规则,结构更加致密。微团直径不断增加,第4 天时微团直径为366.05 μm±4.85 μm、第5 天微团直径为390.79 μm±7.58 μm。 图1 接种密度为2×104 个/mL 的微团生长状态Fig.1 Growth status of cell spheroids at seeding density of 2×104/mL 光镜下观察,细胞接种密度越大,细胞出现黏附的趋势越强。不同接种密度下细胞微团尺寸随培养时间变化曲线如图2所示。接种密度为1×104个/mL、2×104个/mL、5×104个/mL、1×105个/mL,第3天时微团直径分别为288.14 μm±1.73 μm、344.24 μm±0.74 μm、523.29 μm±6.46 μm、 656.10 μm±4.63 μm,可以看出细胞接种密度越大,细胞微团初始直径越大。随着培养天数的增加,每种接种密度的细胞微团直径都呈缓慢增加的趋势,从第3 天到第5天,接种密度为1×104个/mL、2×104个/mL、5×104个/mL、1×105个/mL,微团直径分别增加了30.06 μm±4.91 μm、46.55 μm± 6.84 μm、59.60 μm± 0.58 μm、62.61 μm±14.34 μm。说明接种细胞密度越大,细胞微团内细胞分裂速度越快,细胞微团直径的增加速度越快。 图2 不同接种密度下细胞微团尺寸随培养时间的变化Fig.2 The relationship of cell spheroids size and culture time at different seeding densities 由于营养物质和氧气供应的逐渐减少,肿瘤球越往核心合成代谢越弱,而分解代谢越强,最终核心层细胞死亡。这种现象在肿瘤球直径超过400 μm 左右时即可出现,具有增殖活力的细胞多集中于肿瘤球外层0~300 μm 的区域内[18-19]。为保证形成微团的增殖能力,选择小于400 μm 的细胞微团进行低温保存,从微团的形成效果进行观察,接种密度为2×104个/mL 时,微团形成的状态好于接种密度为1×104个/mL,故使用接种密度为2×104个/mL 进行接种,培养至3~4 天时进行低温保存。 使用程序降温盒与程控降温仪对冻存管中的肺癌细胞微团进行慢速冷冻,复温后经AO/PI 染色存活率的结果如图3所示。由图可知,使用不同冻存体系低温保存的细胞微团中都存在大量细胞凋亡甚至死亡。使用程序降温盒与程控降温仪低温保存对细胞微团的活力以及增殖能力的影响结果见表1。可以看出,使用不同慢速冻存体系低温保存的肺癌细胞微团相对新鲜组的活力无显著差异(69.36%±4.98% vs 65.87%±10.32%),这与S.Sart 等[14]使用慢速冷冻对胚胎干细胞微团进行低温保存,复苏后细胞微团的存活率65%~68%的结果近似。培养至第3 天时细胞微团增殖率之间无显著差异(15.94%±2.00% vs 15.87%±2.09%),明显低于新鲜组细胞微团的增殖率。 图3 慢速冷冻肺癌细胞微团AO/PI 染色图像Fig.3 AO/PI staining image of cell spheroids after slow-freezing 表1 慢速冷冻细胞微团相对活力及3 天增殖率Tab.1 Relative viability and 3-day proliferation rate of cell spheroids after slow-freezing 使用塑料麦管作为冷冻载体,不同浓度低温保护剂低温保存细胞微团的存活率结果见图4。可以看出,使用VS1 低温保护剂,细胞微团中存在大量晚期凋亡或死亡细胞;使用VS2、VS3 低温保护剂,细胞微团中只有少量死亡细胞,低温保存效果明显好于VS1。使用不同浓度低温保护剂低温保存细胞微团的活力以及增殖能力的结果见表2。使用VS2、VS3低温保护剂时,细胞微团相对活力无显著差异,且明显高于VS1。培养至第3 天时,使用VS2 低温保护剂组的细胞微团增殖能力与新鲜组细胞微团的增殖率相比无显著性差异,显著高于使用VS1、VS3 组细胞微团的增殖率。 图4 塑料麦管冷冻肺癌细胞微团AO/PI 染色图像Fig.4 AO/PI staining image of cell spheroids frozen with plastic straw 表2 使用冷冻麦管冷冻细胞微团相对活力及3 天增殖率Tab.2 Relative viability and 3-day proliferation rate of cell spheroids frozen with plastic straw 使用玻璃毛细管作为冷冻载体,使用不同浓度低温保护剂低温保存细胞微团存活率的结果见图5。可以看出,使用VS1 低温保护剂,细胞微团中存在较多的晚期凋亡细胞和死亡细胞,使用VS2 低温保护剂,细胞微团中只有少量死亡细胞,或处于早期凋亡状态细胞;而使用VS3 作为低温保护剂时,细胞微团中的活细胞比例最高,说明VS3 的低温保存效果优于使用VS2、VS1。使用不同浓度低温保护剂低温保存细胞微团的活力以及增殖能力的结果见表3。使用VS3 低温保护剂时,细胞微团相对活力及3 天增值率与新鲜对照组无显著差异,且明显高于VS1、VS2 组。 图5 玻璃毛细管冷冻肺癌细胞微团AO/PI 染色图像Fig.5 AO/PI staining image of cell spheroids frozen with glass capillary 表3 使用玻璃毛细管冷冻细胞微团相对活力及3 天增殖率Tab.3 Relative viability and 3-day proliferation rate of cell spheroids frozen with glass capillary 从上述低温保存方案中,选择复苏后细胞微团活力较高及增值率较高的几组进行对比,不同低温保存方案相对新鲜细胞微团活力结果见图6,不同低温保存方案以及新鲜细胞微团培养3 天增殖率见图7。 图6 不同低温保存方案细胞微团相对新鲜细胞微团活力Fig.6 The relative viability of cell spheroids under different cryopreservation schemes 图7 不同低温保存方案下细胞的增殖能力Fig.7 Cell proliferation ability under different cryopreservation schemes 由图6 和图7 可知,上述低温保存方案中,慢速冷冻复苏后的细胞微团活力相对较差,增殖能力相对较差,不同慢速冷冻体系对于低温保存后细胞微团相对活力、增殖能力无显著性差异。使用冷冻载体直接浸入液氮低温保存的细胞微团活力及增殖能力均优于慢速冷冻组,其中使用玻璃毛细管作为冷冻载体,VS3 溶液作为低温保护剂时,复苏后细胞微团相对新鲜组细胞微团活力最高为94.59%,增殖能力与新鲜组细胞微团差异最小。这与Li Tao 等[15]使用直接接触液氮的玻璃化方法对胚胎干细胞微团进行低温保存,复苏后细胞微团的存活率为94.3%的结果近似。 在使用塑料麦管和玻璃毛细管作为冷冻载体对细胞微团进行快速冷冻时,低温保存效果优于使用程控降温仪及程序降温盒组的慢速冷冻,这与冷冻载体可实现的降温速率及低温保护剂的玻璃化转变临界降温速率有关。 使用塑料麦管和玻璃毛细管作为冷冻载体,对两种冷冻载体加载低温保护剂直接浸入液氮的温度变化进行采集,并绘制温度变化曲线,两种冷冻载体加载低温保护剂降温过程温度变化如图8所示。通过对有效降温区间(-140~0 ℃)计算,塑料麦管的降温速率为(2 207.04 ± 191.76)℃/min。玻璃毛细管的降温速率为(4 712.07 ± 143.44)℃/min。 图8 冷冻载体加载保护剂降温过程温度变化Fig.8 Temperature curve of the carrier loaded with cryoprotectant during cooling process 观察塑料麦管和玻璃毛细管两种冷冻载体加载低温保护剂后直接插入液氮的现象,发现浸入液氮后VS1 溶液出现明显结晶,VS2、VS3 溶液未出现结晶。这说明塑料麦管的降温速率(2 207.04± 191.76)℃/min、玻璃毛细管的降温速率(4 712.07± 143.44)℃/min 都未超过VS1 溶液的玻璃化临界降温速率,VS1溶液在这两种冻存体系中并未实现玻璃化只实现了快速冷冻。快速冷冻时,由于降温速率较快,细胞内的水分来不及被低温保护剂置换出来,导致细胞微团不能及时失水,细胞内外均形成大量冰晶,使细胞内溶液过冷,快速生长为大冰晶,对细胞结构形成间接损伤,破坏细胞间的连接结构,甚至引起细胞膜、细胞器受损,导致复温后细胞微团的活力和功能性受到影响。 对不同降温速率下VS2 溶液的量热学数据进行分析,如表4所示。由式(3)~式(5)可计算出VS2溶液的临界降温速率为(269.82±37.54)℃/min。 表4 VS2 溶液的量热学数据Tab.4 Calorimetric data of VS2 solution 对不同降温速率下VS3 溶液的量热学分析表明,随着降温速率的降低,60 ℃/min、30 ℃/min、15℃/min、5 ℃/min、2 ℃/min,直到降温速率为2 ℃/min,VS3 溶液在降温过程中DSC 仍然无法检测到放热现象,说明VS3 的临界降温速率< 2 ℃/min。 由于塑料麦管可实现的降温速率为(2 207.04 ±191.76)℃/min、玻璃毛细管可实现的降温速率为(4 712.07±143.44)℃/min,二者均远高于VS2、VS3 玻璃化临界降温速率,说明VS2、VS3 溶液在降温阶段实现了玻璃化。虽然VS2、VS3 溶液在塑料麦管和玻璃毛细管两种冷冻载体中都实现了玻璃化,但是由于玻璃毛细管传热性能好于塑料麦管且吸液量远小于塑料麦管,因此玻璃毛细管的降温速率高于塑料麦管,使用玻璃毛细管作为冷冻载体,VS3 溶液作为低温保护剂,降温过程中形成的玻璃化程度更高。 玻璃化冷冻与慢速冷冻的主要差异在于冷冻速度与冷冻保护剂的体积浓度不同。相比于慢速冷冻[20],玻璃化冷冻需要超快速的降温速率使降温过程中液体不发生结晶现象,由于在降温过程中细胞内外的水分子迅速度过相变温区,避免细胞内外冰晶的形成,保持了细胞微团较好的活性以及结构的完整性并保持了良好增殖能力。此外,玻璃化冷冻需要高浓度的低温保护剂,高浓度低温保护剂通过降低溶液的凝固点和提高溶液黏度来促进玻璃化的实现,同时保护剂体积浓度高,渗透压较大可加快跨膜传质。VS3溶液相比于VS1、VS2 溶液浓度最大,渗透压最高,在相同的平衡时间内低温保护剂跨膜运输更快,细胞微团内部保护剂浓度越高,且短时间的平衡时间细胞受到的毒性损伤较小。但同时低温保护剂自身毒性也大,因此只有在较短的平衡时间保证渗透充分且充分洗脱才可避免低温保护剂对细胞微团的毒性损伤。 本文研究了A549 肺癌细胞的接种密度以及培养天数对细胞微团尺寸及生长状态的影响,得到如下结论: 1)细胞接种密度为2×104个/mL,培养3 天的细胞微团状态良好,尺寸约300~400 μm,适用于低温保存。 2)使用程序降温盒、程控降温仪两种慢速冷冻法低温保存肺癌细胞微团,复苏后细胞微团活力相对新鲜组细胞微团活力为69.36%和65.87%,3 天增殖率分别为15.94%和15.87%,远低于新鲜组细胞微团增殖能力。 3)使用塑料麦管和玻璃毛细管快速或玻璃化保存肺癌细胞微团,当采用玻璃毛细管为冷冻载体,以含有20%EG +20%Me2SO +0.5 mol/L 海藻糖的DMEM 作为低温保护剂时,复苏后细胞微团相对新鲜组活力为94.59%±9.23%,3 天增殖率与新鲜组最为接近。 4)热力学分析表明塑料麦管和玻璃毛细管可实现的降温速率分别为(2 207.04±191.76)℃/min 和(4 712.07±143.44)℃/min,未达到VS1 溶液的玻璃化临界降温速率,而高于VS2、VS3 玻璃化临界降温速率,因此VS1 溶液在这两种冻存体系中是快速冷冻,而VS2、VS3 溶液在两种冻存体系中可以实现玻璃化。1.9 数据分析
2 结果与讨论
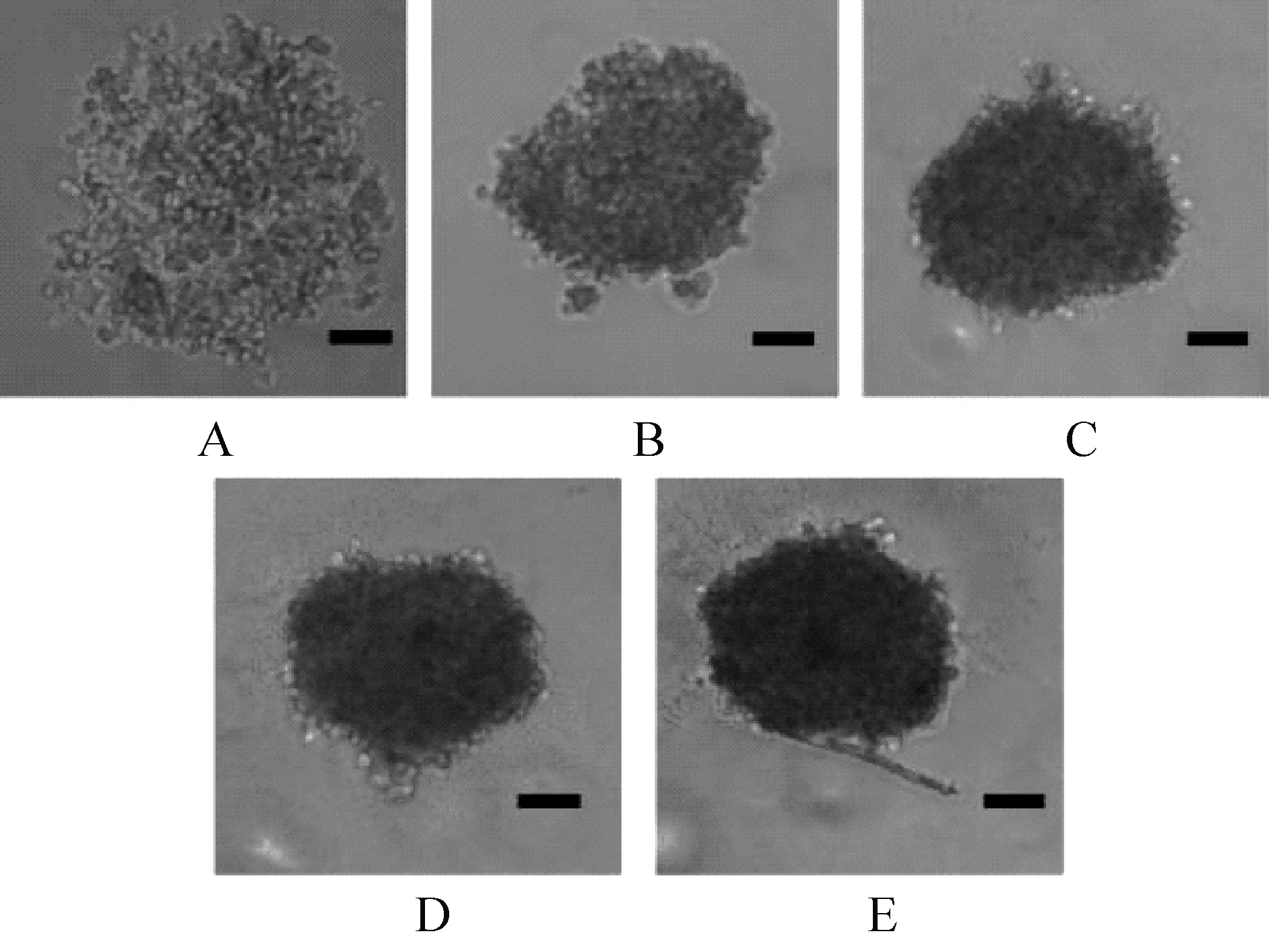
2.1 培养天数对细胞微团形成的影响
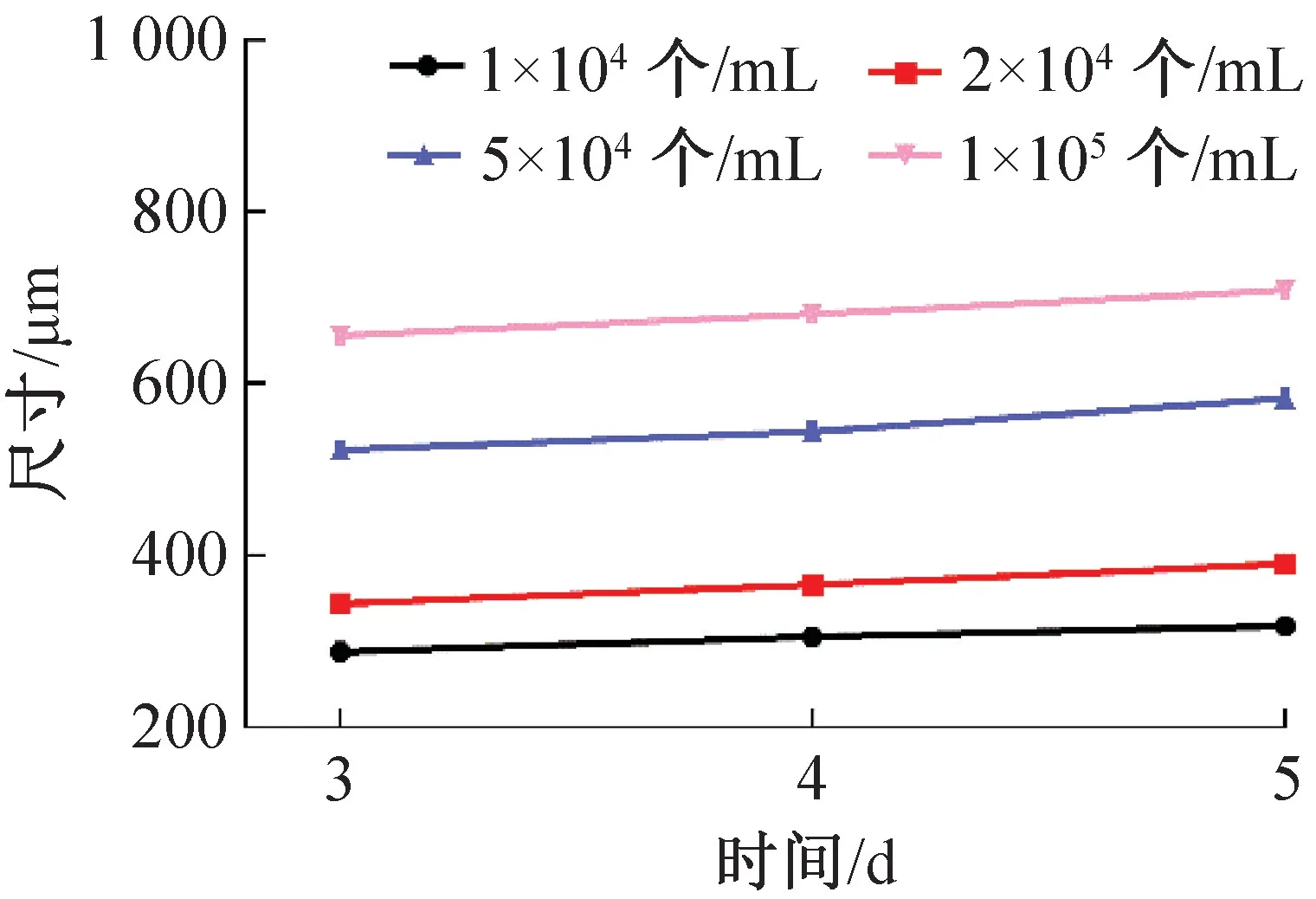
2.2 细胞接种密度对细胞微团形成的影响
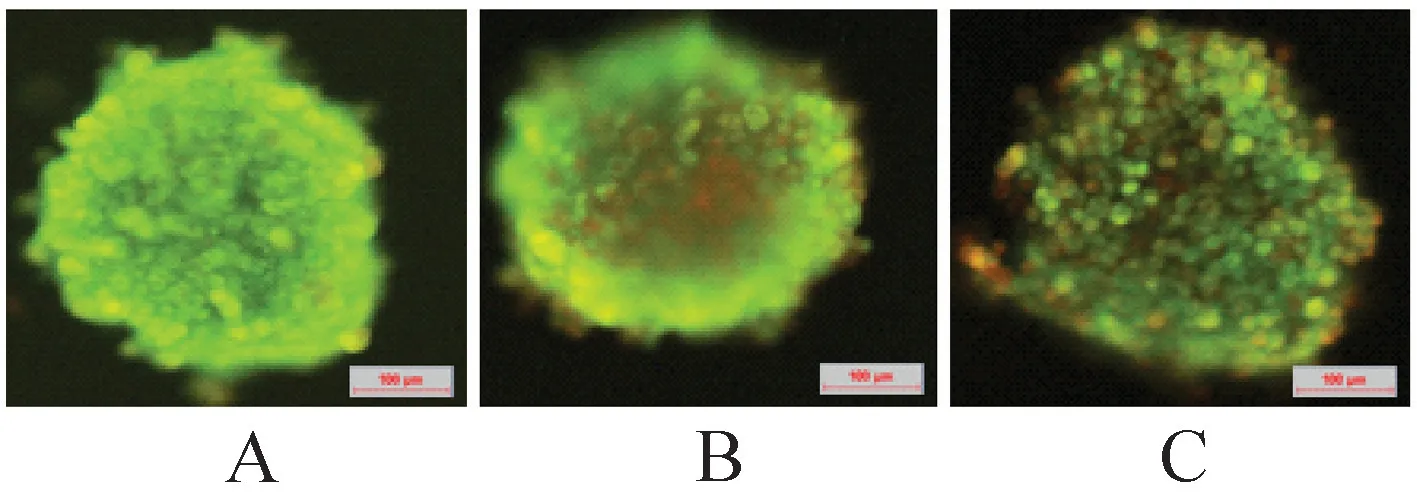
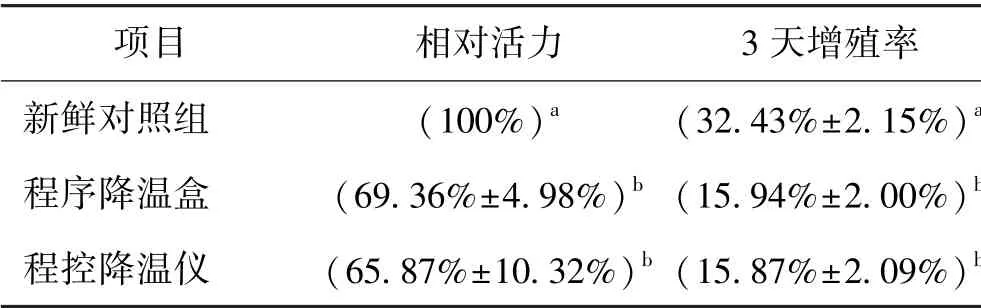
2.3 慢速冷冻肺癌细胞微团
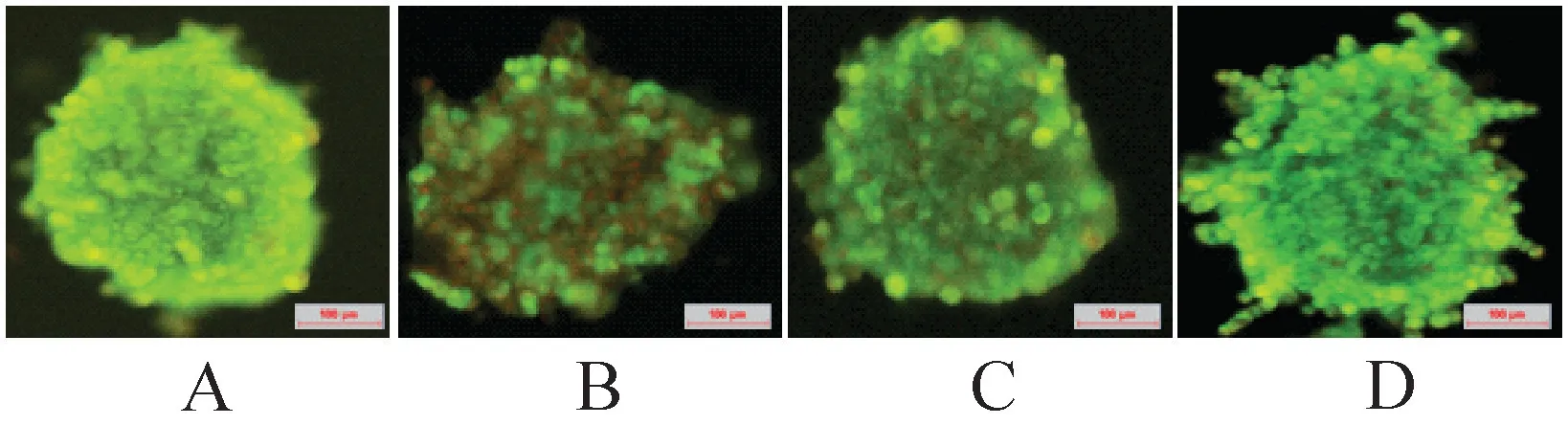
2.4 塑料麦管冷冻肺癌细胞微团
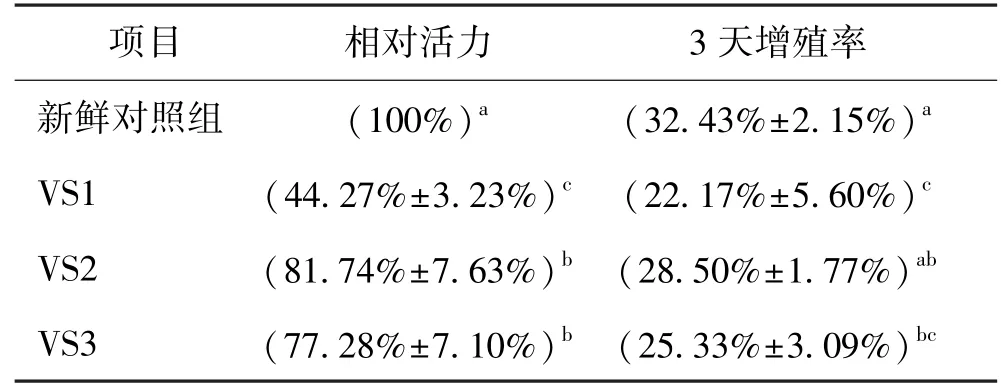
2.5 玻璃毛细管冷冻肺癌细胞微团
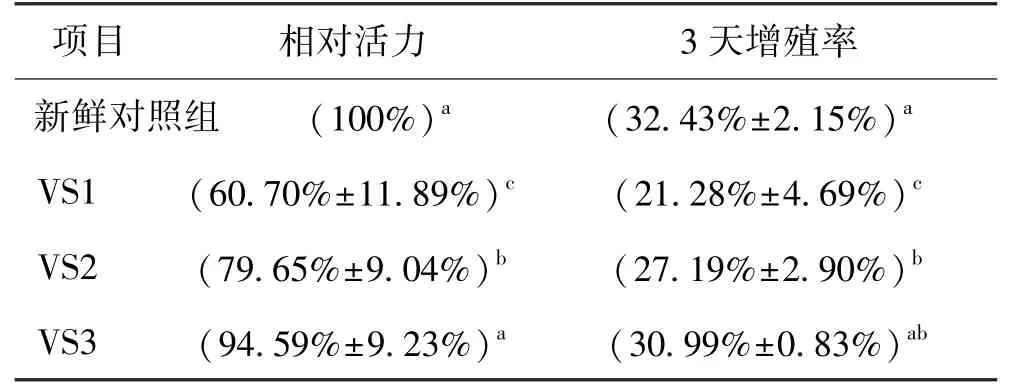
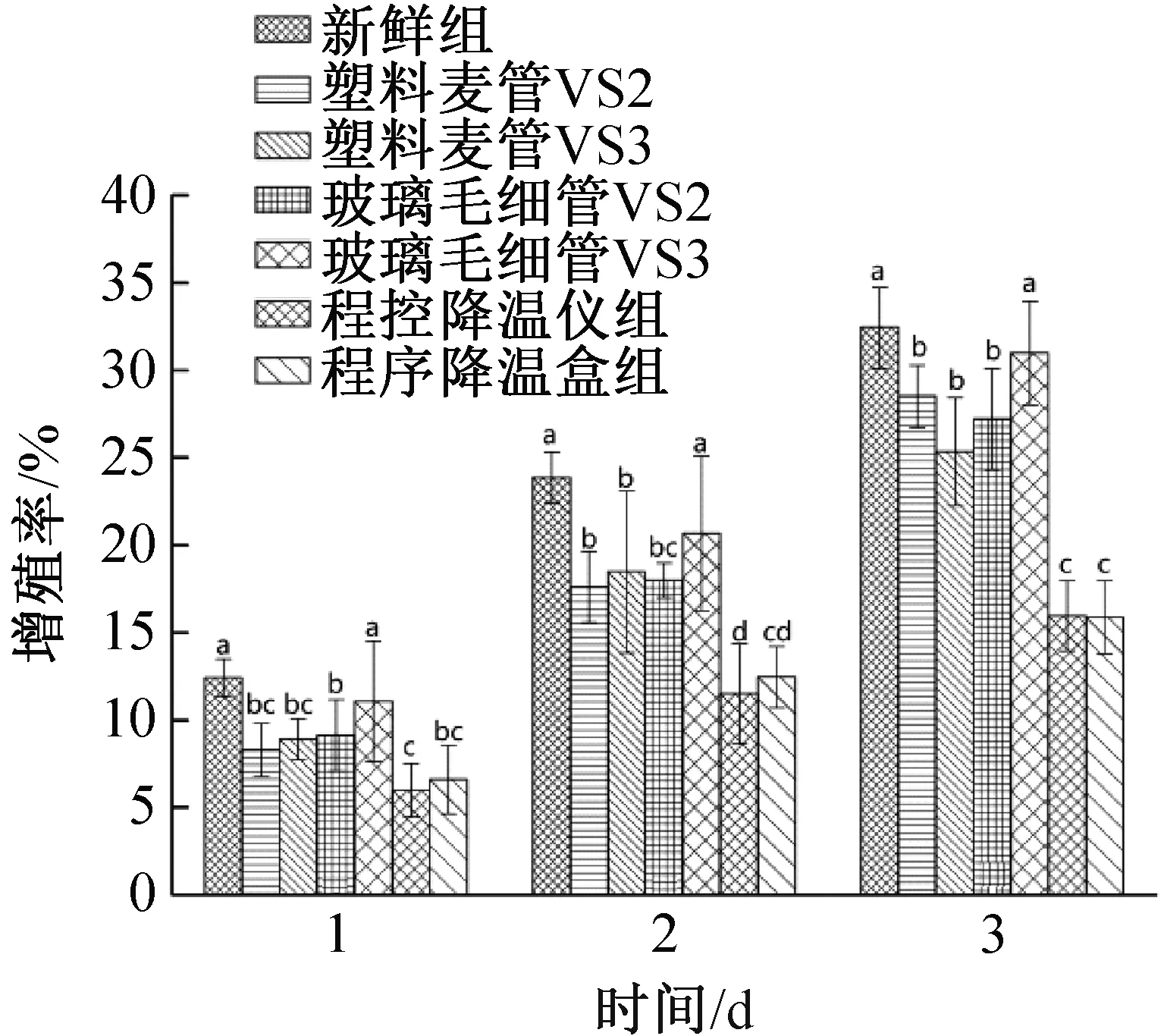
2.6 不同冷冻方法的对比

2.7 肺癌细胞微团快速及玻璃化冻存的热力学分析

3 总结

