基于Illumina MiSeq和IonS5 XL测序对原料乳中微生物多样性的比较分析
苟 萌,胡 婕,张彤彤,剧 柠
(宁夏大学 农学院,宁夏 银川750021)
原料乳指的是未经加工处理的生鲜牛乳,在富含多种天然营养物质的同时,也为微生物生长提供了绝佳的环境[1]。原料乳中微生物种类繁多,导致乳及乳制品在存储及加工过程中的变化具有复杂性。细菌是导致原料乳品质变化的主要微生物[2]。因此,研究原料乳中的细菌种类及数量对乳及乳制品的品质控制尤为重要。早期的微生物纯培养法、传统核酸扩增等技术操作复杂、检测灵敏度低,已经无法满足对乳及乳制品中微生物的深入研究。高通量测序技术也叫第二代测序技术,具有时效高、精度高、通量高、成本低、操作简单等优点,目前已被广泛应用于肠道环境、土壤、食品等领域的微生物多样性研究。
近年来各类测序平台快速发展,研究表明,不同测序平台因测序质量与深度的不同,对相同样本亦可产生不同的微生物多样性结果[3-4]。Illumina MiSeq测序与IonS5 XL测序是目前常用的高通量测序平台。Illumina MiSeq测序能够使多个样品在不同区域内同步测序,其读长较短,结果准确性高,覆盖度深,已被广泛用于研究醋[5]、豆酱[6]和茶叶[7]等食品,也是目前研究原料乳[8-9]、巴氏杀菌乳[10]、发酵乳[11]以及干酪[12]中微生物群落结构的重要工具。IonS5 XL测序平台的读长长于Illumina MiSeq平台,最长可达600 bp。测序时间比Illumina MiSeq更短,且成本更低,多被应用于肠道菌群、发酵肉[13]、冰鲜鸡肉[14]的微生物菌相分析,在乳及乳制品微生物研究中的应用报道较少。基于IonS5 XL测序时效性高、成本低的优点,利用它对原料乳中微生物进行测序,探究其是否适用于乳及乳制品微生物多样性的研究,能够为获取更加准确全面的乳及乳制品微生物信息提供方法依据。
作者以原料乳为研究对象,采用16SrDNA扩增子技术,利用Illumina MiSeq和IonS5 XL两种不同的测序平台对原料乳中微生物多样性进行分析,通过OTU聚类分析、alpha多样性分析、物种注释和丰度分析,探讨两种测序平台结果一致性,比较两种测序平台之间的差异,分析各自的优缺点及适用性,为今后乳及乳制品微生物测序平台的选择、群落结构研究提供理论依据。
1 材料与方法
1.1 主要仪器、设备及试剂
TGL-16M高速台式冷冻离心机:湖南湘仪离心机仪器有限公司产品;C200凝胶成像分析系统:北京百晶生物技术有限公司产品;核酸纯度测定仪:德国TITERTEK BERTHOLD公司产品。
DNeasy PowerFood Microbial Kit(100)试剂盒:德国QIAGEN公司产品;TruSeq Nano DNA LT Library Prep Kit试剂盒:美国Illumina公司产品;AxyPrepDNA凝胶回收试剂盒:美国AXYGEN公司产品;GeneJET凝胶回收试剂盒:Thermo Scientific公司产品;Ion Plus Fragment Library Kit 48 rxns建库试剂盒:Thermo Fisher公司产品。
1.2 试验方法
1.2.1 样品收集及预处理 严格遵循无菌操作,采集宁夏银川市某乳品企业乳罐中原料乳样品,经无菌容器密封后放入4℃车载冰箱,2小时内运回实验室,在4℃冰箱中冷藏72 h后进行样品总细菌DNA的提取。
1.2.2 DNA的提取 在QIAGEN DNeasy PowerFood Microbial Kit(100)试剂盒的改良基础上提取总DNA,具体操作如下:先将10 mL均质原料乳样在5 000g、4℃下离心10 min,去除多余上清液和脂肪,再加入3 mL无菌水,使用涡旋混匀器将无菌水和菌体沉淀混匀后,5 000g、4℃下离心5 min,去除多余的上清液和脂肪,加入2 mL PBS缓冲液,混匀后吸取2 mL菌液,按照QIAGEN DNeasy PowerFood Microbial Kit(100)试剂盒操作说明进行操作,并在第(4)步(转移重悬的细胞到PowerBead Tube上)之后进行55℃、10 min水浴,在第(19)步(在白色滤膜中加入100μL EB溶液,13 000g离心1 min)改为加入80μL EB溶液。
将提取的DNA用1.0 g/dL琼脂糖凝胶电泳和核酸纯度测定仪进行浓度和纯度检测。DNA样品混匀后平分6份,分别编号为1—6,置于-20℃冰箱冻存,送样备用。
1.2.3 Illumina MiSeq测序平台的检测 1—3号核酸样本采用Illumina MiSeq平台进行测序。选择细菌的16S rRNA基因的V4—V5区作为目的扩增段,使用引物515F(GTGCCAGCMGCCGCGGTAA)和引物907R(CCGTCAATTCMTTTRAGTTT)进行扩增。扩增体系为(25.0μL):5×reaction buffer 5.0μL,5×GC buffer 5.0μL,dNTP(2.5 mmol/L)2.0μL,正向引物(10μmol/L)1.0μL,反向引物(10μmol/L)1.0μL,DNA模板2.0μL,ddH2O 8.7μL,Q5高保真DNA聚合酶0.3μL。PCR扩增程序为:98℃预变性2 min;98℃变性15 s,55℃退火30 s,72℃延伸30 s,进行25次循环;最后72℃延伸5 min。使用2.0 g/dL琼脂糖凝胶电泳对PCR扩增产物进行检测,采用AXYGEN公司的凝胶回收试剂盒对目标片段进行切胶回收。将扩增回收产物进行荧光定量,使用TruSeq Nano DNA LT Library Prep Kit试剂盒制备测序文库,2.0 g/dL琼脂糖凝胶电泳进行文库最终的片段选择与纯化,在Solex MiSeq 2500测序平台上进行300 bp双端测序。
1.2.4 IonS5 XL测序平台的检测 4—6号核酸样本采用IonS5 XL平台进行测序。选择细菌的16S rRNA基因的V4—V5区作为目的扩增段,将DNA样本使用无菌水统一稀释至1 ng/μL。用引物515F(GTGCCAGCMGCCGCGGTAA)和引物806R(CCGT CAATTCMTTTRAGTTT)进行扩增。扩增体系为(30.0μL):Phusion Master Mix(2×)15.0μL,引物(2μmol/L)3.0μL,DNA模板10.0μL,H2O 2.0μL。PCR扩增程序:98℃预变性1 min;98℃变性10 s,50℃退火30 s,72℃延伸30 s,30个循环;最后72℃延伸5 min。使用2.0 g/dL的琼脂糖凝胶对PCR产物进行电泳检测,根据PCR产物浓度进行等量混样后采用1×TAE电泳缓冲液,2.0 g/dL的琼脂糖凝胶电泳纯化PCR产物,采用Thermo Scientific公司GeneJET凝胶回收试剂盒切胶回收产物。使用Ion Plus Fragment Library Kit 48 rxns试剂盒进行文库构建,经过Qubit定量和文库检测合格后,使用IonS5 XL进行400 bp单端测序。
1.2.5 测序数据优化处理与分析 获得原始数据(raw data)后使用FLASH软件和Trimmomatic软件对其分别进行拼接和质控,设置50 bp的窗口,去除平均长度小于20 bp的序列后端的序列,再去除质控后长度小于50 bp及含N碱基的序列;将Overlap长度小于10 bp及错配比率大于0.2的序列去除,根据序列首尾两端的Barcode和引物区分样品并调整序列方向,Barcode允许的错配数为0,最大引物错配数为2,去除存在模糊碱基的序列,最终得到优化序列。
利用Uparse 7.1(http://www.drive5.com/uparse/)在97%相似度下进行OTU聚类,对于优化序列,去除单序列,并在聚类过程中去除嵌合体;参考Silva数据库(http://www.arb-silva.de),采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,以获取每个OTU对应的物种分类信息,置信度阈值为0.7。利用Mothur 1.30.2(https://www.mothur.org/wiki/Download_mothur)进行alpha多样性分析,并利用R语言制作稀释曲线、丰度等级曲线、Venn图、群落柱形图以及主成分分析(PCA)图。通过OTU的物种注释信息并结合OTU丰度表对门和属两个生物学水平上的物种丰度结果进行物种多样性和测序重复性比较。
2 结果与讨论
2.1 测序数据预处理及质控结果比较
测序得到的最初的序列即为原始序列,其中存在一定比例的干扰数据,对原始数据进行质控,得到有效序列后进行OTU聚类和物种分类分析。由两个测序平台测序数据及质控结果比较(见表1)可知,Illumina MiSeq测序得到的原始序列数低于IonS5 XL测序,但经过相同的质控参数优化处理后,Illumina MiSeq测序平台的有效序列在原始序列中所占比例为89.61%,高于IonS5 XL测序的76.13%的结果,说明IonS5 XL测序得到的原始序列数据量虽然大,但低质量序列数目较多。而由两个测序平台所得出的平均读长可以看出,IonS5 XL测序的序列平均读长为410 bp,高于Illumina MiSeq测序得出的平均读长372 bp。因此,虽然IonS5 XL测序平台识别出较多的原始序列数,但可能是由于这些原始序列并非全部为高质量序列,经质控处理后低质量序列最终被剔除。

表1 Illumina MiSeq测序和IonS5 XL测序结果统计比较Table 1 Statistical comparison between Illumina MiSeq sequencing and IonS5 XL sequencing
2.2 OTU分类地位鉴定结果比较
从门、纲、目、科、属各分类学水平下注释物种数来看(见表2),IonS5 XL平台注释出的物种数目均多于Illumina MiSeq平台,分别是Illumina MiSeq的1.6倍、1.5倍、1.6倍、1.6倍、1.9倍,总OTU数为Illumina MiSeq测序的2.5倍。可见IonS5 XL测序能够得到更多的物种信息。

表2 Illumina MiSeq测序和IonS5 XL测序在各分类水平上注释物种数比较Table 2 Comparison of the annotated species numbers at each taxonomic level between Illumina MiSeq sequencing and IonS5 XL sequencing
2.3 Alpha多样性结果比较
2.3.1 多样性指数结果比较 微生物群落alpha多样性可由多种指数反映。不同的指数对于衡量群落多样性的侧重点各不相同,常用的度量指数主要包括侧重于体现群落丰富度的Chao1指数和ace指数,兼顾群落均匀度的Shannon指数和Simpson指数,以及反映群落覆盖度的Coverage指数。一般而言,Chao1或ace指数越大,表明群落的丰富度越高;Shannon值越大,说明群落多样性越高;Simpson指数值越大,说明群落多样性越低。通常Shannon指数对群落的丰富度以及稀有OTU更敏感,而Simpson指数对均匀度和群落中的优势OTU更敏感。Coverage是指各样本文库的覆盖率,其数值越高,则样本中序列被测出的概率越高。该指数反映本次测序结果是否代表了样本中微生物的真实情况[5]。Alpha多样性指数表(见表3)显示,两个测序平台所得出的Coverage值均高于99.00%,说明样品文库覆盖率足够大,两个测序平台的结果足够反应样本的真实情况;就Chao1指数和ace指数而言,IonS5 XL平台检测到的结果分别为Illumina MiSeq平台检测到的2.2倍和2.09倍,且差异性显著(P﹤0.05),表明IonS5 XL测序检测到的物种丰富度要高于Illumina MiSeq测序;IonS5 XL测序的Shannon指数是Illumina MiSeq测序的1.32倍,Illumina MiSeq测序样本的Simpson指数是IonS5 XL测序的1.58倍,这说明本实验中IonS5 XL测序所得到的微生物结构可能会更加丰富。
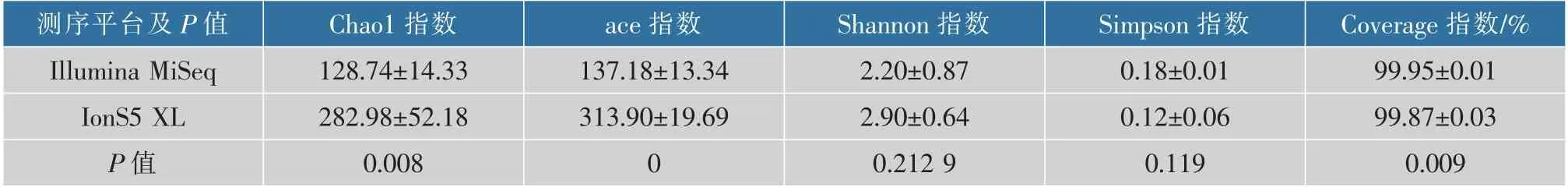
表3 Illumina MiSeq测序和IonS5 XL测序的alpha多样性指数Table 3 Alpha diversity index of Illumina MiSeq sequencing and IonS5 XL sequencing
2.3.2 稀释曲线结果比较 稀释曲线可直接反映当前测序数据量的合理性,并间接反映样本物种的丰富程度,当曲线趋向平坦时,说明测序数据量渐进合理,增加数据量只会产生少量新的物种。两测序平台的稀释曲线见图1,横坐标代表随机抽取的测序数据量,纵坐标代表观测到的物种数量。对Illumina MiSeq和IonS5 XL测序所得序列进行抽样分析,随着测序深度的增加,曲线逐渐变得平坦,表明原料乳样品中绝大部分微生物已经被检测出,此测序水平可以表示出样品微生物的多样性,两个平台的测序量均可满足实验要求。
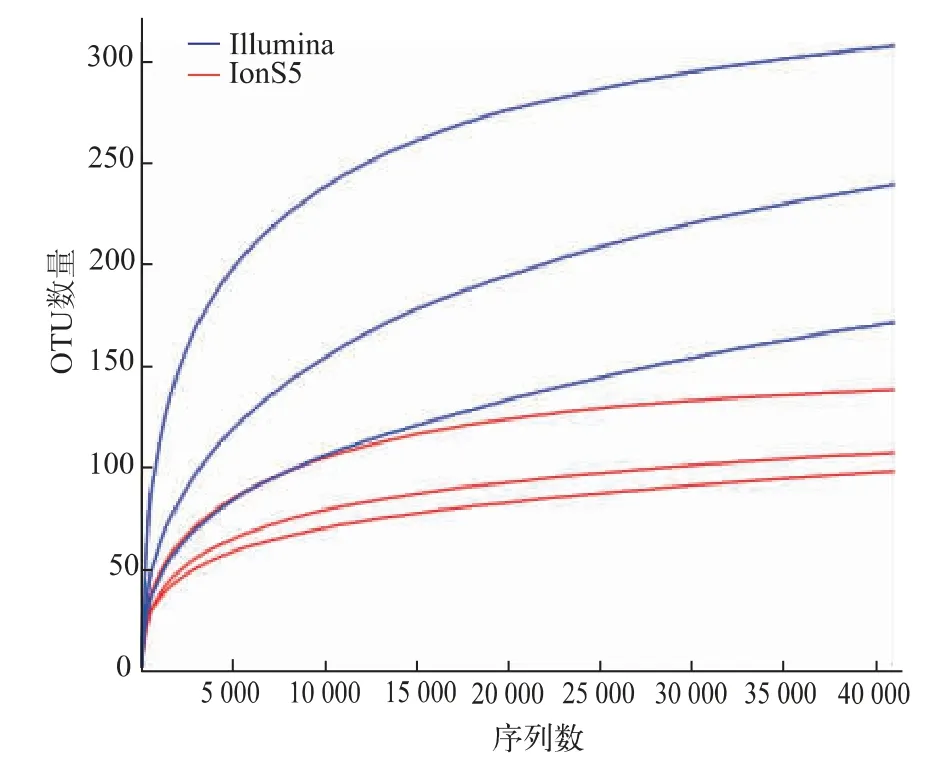
图1 Illumina MiSeq测序和IonS5 XL测序的稀释曲线Fig.1 Rarefaction Curve of Illumina MiSeq sequencing and IonS5 XL sequencing
2.4 丰度等级曲线结果比较
丰度等级曲线的横坐标代表某分类学水平下的OTU数目排序等级,纵坐标表示该分类水平下物种数目的相对百分含量,样本曲线延伸终点的横坐标位置为该样本的物种数量,若曲线下降平缓则表明样本的物种多样性越高,而曲线下降快速陡峭则表明样本中的优势菌群所占比例很高,物种多样性较低。随着物种等级的增加,两个测序平台得出的相对丰度均降低并逐渐趋于平缓(见图2),表明此测序水平下,二者均已检测出原料乳中绝大部分微生物。而Illumina MiSeq测序得到的丰度等级曲线下降比较陡峭,IonS5 XL测序得到的曲线下降较为平缓,说明IonS5 XL测序比Illumina MiSeq测序所得的物种数量多。
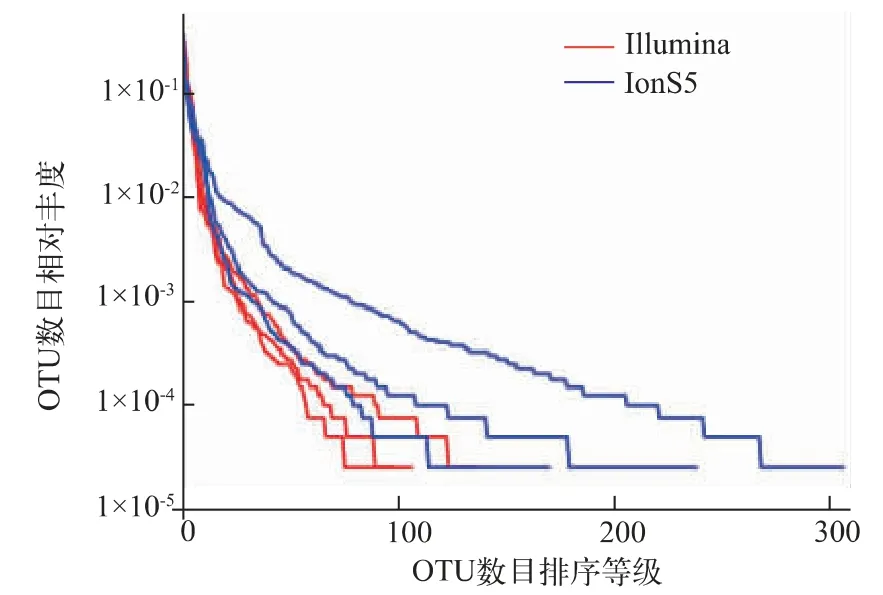
图2 Illumina MiSeq测序和IonS5XL测序的丰度等级曲线图Fig.2 Rank abundance of Illumina MiSeq sequencing and IonS5 XL sequencing
2.5 细菌的物种分类注释结果比较
2.5.1 门水平上的物种相对丰度 在门水平上,Illumina MiSeq平台检测到了8个细菌门,IonS5 XL平台检测到13个细菌门(见表2),说明原料乳的微生物多样性组成丰富,并且IonS5 XL测序覆盖的细菌菌群比Illumina MiSeq测序更加广泛。进一步分析比较门分类水平下Illumina MiSeq与IonS5 XL测序的物种相对丰度可知(见图3),两个平台检测到原料乳中的优势菌门组成差别不大,且优势菌门均为变形菌门(Proteobacteria),这与前人报道一致[1,8,11]。Illumina MiSeq测序与IonS5 XL测序所检出的变形菌门平均相对丰度分别为72.4%和58.8%,但差异性并不显著(P>0.05)。拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)也是原料乳中常见的菌门[15-17],且两测序平台相对丰度的差异性也并不显著(P>0.05)。Mareike等[18]采用传统的选择性培养法对冷藏72 h原料乳中的微生物进行研究,所分离鉴定出的菌株归属于拟杆菌门、厚壁菌门与变形菌门,与作者所选用的两个测序平台的优势菌门结果一致,说明两个测序平台在分析乳中微生物方面结果准确可靠。
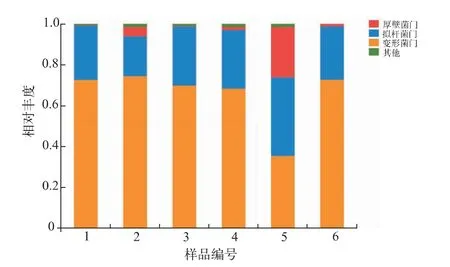
图3 门分类水平下Illumina MiSeq与IonS5 XL测序的物种相对丰度Fig.3 Relative abundance of predominant bacteria in phylum classification level of Illumina MiSeq sequencing and IonS5 XL sequencing
2.5.2 属水平上的物种相对丰度及差异 Illumina MiSeq测序检测到123个细菌属,IonS5 XL测序检测到178个细菌属(见表2)。对两个测序平台属水平上的物种丰度进行进一步研究分析(见图4),Illumina MiSeq与IonS5 XL平台所检测到原料乳中的优势菌属均为假单胞杆菌属(Pseudomonas),在已检测出的细菌属中平均占比分别为56.6%和48.1%,见图5,差异性不显著(P>0.05)。两测序平台也都在原料乳中检出了金黄杆菌属(Chryseobacterium)、黄杆菌属(Flavobacterium)和不动杆菌属(Acinetobacter),以及少量沙雷氏菌属(Serratia)和另支菌属(Alistipes),相对丰度的差异均不显著(P>0.05)。先前的研究显示,尽管环境、泌乳期、冷藏温度等因素会造成原料乳中微生物存在差异,但其中主要菌属结构相同。李玲等[8]利用高通量测序技术对原料乳冷藏过程中微生物多样性进行研究,结果显示,冷藏72 h后原料乳中的优势菌属为假单胞杆菌属,相对丰度高达51.0%;Nuwan[19]利用MALDI-TOF MS和16S rRNA技术对原料乳中嗜冷微生物进行分离鉴定,得到的604株分离菌株有19.9%属于假单胞杆菌属;于国萍等[20]研究原料乳时,不动杆菌属的相对丰度也位于前列。Mareike[18]利用选择性培养法获得了乳中的黄杆菌属菌种。因此,在原料乳优势菌属的检测上,两个平台的结果均可满足准确性的要求。
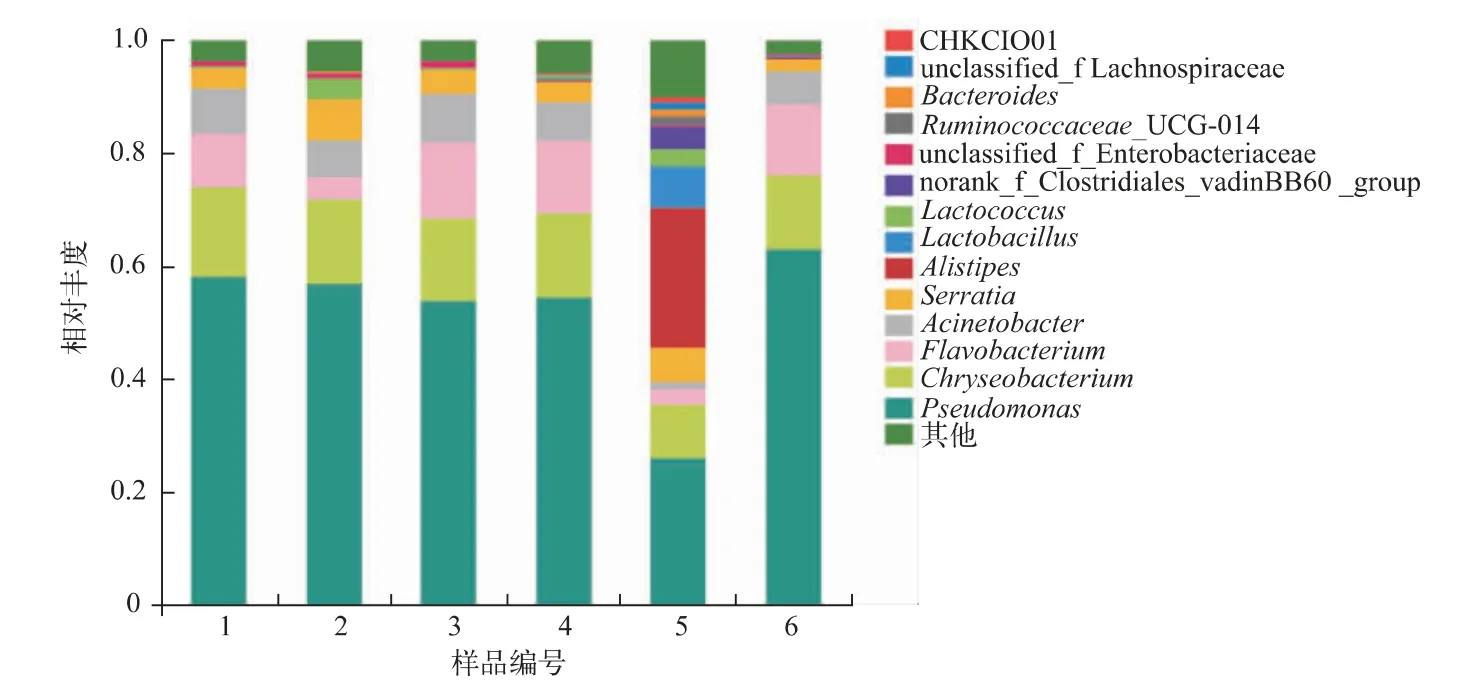
图4 属分类水平下Illumina MiSeq与IonS5 XL测序的物种相对丰度Fig.4 Relative abundance of predominant bacteria in genus classification level of Illumina MiSeq sequencing and IonS5 XL sequencing
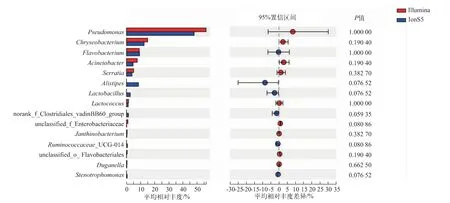
图5 Illumina MiSeq测序与IonS5 XL测序属水平多物种差异检验柱形图Fig.5 Wilcoxon rank-sum test bar plot on Genus level of Illumina MiSeq sequencing and IonS5 XL sequencing
2.6 测序平台稳定性比较
分别对两个测序平台的平行样本中共有和独有的OTU进行Venn图绘制(见图6),Illumina MiSeq测序检测到平行样本中共有的OTU个数为85,占所有OTU的57.4%;IonS5 XL测序检测到原料乳中共有的OTU个数为154,占所有OTU的40.5%。Illumina MiSeq测序得到的各平行样本的独有OTU数目差距较小,而IonS5 XL测序的各平行样本的独有OTU数目差距较大。可初步认为针对原料乳菌群多样性的研究,Illumina MiSeq平台的重复性优于IonS5 XL平台。此外,从稀释曲线(见图1)以及DNA样品丰度等级曲线(见图2)来看,Illumina MiSeq平台测得的3个平行样本的物种数量以及丰度等级的重合度均高于IonS5 XL平台。
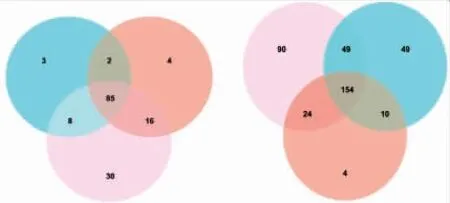
图6 Illumina MiSeq测序和IonS5 XL测序基于OTU的Venn分析比较Fig.6 Venn analysis comparison based on OTU between Illumina MiSeq sequencing and IonS5 XL sequencing
主成分分析(PCA)是通过分析不同样本群落组成,反映样本间的差异和距离。样本物种组成越相似,反映在PCA图中的距离越近[21]。图7可以看到Illumina MiSeq测序的3个样本点距离较近,其中两个样本点有重叠现象,说明平行样本之间差异较小。而IonS5 XL测序的3个样本点距离较远,分布离散,群落结构差异较大。再次证明了本实验中,Illumina MiSeq平台的检测结果具有更高的稳定性与生物学重复性。
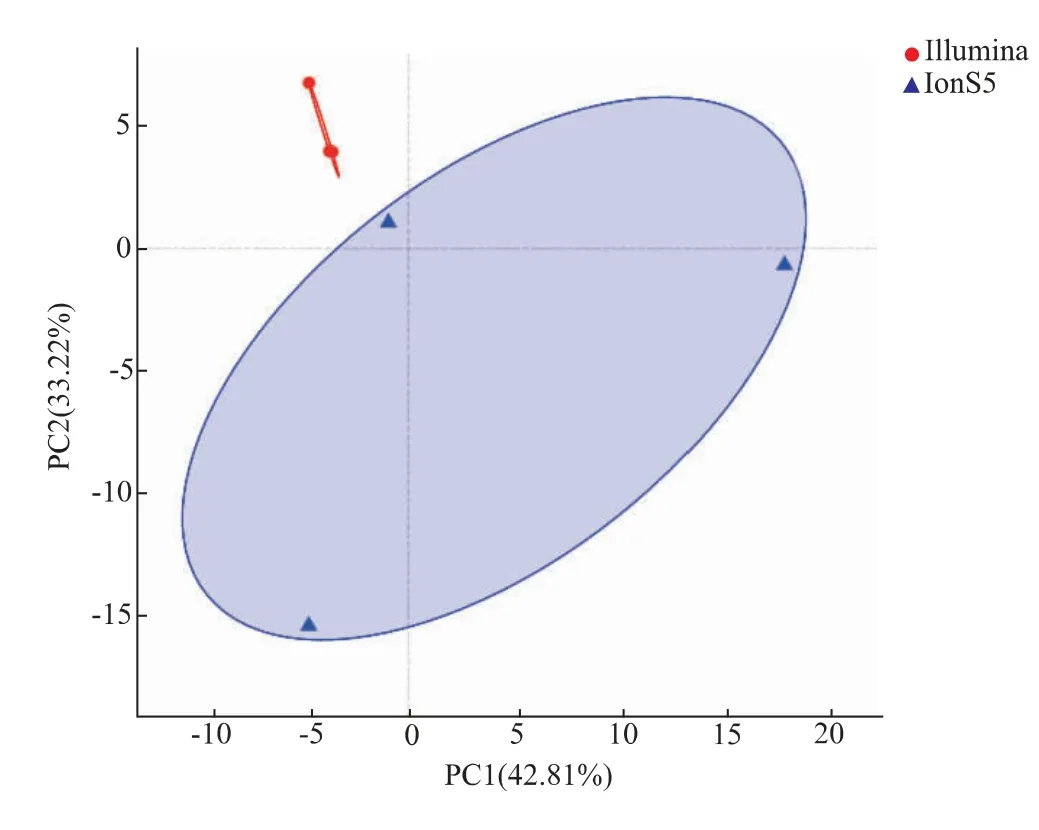
图7 Illumina MiSeq与IonS5 XL测序对样本属水平的PCA分析Fig.7 PCA analysis on genus level of Illumina MiSeq sequencing and IonS5 XL sequencing
通过门水平和属水平上细菌相对丰度的分析,可以看出随着分类水平的降低,两个平台所检出的物种丰富度差异增大,在属水平上,IonS5 XL测序检测得到的菌属种类要多于Illumina MiSeq测序。然而两个测序平台所检出的优势菌属相同,对两个平台所得到的各优势菌属的相对丰度进行差异分析,发现两者之间并不存在显著性差异。Anna等[22]采用Illumina MiSeq与IonS5用于草药茶的微生物组成分析,最终两个平台在定性和定量上都产生了一致的结果。本研究中,可初步认为两个平台对原料乳中优势菌群的检测结果具有一致性,且对优势菌群的检测均具有准确性。
本实验中两个平台的优势群落组成差异虽然不显著,但依然可以看出优势菌群在Illumina MiSeq测序结果中的占比与IonS5 XL测序结果相比较高,IonS5 XL测序所检出的菌属尤其稀有菌属多于Illumina MiSeq测序。何世耀等[3]的研究表明测序深度会影响微生物群落的丰富度。测序深度较低时,环境中的群落大多由高丰度微生物组成,从而掩盖了低丰度微生物信息,低估了环境微生物的多样性。
此实验中,IonS5 XL测序结果表现出来的稳定性和重复性不高,平行样本间离散程度较大,这可能与数据量不足有关,尚需大量的实验数据继续验证。另外,前人的研究中发现,测序的错误率会随着读长增加而提升,需要在质控环节严格控制,降低错误干扰[3]。即也可能是因为IonS5 XL较长的读长引起的测序错误,进而影响了平行样本间结果稳定性。这也是后续比较测序平台时可供参考的方向。
一个好的测序平台应当具备测序时间短、生物学重复性良好、稳定性高等特点,并且能展示出全面准确的物种多样性信息。Illumina MiSeq测序是最常见的二代双端测序平台之一,测序时间大约为28~56 h,是常被用于乳品微生物研究领域的测序平台之一[23]。IonS5 XL测序是Thermo公司近年来推出的较新的二代单端测序平台,能够在较短的时间(约2~11 h)内完成测序,且测序费用低于Illumina Miseq平台,常被用于临床试验及真菌多样性的检测[24],尚未见应用于乳品研究领域的报道。作者比较了两测序平台在原料乳微生物多样性中的应用,结果显示二者均能检出相同的优势菌相,且相对丰度差异性不显著,测序结果具有一致性。从物种丰富度来看,IonS5 XL测序可检出乳中更多的低丰度微生物,获得更全面的生物信息。但在各平台3个平行样本的检测结果中发现,IonS5 XL测序的重现性不如Illumina MiSeq测序。后期需加大样本量进一步分析。相信经过针对性改进后,IonS5 XL测序将在乳品微生物研究领域拥有更大的应用空间。
3 结语
作者利用Illumina MiSeq与IonS5 XL两种高通量测序对原料乳中的微生物多样性进行研究。IonS5 XL与Illumina MiSeq两种测序所得到的原始数据经过相同的预处理及质控后,结果均可满足实验需求。IonS5 XL高通量测序相较于Illumina MiSeq能够获得更多的OTU,鉴定出更多的微生物群落,且对低丰度菌群较为敏感。而Illumina MiSeq测序的广泛度不够,忽略了某些稀有物种,低估了样本的微生物多样性。在优势菌相上,两测序平台获得的信息相同,差异性并不显著,说明IonS5 XL测序同样适用于乳品微生物检测。值得注意的是,无论是平行样本之间稀释曲线、丰度等级曲线以及物种丰度的结果,都显示Illumina MiSeq测序结果的重现性优于IonS5 XL测序。因此,Illumina MiSeq测序目前依然能够为原料乳微生物多样性的研究提供稳定且较为全面准确的测序信息,而IonS5 XL测序在针对稳定性进行改进后,能够替代Illumina MiSeq测序,更为全面、快捷地研究乳品微生物多样性。

