盐湖高锂卤水中硫酸根的分离与锂的迁移
马 丽,孟永涛,毕秋艳,房晓宇,关云山
(1.青海大学化工学院,青海西宁810016;2.青海省化工设计研究院有限公司)
锂是自然界中最轻的碱金属元素,在许多行业都有广泛的应用,如制造业、核工业和电池工业[1];玻璃、陶瓷、冶金、润滑剂、橡胶、制药和锂离子电池的生产[2-3]。锂金属必将在能源领域中占据一席之地,已经被广泛认可为“21世纪高科技发展的关键能源金属材料”[4],同时也被誉为“推动世界前进的重要元素”,具有极高的战略价值[5]。
近年来,随着新能源汽车尤其是电动汽车的快速发展,锂的需求量不断增加[6-7]。目前,提取锂的原料主要有两种:含锂矿物和盐湖卤水[8]。中国锂资源结构中盐湖卤水锂资源所占比例接近80%[9],而且目前从盐湖卤水中生产的锂占锂总产量的60%以上[10]。中国的卤水锂资源主要分布在青海、西藏等西部地区,青藏高原地区的盐湖除碳酸盐型盐湖外均为高镁锂比盐湖[10]。由于高镁锂比盐湖卤水沉淀除镁的试剂消耗量大,不宜采用传统的提锂工艺,近年来有不少学者研究开发了许多提取锂的新工艺,如煅烧浸取法、溶剂萃取法、离子交换与吸附法、膜分离法和盐析法等[10]。但是,这些新工艺在高镁锂比盐湖卤水中提取锂还存在很多不足,有待进一步提升和完善盐湖卤水提锂成本的降低、可采储量的增大、环境友好性[11],故从盐湖卤水中提锂将成为中国锂行业的发展趋势,同时也具有重要的现实意义与经济价值。
目前,中国已开发成功的盐湖提锂技术包括蒸发浓缩沉淀法(适合低镁锂比盐湖卤水,如美国西尔斯盐湖与智利的Atacama盐湖均采用此方法生产碳酸锂)、煅烧浸取法(硫酸盐型盐湖)、溶剂萃取法(比较适用于高镁盐湖卤水提锂)、膜分离法(电渗析法和纳滤膜分离)。虽然膜分离法工艺较为简单、分离效果较好,但是膜的成本较高、膜中毒较为严重、使用寿命较短[12];离子交换与吸附法、盐析法(该方法对设备的耐腐蚀性要求较高,因为析出固体夹带锂,因此锂的回收率较低,此工艺也不足以应用于实际的盐湖卤水体系[13])、碳化法(适用于碳酸盐型盐湖卤水[14])等,这些技术已经应用于青海盐湖提锂工业生产中,对中国盐湖提锂工业的快速发展奠定了良好基础。然而,西台吉乃尔盐湖高锂卤水煅烧法生产碳酸锂工艺中,在原料卤水(老卤)浓缩和锂的富集过程中,尤其是卤水净化[15-16](如除硫、除硼)过程中,锂会随同其他盐类析出,造成锂的大量夹带损失,从而导致了严重的锂资源浪费,综合利用效率也较低[17]。因此,研究脱硫过程中锂的迁移规律,对提高锂的收率以及开发高效、环保、低成本的提锂集成技术和高效锂富集技术,具有十分重要的现实意义和战略意义。
1 实验部分
1.1 原料、试剂及仪器
原料:西台吉乃尔盐湖高锂卤水,即盐湖卤水提钾后的老卤(锂质量浓度约为2 g/L)继续盐田蒸发浓缩后的卤水(锂质量浓度约为4 g/L),其主要成分及离子含量见表1。
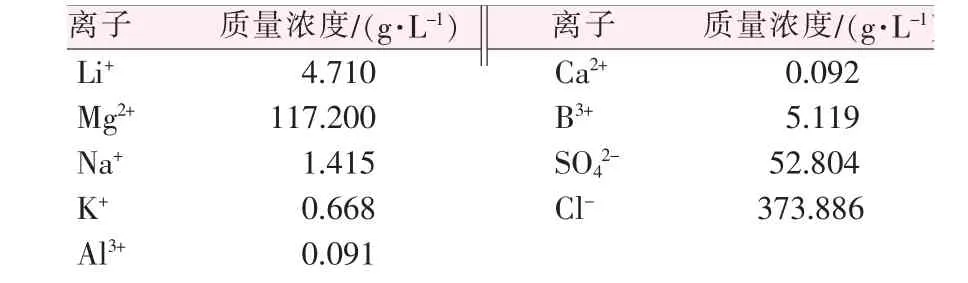
表1 盐湖高锂卤水的组成Table 1 Composition of brine with high lithium in salt lake
试剂:无水氯化钙、无水硫酸钠、无水乙醇,均为分析纯。
仪器:HH-2恒温水浴锅,JJ-3型搅拌器,DHLA电脑数显恒流泵,DGG-9053AD电热恒温鼓风干燥箱,SHB-Ⅲ循环水式多用真空泵。
1.2 实验方法
取200 mL盐湖高锂卤水置于三口烧瓶中,然后置于恒温水浴中,在均匀搅拌下以恒定的速度加入一定浓度的氯化钙溶液,控制反应条件进行化学反应。反应结束后,将硫酸钙悬浮液真空抽滤,反复用去离子水洗涤,最后用无水乙醇洗涤3次,在45℃真空干燥12 h,研磨得到硫酸钙样品。固体称重后用X射线衍射仪分析晶体结构,用扫描电镜观察晶体形貌;母液中的SO42-含量用0.05 mol/L的BaCl2溶液滴定法(容量法2)测定,用原子吸收分光光度计测定滤液中的Li+浓度,计算除硫率、锂的夹带损失率。
SO42-脱除率和Li+损失率测定方法:吸取质量浓度为10 mg/mL的SO42-标准溶液10.00 mL,加水40 mL,加无水乙醇20 mL,加茜素红指示剂0.20 mL(4滴),用质量分数为10%的HNO3溶液调至黄色(pH=3~4),用BaCl2标准溶液滴定至粉色,记录消耗BaCl2标准溶液的体积V1,加入2.00 mL抽滤得到的滤液,溶液呈现紫红色,用10%HNO3溶液调至黄色,用BaCl2标准溶液滴定至粉色,记录消耗BaCl2标准溶液的体积V2。
1)SO42-脱除率计算:R(SO42-)=[(ρ0V0-ρ1V1)/ρ0V0]×100%。式中:R(SO42-)为SO42-脱除率,%;ρ0为卤水SO42-质量浓度,52.804 g/L;V0为卤水体积,0.2 L;ρ1为滤液SO42-质量浓度,g/L;V1为滤液体积,L。
2)Li+损失率计算:R(Li+)=[(ρ0V0-ρ1V1)/ρ0V0]×100%。式中:R(Li+)为Li+损失率,%;ρ0为卤水Li+质量浓度,4.71 g/L;V0为卤水体积,0.2 L;ρ1为滤液Li+质量浓度,g/L;V1为滤液体积,L。
1.3 分析、表征方法
用AA-6300C原子吸收分光光度计测定Li+质量浓度;用ICAP6300电感耦合等离子体光谱仪测定原料卤水中各阳离子质量浓度;用ICS1100型阴离子色谱仪测定各阴离子质量浓度;用D/max 2500 pc X射线衍射仪(XRD)测定晶体结构;用JSM-6610扫描电子显微镜(SEM)观察固相的形貌。
2 结果与讨论
2.1 原料配比对SO42-脱除率和Li+损失率的影响
为尽可能降低卤水中的SO42-含量,在卤水净化过程中加入的除硫剂往往是过量的。实验中以CaCl2为沉淀剂,研究了不同原料配比(或钙硫比)[n(Ca2+)/n(SO42-)=1.0~1.5]对SO42-脱除率和Li+损失率的影响,实验结果见图1a。控制反应条件:连续稳定并流加料,加料时间为30 min,反应时间为30 min,搅拌转速为150 r/min,反应温度为25℃。由图1a看出,随着原料配比增加,硫酸根脱除率先增大后趋于稳定,而锂的夹带损失率则呈现先增大后减小并趋于稳定的趋势。从同离子效应观点来看[18],钙、硫物质的量比增加有利于硫酸根以沉淀(CaSO4·2H2O)的形式析出;同时,随着沉淀剂加入量增大,溶液中Ca2+浓度增加,Ca2+与SO42-的碰撞机会增多,反应速度加快,有利于化学反应向产物的方向移动,因而脱硫率增加;当原料配比增加到一定程度时,化学反应趋于完全,故脱硫率趋于稳定。在n(Ca2+)/n(SO42-)为1.2时,卤水中SO42-的脱除率达到87.92%,此时锂的夹带损失率也相对较小,约为0.82%。当原料配比超过1.2时,硫酸根脱除率开始下降,同时锂的夹带损失率也略微增大。因此,原料配比采用1.2比较适宜。
原料配比为1.2时生成沉淀产物CaSO4的SEM照片见图1b。由图1b看出,硫酸钙晶体分散性较好,尺寸分布均匀[19],但是整体上呈现针状形貌,导致过滤性能较差。后期可以通过改变反应条件或者通过反应体系中增加添加物来改变CaSO4的形貌[20],从而改善过滤性能。
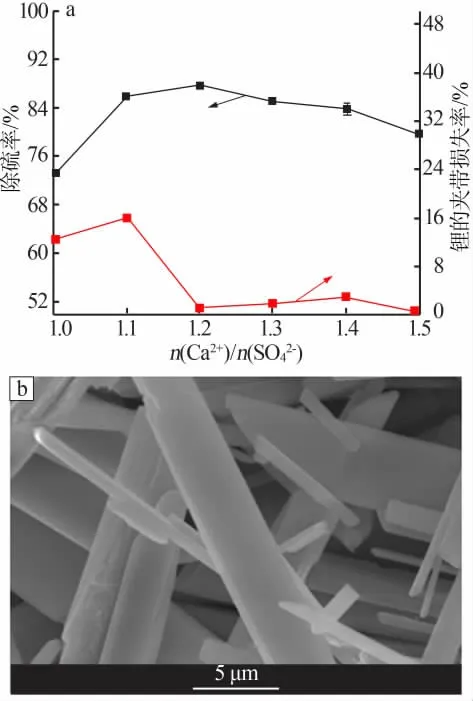
图1 原料配比对SO42-脱除率及Li+损失率的影响(a);原料配比为1.2时生成沉淀产物CaSO4的SEM照片(b)Fig.1 Effect of raw material ratio on separation of sulfate and lithium loss rate(a);SEM image of CaSO4 product at the ratio of raw material is 1.2(b)
2.2 加料方式对SO42-脱除率和Li+损失率的影响
加料方式往往会决定反应体系中各离子之间的接触是否完全,从而决定反应是否迅速、彻底[15]。加料方式包括正加料(氯化钙溶液加入卤水中)、反加料(卤水加入氯化钙溶液中)、并流加料(氯化钙溶液与卤水同时加入反应器中)。实验考察了加料方式对SO42-脱除率和Li+损失率的影响,实验结果见表2。控制反应条件:n(Ca2+)/n(SO42-)为1.2,加料时间为30 min,反应时间为30 min,搅拌转速为150 r/min,反应温度为25℃。无论采用何种加料方式,当溶液中的离子积大于硫酸钙的溶度积时,均可很快生成CaSO4沉淀。从表2看出,不同的加料方式对SO42-脱除率和Li+夹带损失率的影响不明显。为与实际生产工艺一致,后续实验采用正加料方式,即氯化钙溶液加入卤水中。

表2 加料方式对SO42-脱除率及Li+损失率的影响Table 2 Effect of feeding method on separation of sulfate and lithium loss rate
2.3 加料时间对SO42-脱除率和Li+损失率的影响
加料时间即加料速度会影响反应速率,进而影响产物的过饱和度、晶体形貌及粒度。实验选取5个不同加料时间(12、18、24、30、36 min),考察了加料时间对SO42-脱除率和Li+损失率的影响,实验结果见图2。控制反应条件:原料配比为1.2,连续稳定正加料,反应时间为30 min,搅拌转速为150 r/min,反应温度为25℃。加料反应过程中,溶液的过饱和度是决定和控制晶核生成数量的主要因素,也影响着晶体的生长速率和晶体粒径[21];由图2看出,随着加料时间延长,即加料速度的减小,硫酸根脱除率先增大后基本保持不变,同时锂的损失率小幅减小。随着加料时间增加,反应体系中Ca2+浓度较低,因此锂的夹带损失率则不断减小。当加料时间为24 min时,SO42-脱除率为88.18%,锂的夹带损失率为25.02%。综合考虑,选取加料时间为24 min。

图2 加料时间对SO42-脱除率和Li+损失率的影响Fig.2 Effect of feeding time on the separation of sulfate and lithium loss rate
2.4 反应时间对SO42-脱除率和Li+损失率的影响
反应时间影响目标产物的收率及生产效率。实验中控制反应时间分别为10、20、30、40、50、60 min,考察了反应时间对SO42-脱除率和Li+损失率的影响,实验结果见图3。控制反应条件:原料配比为1.2,连续稳定并流加料,加料时间为24 min,搅拌转速为150 r/min,反应温为25℃。由图3分析得出,随着反应时间增加,硫酸根脱除率呈现略微增大然后保持稳定的趋势,脱除率维持在98.5%左右,说明Ca2+与SO42-的反应在20 min内基本完成。同时锂的夹带损失率在50 min之前变化不明显,超过50 min后出现下降趋势。从图3可知,当反应时间达到60 min时,在硫酸根的脱除过程中锂的夹带损失率也相对较小(为16.83%)。因此,反应时间确定为60 min。

图3 反应时间对SO42-脱除率和Li+损失率的影响Fig.3 Effect of reaction time on the separation of sulfate and the loss rate of lithium
2.5 搅拌转速对SO42-脱除率和Li+损失率的影响
搅拌的目的是让反应体系中的反应物分散更加均匀,各离子间接触更加充分,从而使得反应更加完 全。控 制 搅 拌 转 速 分 别 为100、150、200、250、300 r/min,考察了搅拌转速对SO42-脱除率和Li+损失率的影响,实验结果见图4a。控制反应条件:原料配比为1.2,连续稳定并流加料,加料时间为24 min,反应时间为30 min,反应温度为25℃。由图4a看出,随着搅拌转速增大,硫酸根脱除率稳定于98.6%~99.0%,同时对锂的夹带损失率影响不大(21%~25%)。另外,实验中还发现无搅拌或者慢搅拌都会促进反应体系中不同颗粒的团聚,导致过滤困难[22],而过高的搅拌速度又不利于晶体生长,容易生成过多的晶核,导致颗粒粒径变小,也不利于过滤。从图4a看出:当搅拌转速为150 r/min时,锂的夹带损失率最小(为20.76%)。综合考虑,确定搅拌转速为150 r/min。
图4b为制得CaSO4晶体SEM照片。由图4b看出CaSO4晶体形貌为棒状。原因在于,随着反应条件不断优化CaSO4的存在形式逐渐变少,同时发现固体形貌不再是针状形貌[23],这样有利于提高过滤性能。不同形貌硫酸钙的用途不一样,且不同的金属阳离子对硫酸钙的形貌也有不同的影响[24]。吕鹏飞等[25]、李帅等[26]曾针对Fe3+、Mg2+对硫酸钙晶体的形貌影响进行了研究,发现这两种离子对半水硫酸钙晶须的形貌都有一定的调控作用[27]。

图4 搅拌速度对SO42-脱除率和Li+损失率的影响(a);制备得到CaSO4的SEM照片(b)Fig.4 Effect of stirring speed on the separation of sulfate and lithium loss rate(a);SEM image of product CaSO4(b)
2.6 反应温度对SO42-脱除率和Li+损失率的影响
一般而言,反应温度[16,28]对反应速率、过滤性能产生影响。从动力学角度出发,反应体系温度越高反应速率越快。实验控制反应温度分别为25、30、35、40、45、50℃,考察了反应温度对SO42-脱除率和Li+损失率的影响,实验结果见图5a。控制反应条件:原料配比为1.2,正向加料,加料时间为24 min,反应时间为60 min,搅拌转速为150 r/min。由图5a分析可以得出,反应温度对硫的脱除率和锂的损失率影响不明显。在实验操作条件下,锂的夹带损失率维持在27.71%~29.0%,SO42-脱除率保持在98.89%~99.2%。考虑到实际生产中的能耗[29],选择反应温度为25℃。
图5b为沉淀产物CaSO4的SEM照片。由图5b看出,随着反应条件不断优化CaSO4的形貌单一,基本上呈棒状或者颗粒状。

图5 反应温度对SO42-脱除率和Li+损失率的影响(a);沉淀产物CaSO4的SEM照片(b)Fig.5 Effect of reaction temperature on the separation of sulfate and lithium loss rate(a);SEM image of product CaSO4(b)
2.7 产物表征与分析
盐湖高锂卤水与氯化钙溶液在不同反应条件下反应结束后过滤,用无水乙醇反复对固体样品进行洗涤,经电热恒温鼓风干燥箱在80℃烘干,取出样品,在室温条件下将样品置于研钵中但不超过研钵体积的1/3进行研磨,采用X射线衍射仪对其进行表征,结果见图6。由图6分析可以得出,在脱除硫酸根的过程中,形成的固体产物主要有CaSO4·2H2O、CaSO4·0.5H2O。生成的不同形式的硫酸钙晶体可应用于复合材料的增强组元[30],制造一些摩擦材料[31],用于环境工程[32-34]、沥青的改性;制造一些难燃纸张从而用于室内装饰;也可以应用于医药、癌症治疗[35]、涂料、油漆、隔热材料等方面。锂主要是以Li2SO4·H2O和LiAl2(OH)7(H2O)2的形式存在,说明在脱除SO42-的同时也损失了一部分Li+,且是以含水化合物而迁移。

图6 沉淀产物XRD谱图Fig.6 XRD patterns of the product
3 结论
以西台吉乃尔盐湖高锂卤水为原料,以氯化钙为沉淀剂,考察了不同操作条件下硫酸根的脱除率、锂的夹带损失率和锂形成复盐的形式。结果表明:在原料配比为1.2、正向加料、反应时间为60 min、搅拌转速为150 r/min、反应温度为25℃条件下,盐湖高锂卤水中SO42-的脱除率为99.02%,锂的夹带损失率为27.71%。在脱除硫酸根的过程中,硫酸钙主要以CaSO4·2H2O、CaSO4·0.5H2O的形式存在,根据实验条件不同其形貌主要有针状、棒状和颗粒状;卤水中的Li+主要以LiAl2(OH)7(H2O)2和Li2SO4·H2O复盐的形式迁移到固相产物中。

