外周血中性粒细胞与淋巴细胞比值以及血小板与淋巴细胞比值评估声门型喉癌患者预后的价值
王川,刘盼,神平,李红权,张伟强,仝悦,刘稳
(徐州医科大学附属医院 耳鼻咽喉头颈外科,江苏 徐州 221000)
喉癌是头颈部最常见的癌症之一,占全身恶性肿瘤的1%~5%, 其中96%~98%为鳞状细胞癌[1]。每年大约有65万新病例和35万癌症死亡是由这种疾病引起的[2]。在2015年[3]中国新增病例26300例,死亡14500例。在各种类型喉癌中,声门型喉癌最常见,发病率远高于声门上型、声门下型及跨声门型喉癌。近年来,研究表明相关炎症指标可能与肿瘤的局部形成、生长、复发和预后有关,其中,外周血中性粒细胞(neutrophils-to-lymphocytes ratio,NLR)以及血小板与淋巴细胞比值(platelet-to-lymphocytes ratio,PLR)可以综合反映肿瘤患者体内炎症和免疫状态,已然成为肺癌、结直肠癌、肝癌、乳腺癌、肾癌等多种肿瘤的独立预后因素之一。但是NLR和PLR对于喉癌患者预后的相关分析研究较少,本研究对我院声门型喉癌患者的术前相关血液学指标以及临床病理因素进行回顾性分析,并结合患者的随访资料,来研究NLR和PLR与声门型喉癌患者预后的关系。
1 资料与方法
1.1 临床资料
选取2012年1月1日—2015年1月1日就诊于徐州医科大学附属医院的声门型喉癌患者115例,因收集的女性患者为个位数,为了排除干扰因素,所以纳入时排除了女性患者。病理诊断均明确为鳞状细胞癌,且入院前未经治疗。所有患者既往无肿瘤病史,无放化疗病史,无自身免疫疾病史,均未曾输过血、在过去的2个月里无活动性出血、无弥漫性血管内凝血、无肝素治疗史、无甲状腺功能亢进或减退、无严重感染史。最终失访8例,纳入分析的107例患者均为男性,年龄(53.29±15.31)岁。
1.2 信息采集
通过医院病例系统收集患者资料,包括年龄、T分期、有无淋巴结转移、组织学分化程度。收集患者入院血常规指标,包括中性粒细胞计数、血小板计数、淋巴细胞计数,计算PLR和NLR。
1.3 随访情况
以首次治疗作为观察点,对治疗后出院的患者采用门诊复诊、电话等方式每3个月至半年随访1次,末次随访时期为2020年1月1日。生存时间为入院日期至死亡日期或至随访结束。
1.4 统计学方法
采用SPSS 19.0软件进行统计分析。绘制NLR、PLR的ROC曲线,确定最佳临界值。进行分析NLR和PLR与患者临床病理因素(年龄、分化程度、T分期及有无转移等)的关系,采用χ2检验或Fisher精确概率法。采用Kaplan-Meier法或者计算生存率,Log rank检验比较不同组间的差异,采用多因素Cox模型分析预后的独立影响因素。检验水准为α=0.05。
2结果
2.1 PLR和NLR最佳临界值的确定
对随访的患者绘制受试者工作特征(receiver operating characteristic,ROC)曲线进行分析:对于PLR,曲线下面积值为0.817,具有准确性(图1a)。尤登指数=敏感性+特异性-1,该指数的最大值即为最佳临界值,本试验最佳临界值为139.79,将患者分为高PLR组(PLR≥139.79)与低PLR组(PLR<139.79);对于NLR,曲线下面积值为0.735,具有准确性(图1b),最佳临界值为2.83,将患者分为高NLR组(NLR≥2.83)与低NLR组(NLR<2.83)。结果显示高PLR组32例(30.0%);高NLR组30例(28.0%)。

图1 ROC曲线图 1a:PLR组; 1b:NLR组 图2 生存曲线图 2a:低PLR组与高PLR组; 2b:低NLR组与高NLR组
2.2 不同PLR和NLR组临床病理因素的比较
对于不同PLR组和NLR组患者的年龄、分化程度、有无淋巴结转移、T分期进行比较,结果显示:高PLR组和低PLR组患者的病理分化程度、有无淋巴结转移、T分期的差异具有统计学意义(P均<0.05,表1);高NLR组和低NLR组患者的病理分化程度、有无淋巴结转移、T分期的差异具有统计学意义(P均<0.05,表1)。
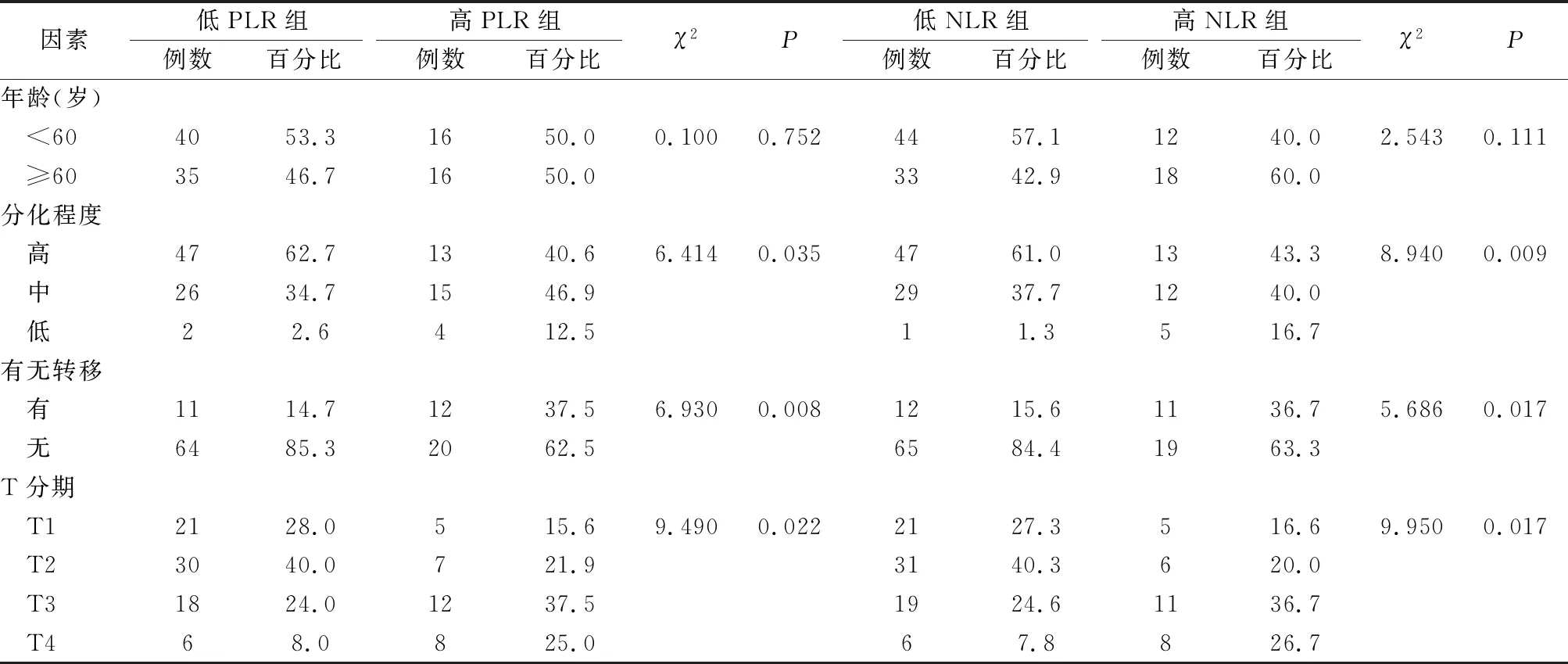
表1 不同NLR和PLR分组声门型喉癌患者临床病理因素比较 (例,%)
2.3 声门型喉癌患者术后5年生存率的单因素分析
本研究115例患者中,完成随访107例,失访8例,随访率为93.0%。采用Kaplan-Meier生存分析比较不同组间的生存率,以患者死亡或者随访结束作为终点事件,进行单因素分析得出有无淋巴结转移、T分期、PLR水平以及NLR水平与喉癌术后5年生存率有关。具体结果见表2、图2。
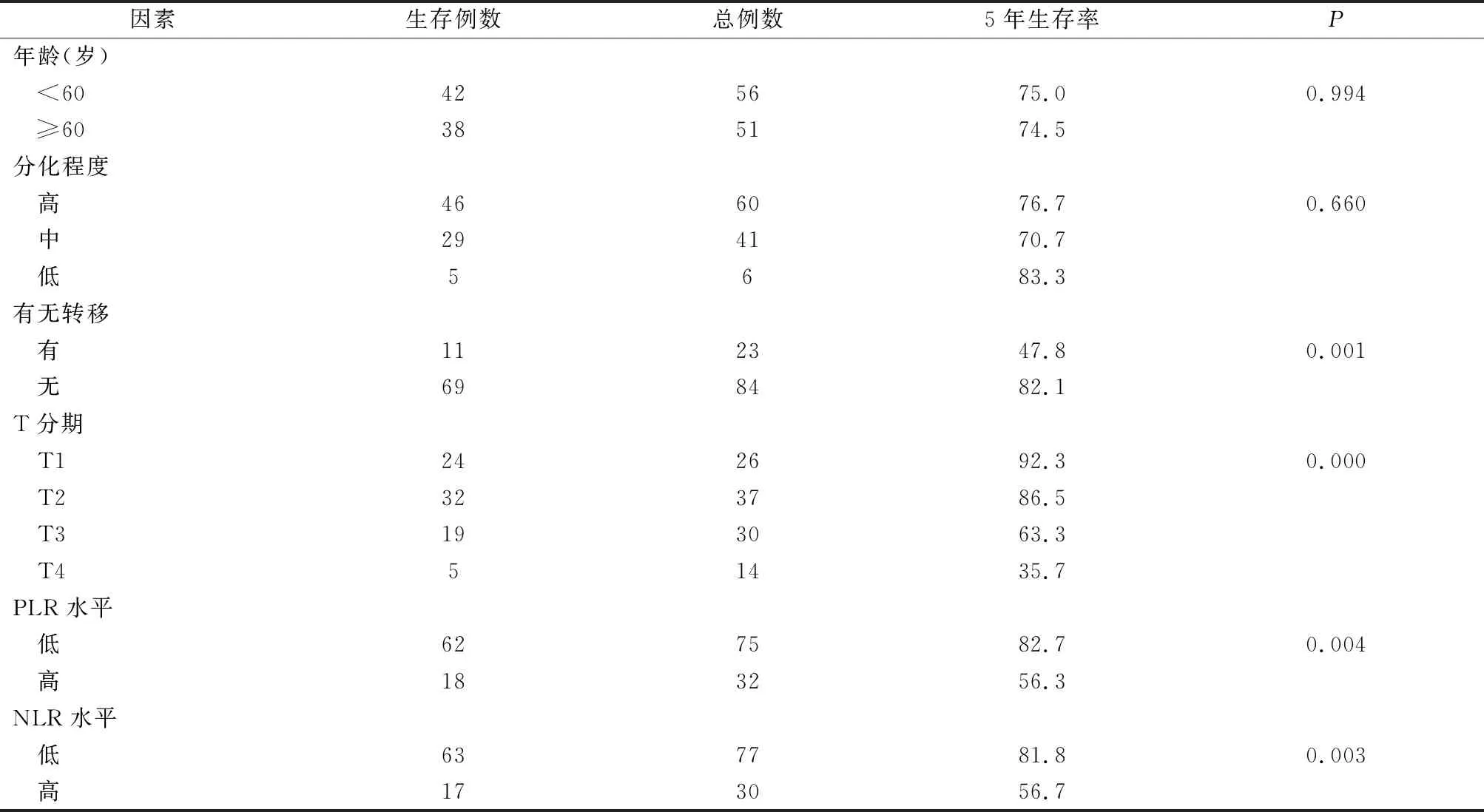
表2 声门型喉癌患者临床病理因素与预后的关系 (例,%)
2.4 声门型喉癌患者术后5年生存率的多因素分析
对影响喉鳞状细胞癌患者预后的变量进行Cox多因素回归分析,结果显示,T分期、PLR水平以及NLR水平为影响喉鳞状细胞癌患者预后的独立因素(P均<0.05),见表3。
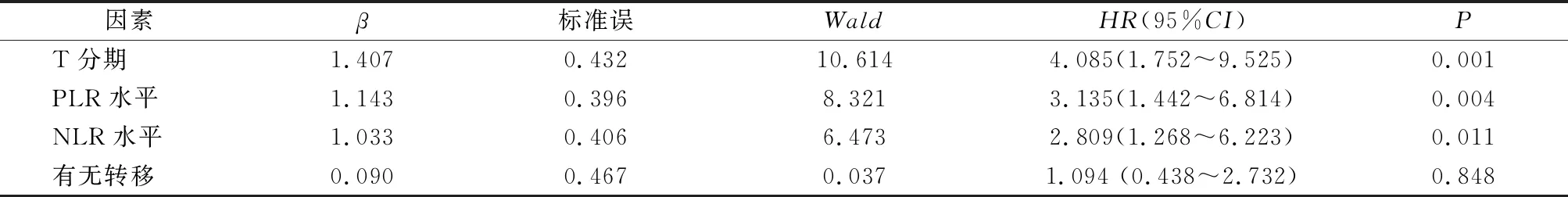
表3 影响声门型喉癌患者预后的Cox多因素回归分析
3 讨论
慢性炎症反应是许多癌症的病因,如乙型及丙型肝炎和肝癌、幽门螺杆菌和胃癌、炎症性肠病和结直肠癌、HPV和子宫颈癌以及许多其他的癌症[4-7]。有相关证据表明[8],肿瘤相关的全身炎症反应在肿瘤的生长和转移中也起着至关重要的作用。尽管炎症和肿瘤之间的关系已经被许多研究证实,但是其机制尚未完全阐述。炎症性微环境通过多种机制诱导毒性应激,这些毒性应激反应可导致细胞核和线粒体DNA死亡损伤,尤其是后者会引起NLRP3炎性体的激活,从而诱导促肿瘤的IL-1b和IL-18等表达[9]。另外肿瘤微环境中各种炎性细胞因子已成为癌症治疗的靶点,针对这些靶点通过抗体介导的中和作用,进行化学治疗具有更少的毒性[6]。
NLR和PLR是炎症指标的简单且有效的测量指标,它反映了患者的炎症和免疫状态。李坚等[10]认为NLR升高与肿瘤瘤荷有关,当瘤荷超过一定程度,肿瘤细胞迅速生长导致抗原提呈细胞无法识别提呈肿瘤抗原,导致肿瘤细胞呈对数生长,得出NLR升高是肝癌复发及预后的独立危险因素之一。Pavan等[11]得出非小细胞肺癌患者治疗前NLR和PLR升高与较低的生存率相关,并独立于其他预后因素。Dell’ Aquila等[12]发现高NLR的结直肠癌患者的预后更差。Sharma等[13]认为血小板可以介导各种肿瘤细胞生长、传播和血管生成和肿瘤细胞的接触及血小板和肿瘤细胞的接触协同激活肿瘤细胞中的TGF-β和NF-κB途径,导致肿瘤细胞转移能力增强,并且淋巴细胞的减少,形成了适合癌细胞增殖及转移的环境。NLR和PLR升高常伴有血中白细胞介素17水平上升及肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)增加[14],而TAM与肿瘤血管生成和浸润生长有关。
慢性肥厚性喉炎、人乳头状瘤病毒、喉咽反流等炎症因素与喉癌发生发展的关系已经逐渐得到证实,但是炎症因素与喉癌的预后研究较少,赵国峰等[15]研究了NLR与喉鳞状细胞癌预后关系,并计算出NLR的最佳临界值为2.85。在本研究中我们总结了107例声门型喉癌患者的临床和随访资料,除已经公认的喉癌预后相关因素外,如分化程度、有无淋巴结转移、T分期等,还发现NLR和PLR也是影响喉癌患者预后的因素。本研究使用ROC曲线分析确定了NLR及PLR的最佳临界值,分别为2.83和139.79,我们发现:术前低PLR喉癌患者的5年生存率为82.7%,术前高PLR喉癌患者的5年生存率为56.3%;术前低NLR喉癌患者的5年生存率为81.8%,术前高NLR喉癌患者的5年生存率为56.7%,说明NLR与PLR与声门型喉癌的预后有关。多重Cox比例风险回归分析显示,NLR≥2.83以及PLR≥139.79是预测声门型喉癌患者预后的独立因素。本研究表明,术前NLR以及PLR可以作为预测声门型喉癌患者的预后指标之一,并且这些炎症指标简单易得,结合TNM分期以及术后病理结果,更有助于临床医生制定更加合适的诊疗决策。但是目前关于PLR、NLR与喉鳞状细胞癌预后的研究较少,对于PLR、NLR最佳临界值的确定还不一致,如能进行多中心大样本研究则更有意义。

