不同浓度七氟醚预处理对tGCI大鼠模型海马组织神经细胞的影响
汪 静 李文谦 曾庆繁
1)贵州医科大学附属医院,贵州 贵阳 550001 2)贵州医科大学附属白云医院,贵州 贵阳 550001
短暂性全脑缺血(transient global cerebral ischemia,tGCI)是一种起病突兀的神经内科疾病[1],好发于中老年男性人群,且多在患者运动过量、突然起立、转颈等时候发病。发病时长为5~20 min,可反复发展,通常24 h后可自我恢复,且无明显后遗症[2]。临床尚未就tGCI 病机达成统一结论,但分析可能与以下几点有关:(1)脑动脉粥样硬化:脑动脉粥样硬化通过引发脑动脉狭窄影响脑部供血,如硬化斑块破裂,这些破裂物质将可能栓塞血管,导致小动脉梗阻,最终引发tGCI;(2)微栓塞:斑块破裂的微小凝块并无法直接栓塞血管,但这些凝块将与血小板等物质结合并生成微栓子,当微栓子进入微小动脉后,将引发局部缺血现象,即tGCI;(3)心脏疾病:心房纤维颤动、左心肥厚以及心功能不全等均可能通过影响血流动力指标或介导栓子脱落参与tGCI;(4)血流动力学变化:快速起立或快速扭头转颈均可能导致脑血流变化,并引发tGCI,如患者已存在动脉粥样硬化、颈动脉窦过敏,其tGCI发病率还将进一步提高[3];(5)血液成分变化:贫血、白细胞、血小板增多症等影响人体血液成分,导致血氧、血脂、血蛋白异常变化,影响人体血液黏度,导致血液出现病理状态,最终参与tGCI 的发生、发展。患者临床症状与其缺血的动脉系统有关,颈内动脉缺血患者症状以偏瘫、失语、单向眼视力障碍为主;椎基底动脉缺血患者症状则以眩晕、站立不稳、一过性视力缺失、轻度偏瘫等为主[4]。尽早恢复tGCI患者血供是本病的主要急救办法,但也带来新的问题,即脑缺血再灌注损伤[5]。既往研究显示,预处理可有效提升tGCI 患者缺血耐受性,并保护患者神经[6-7]。七氟醚是一种具有缺陷耐受诱导功能的麻醉药物,研究显示[8],七氟醚预处理可对tGCI 造模大鼠脑神经形成保护效应,但其最佳作用浓度及可能的作用机制临床尚无结论。为分析tGCI 的最佳作用浓度,本文选取48 只SD 大鼠进行研究。
1 材料与方法
1.1实验动物及分组选取成年健康WKY 大鼠48只,雌雄各半,体质量240~250 g,购自于贵州医科大学动物中心,质量合格证号:SYXK(黔)2018-0001;将SD 大鼠适应性喂养1 周,自由摄食饮水,饲养室温度20~25 ℃,相对湿度65%~75%。将所有WKY 大鼠随机分为模型组、2%七氟醚预处理组、4%七氟醚预处理组和6%七氟醚预处理组,每组12只。
1.2实验方法
1.2.1 造模及处理方法:对大鼠进行水合氯醛麻醉后,于颈部设置1 cm 切口,显露颈侧总动脉,选用硅胶管包绕总动脉,并固定于硬塑圆筒上,缝合切口后,将大鼠固定在定位仪上,同时对其进行枕部行纵向1 cm切口,显露第一颈椎及横突板,电凝栓塞横突板翼小孔椎动脉后缝合切口。将大鼠送回笼中,正常喂养24 h 后进行预处理,预处理10 min 后夹闭颈总动脉,大鼠30~60 s内昏迷即表明造模成功,10 min后恢复大鼠颈总动脉供血[9]。
预处理前对大鼠进行随机分组,根据分组情况进行生理盐水,2%、4%及6%七氟醚预处理,操作具体如下:将大鼠置于麻醉箱内,将生理盐水或对应浓度的七氟醚与100%氧气进行混合,并让大鼠呼吸1 h。
1.2.2 HE染色:断头处死大鼠,取出海马组织,将其固定后选用0.1 mol/L磷酸盐缓冲液冲洗,并置于2%明胶内,取出后烘干并选用乙醇脱水,将样本置于0.06%高锰酸钾溶液内反应8 min,取出后冲洗,选用苏木素进行染色,伊红复染,乙醇脱水后封片,显微镜读取结果。
1.2.3 神经元活力测定:选用四唑盐比色法鉴定大鼠神经元存活情况,取2 g 海马组织,捣碎制备为悬液,滴至48孔板内,同时每孔滴入10 μL 5 mg/mL四唑盐磷酸缓冲液,培养箱孵化6 h后,丢弃上清液,每孔滴入80 μL DMSO溶液的深蓝色结晶,混匀后反应15 min,通过酶标仪检测OD值。
1.2.4 神经元凋亡率测定:将海马细胞悬液置于试管内,滴入0.125%胰蛋白酶进行消化,反应5 min,1 500 r/min、5 cm 半径离心,时间8 min,弃上清,滴入0.1 mol PBS,同前参数再次离心,将细胞浓度调整为1×106个/mL,滴入10 μL Annexin V-FITC,混匀后反应10 min,滴入5 μL PI,混匀后反应15 min,加入350 μL Annexin V Binding solution溶液,反应60 min后通过流式细胞仪读取结果。
1.2.5 Western blot 检测:选用0.125%胰蛋白酶对海马细胞悬液进行消化,反应5 min 后,1 500 r/min、5 cm 半径离心,时间8 min,滴入3 μL 细胞裂解液,于4 ℃温度下反应20 min,随后进行2 000 r/min、5 cm 半径离心,时间8 min,提取总蛋白,并通过BCA法分析总蛋白浓度。将总蛋白电泳并转膜,封闭2 h后选用Bax、LC3-Ⅱ、Bcl-2 一抗,静置过夜,次日取出后洗涤2 次,滴入IgG 抗体进行二抗,室温下静置反应60 min,洗涤2次,滴入化学发光试剂,震荡均匀反应60 s后,通过凝胶成像系统读取结果。
1.3 统计学处理采用SPSS 22.0软件处理数据,计量资料以均数±标准差(±s)表示,比较使用F 检验。检验水准取a=0.05。
2 结果
2.1 各组海马组织HE染色模型组海马神经元结构及排列紊乱,细胞水肿,成片神经元系统核皱缩,七氟醚预处理组海马结构异常情况较模型组改善,其中6%七氟醚预处理组海马结构较清晰,排列有序,神经细胞形态较正常。见图1。

图1 各组海马组织HE染色(×400,A:模型组;B:2%七氟醚预处理组;C:4%七氟醚预处理组;D:6%七氟醚预处理组)Figure 1 HE staining of hippocampus in each group(×400,A:model group;B:2% sevoflurane pretreatment group;C:4% sevoflurane pretreatment group;D:6% sevoflurane pretreatment group)
2.2 各组海马组织神经元活力OD值比较七氟醚预处理组海马组织神经元活力OD 值明显高于模型组(P<0.05),其中6%七氟醚预处理组海马神经元活力OD 值高于2%七氟醚预处理组和4%七氟醚预处理组(P<0.05),呈剂量依赖性。见表1。
表1 各组海马组织神经元活力OD值比较 (±s)Table 1 Comparison of OD values of hippocampal neurons in each group (±s)
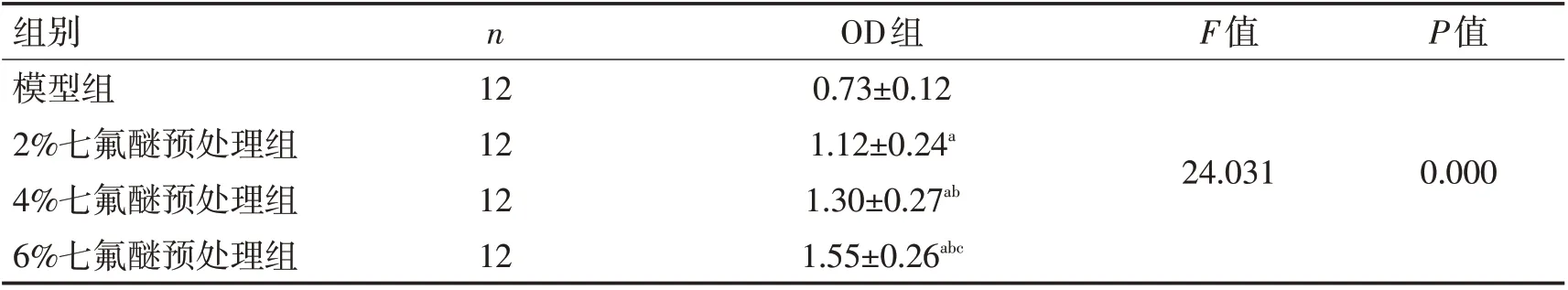
表1 各组海马组织神经元活力OD值比较 (±s)Table 1 Comparison of OD values of hippocampal neurons in each group (±s)
注:与模型组比较,aP<0.05;与2%七氟醚预处理组比较,bP<0.05;与2%七氟醚预处理组比较,cP<0.05
组别模型组2%七氟醚预处理组4%七氟醚预处理组6%七氟醚预处理组n F值P值12 12 12 12 OD组0.73±0.12 1.12±0.24a 1.30±0.27ab 1.55±0.26abc 24.031 0.000
2.3 各组海马组织神经细胞凋亡率比较七氟醚预处理组海马组织神经细胞凋亡率明显低于模型组(P<0.05),其中6%七氟醚预处理组海马神经细胞凋亡率低于2%七氟醚预处理组和4%七氟醚预处理组(P<0.05),呈剂量依赖性。见表2、图2。
表2 各组海马组织神经细胞凋亡率比较 (±s)Table 2 Comparison of apoptosis rate of hippocampal neurons in each group (±s)

表2 各组海马组织神经细胞凋亡率比较 (±s)Table 2 Comparison of apoptosis rate of hippocampal neurons in each group (±s)
注:与模型组比较,aP<0.05;与2%七氟醚预处理组比较,bP<0.05;与2%七氟醚预处理组比较,cP<0.05
组别模型组2%七氟醚预处理组4%七氟醚预处理组6%七氟醚预处理组n F值P值12 12 12 12细胞凋亡率(%)45.51±7.36 32.21±8.11a 23.05±6.88ab 12.24±3.11abc 65.546 0.000
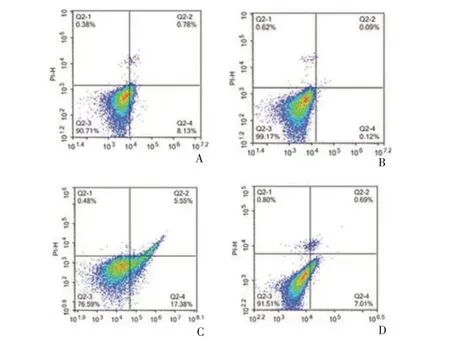
图2 各组海马海马组织神经细胞流式细胞检测图(A:模型组;B:2%七氟醚预处理组;C:4%七氟醚预处理组;D:6%七氟醚预处理组)Figure 2 Flow cytometry of hippocampal neurons in each group(A:model group;B:2% sevoflurane pretreatment group;C:4% sevoflurane pretreatment group;D:6% sevoflurane pretreatment group)
2.4 各组海马组织蛋白表达比较七氟醚预处理组海马组织Bax 蛋白相对表达量明显低于模型组(P<0.05),而Bcl-2、LC3-Ⅱ相对表达量明显高于模型组(P<0.05);其中6%七氟醚预处理组海马组织Bax蛋白相对表达量低于2%七氟醚预处理组和4%七氟醚预处理组(P<0.05),Bcl-2蛋白相对表达量高于2%七氟醚预处理组和4%七氟醚预处理组(P<0.05),呈剂量依赖性;6%七氟醚预处理组海马组织LC3-Ⅱ蛋白相对表达量与2%七氟醚预处理组和4%七氟醚预处理组比较差异无统计学意义(P>0.05)。见表3、图3。
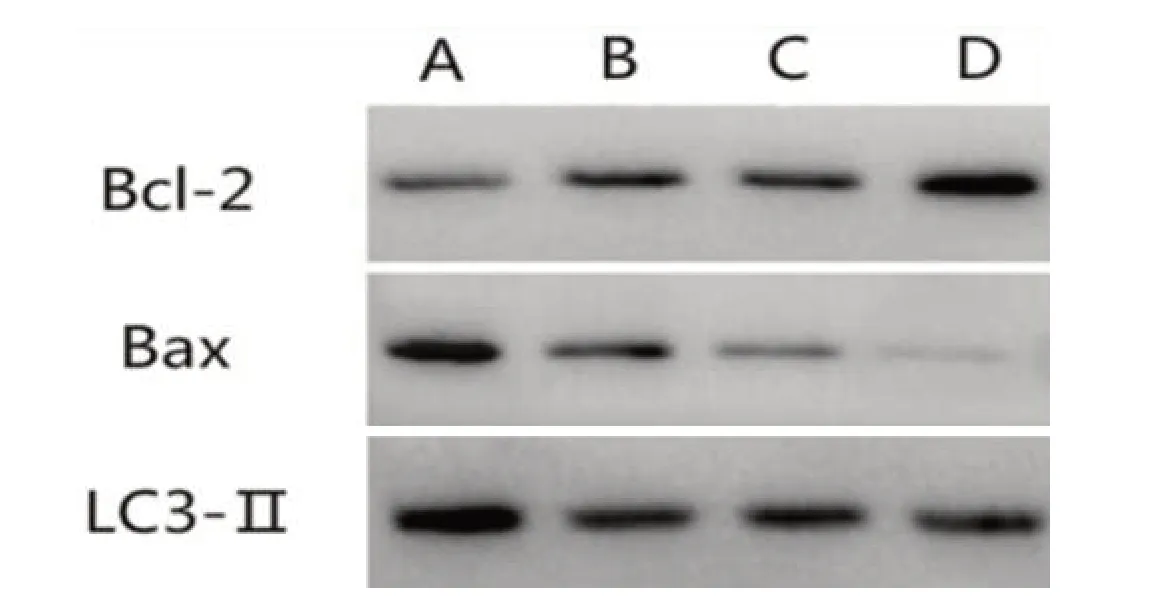
图3 Western blot检查图(A:模型组;B:2%七氟醚预处理组;C:4%七氟醚预处理组;D:6%七氟醚预处理组)Figure 3 Western blot(A:model group;B:2% sevoflurane pretreatment group;C:4% sevoflurane pretreatment group;D:6% sevoflurane pretreatment group)
表3 各组海马组织蛋白比较 (±s)Table 3 Comparison of protein in hippocampus of each group (±s)

表3 各组海马组织蛋白比较 (±s)Table 3 Comparison of protein in hippocampus of each group (±s)
注:与模型组比较,aP<0.05;与2%七氟醚预处理组比较,bP<0.05;与2%七氟醚预处理组比较,cP<0.05
组别模型组2%七氟醚预处理组4%七氟醚预处理组6%七氟醚预处理组F值P值Bcl-2相对表达量0.401±0.101 0.483±0.105a 0.514±0.100ab 0.980±0.112abc 16.654 0.000 n 12 12 12 12 Bax蛋白相对表达量0.902±0.114 0.564±0.103a 0.311±0.097ab 0.122±0.081abc 20.124 0.000 LC3-Ⅱ蛋白相对表达量0.675±0.103 0.911±0.101a 0.903±0.104a 0.901±0.108a 18.877 0.000
3 讨论
海马是多种生物的脑植物性神经功能及高级神经活动的载体,对缺血/缺氧具有较高灵敏度,是缺氧-复氧神经损伤研究工作的理想模型[10-11]。本研究中tGCI 造模后大鼠海马神经元结构及排列紊乱,细胞水肿,成片神经元系统核出现皱缩。七氟醚则是一种麻醉诱导及苏醒均快速平稳的吸入性麻醉药物,既往研究显示,预先七氟醚吸入可对大鼠脑缺血损伤形成保护效应[12]。本研究发现,给予大鼠七氟醚预处理后,其海马结构有所改善,且6%浓度七氟醚预处理组大鼠改善情况最佳,可以发现七氟醚预处理在降低大鼠海马神经元结构破坏上具有显著价值,其疗效与药物浓度有关。分析其可能作用机制:七氟醚可有效降低大鼠脑代谢水平,同时抑制氧自由基表达,形成抗氧化效应[13]。七氟醚还可阻滞N-甲基-D-天冬氨酸受体剂谷氨酸介导的神经元去极化,抑制钙质内流,进而阻滞其引发的神经元凋亡反应[14-15]。
本研究还发现,七氟醚预处理组海马组织神经元活力OD 值明显高于模型组,且6%七氟醚预处理组海马神经元活力OD值最高,同时七氟醚预处理组海马组织神经细胞凋亡率明显低于模型组,而6%七氟醚预处理组海马神经细胞凋亡率最低,表明6%七氟醚预处理可最大程度降低大鼠海马神经元凋亡率,维持其活性。研究发现,开放线粒体膜内的mitoKATP路径活化是吸入麻醉药剂预处理措施生成心、脑保护效应的重要机制[16]。七氟醚可通过活化mitoKATP 路径影响Bcl-2、Bax 蛋白表达,进而抑制大鼠海马神经元的凋亡[17-18]。Bcl-2是细胞凋亡调控介质的一种,具有抗凋亡效应,Bax 则具有促凋亡效应,Bcl-2/Bax 比值直接决定了细胞的命运。当Bcl-2/Bax 比值下降,线粒体PT 路径将被活化,大量的CytC将被释放至细胞胞质内,最终促使细胞凋亡;Bcl-2/Bax比值上升时,细胞凋亡率将大幅降低[19-20]。本研究中七氟醚预处理组海马组织Bax 蛋白相对表达量明显低于模型组,而Bcl-2相对表达量明显高于模型组,表明七氟醚预处理可通过影响Bax、Bcl-2表达水平影响大鼠海马神经元凋亡情况。研究发现,缺氧-复氧造模大鼠七氟醚预处理后,其Bcl-2/Bax比值显著提高,大鼠脑神经元凋亡率也随之降低,大鼠出现缺血性脑损伤耐受[21],与本研究结果相似。
自噬特指细胞对自身成分的消化过程,在细胞营养匮乏、血氧供给不足或出现应激状态时,其自噬率将大幅增高[22]。LC3-Ⅱ是细胞自噬的关键蛋白之一,其主要表达于自噬体膜上,因此LC3-Ⅱ蛋白的高表达往往意味着细胞自噬量大幅增高[23]。本研究发现,七氟醚预处理组海马组织LC3-Ⅱ蛋白相对表达量明显低于模型组,表明七氟醚预处理可通过调控LC3-Ⅱ表达水平来干预大鼠海马神经细胞自噬,进而阻止其凋亡。研究表明,七氟醚预处理后大鼠海马神经元凋亡率显著改善,同时其LC3-Ⅱ/LC3-Ⅰ水平上升[24-30]。该学者认为,七氟醚预处理后可预先启动海马神经元自噬,进而降低缺氧后的自噬率,增强海马神经元对缺氧的耐受,最终降低其凋亡率。
七氟醚预处理对tGCI大鼠模型后海马组织神经细胞有保护作用,呈剂量依赖性,6%浓度或可能是其最佳药效浓度,而七氟醚预处理的大鼠海马神经元保护机制可能与调控Bax、LC3-Ⅱ和Bcl-2 表达有关。

