单侧前庭功能丧失大鼠患侧前庭内侧核及小脑绒球中GLU-IR、GFAP、GABA B2的表达△
冷辉 张琦 马贤德 姜宇晴 石磊 王爱平
前庭及平衡相关系统与中枢联系通路中的任何环节受到影响均可出现平衡障碍,常见原因有外伤、感染、前庭老化、应用耳毒性药物等[1],此时患者的主观感受为眩晕。美国国立卫生研究院(National Institutes of Health,NIH)针对60岁以上人群的调查显示,患有前庭功能障碍的比例高达64.8%[2],这无疑增加了社会和家庭的精神和经济负担。药物、手术是治疗眩晕的主要手段,但其均有弊端,如:药物毒副作用、手术创伤、费用等,而且有部分患者通过药物或手术无法达到治疗眩晕的目的,因此,近年提出的促进前庭代偿治疗模式逐渐成为第三大治疗手段,故有必要对前庭代偿机制做进一步研究。随着实验室技术的发展,学者们逐步认识到前庭中枢代偿可能与前庭功能障碍恢复密切相关[3]。
谷氨酸免疫反应物(GLU-IR)是中枢神经系统含量比较丰富的兴奋性神经递质,介导兴奋性神经传导[4]。中枢神经系统中存在大量使前庭神经元发挥正常功能的星形胶质细胞(GFAP),前庭神经退变时星形胶质细胞反应增强[5],主要表现为胶质细胞肥大及胶质细胞增生。星形胶质细胞对前庭神经元执行正常功能所起的作用主要包括:①填充于神经元之间起隔离和绝缘作用;②监测中枢神经细胞间隙;③参与调节水和离子的平衡,并参与神经元的正常代谢活动;④对多种损伤均出现反应以及屏障作用[6]。γ氨基丁酸B2受体(GABA B2)主要分布在自主神经或中枢神经突触末梢,可参与多种神经活动;前庭代偿涉及到中枢神经系统中多个递质的传导路径,其中GABA系统与前庭迷路急性损伤后的功能恢复密切相关[7]。故本研究拟通过制造单侧前庭功能丧失大鼠模型,观察其前庭内侧核及小脑绒球中GLU-IR、GFAP、GABA B2表达的变化,探讨前庭中枢代偿的可能机制,为今后防治前庭神经损伤及促进前庭功能代偿提供新思路。
1 材料与方法
1.1实验动物及分组 45只SPF级SD大鼠雌雄各半,体重200±20 g,购自辽宁长生生物技术有限公司[SCXK(辽)2010-0001]。动物于辽宁中医药大学实验动物中心(室温20±2 ℃,相对湿度45%)常规适应性饲养一周后,随机分为空白对照组(n=9)、生理盐水注射组(n=18)、模型组(n=18)。
1.2单侧前庭功能丧失大鼠造模 空白对照组不做处理。余两组大鼠随机确定实验耳侧别,生理盐水注射组于实验耳鼓室内一次性注射生理盐水0.1~0.2毫升/耳,模型组于实验耳鼓室内一次性注射50%氯仿0.1~0.2毫升/耳[8];注射后1 h,观察大鼠行为学特征及失衡行为评分和头偏斜测量,进行模型评价。造模后,各组大鼠均再常规饲养3日后进行实验。
失衡行为评分:一侧迷路破坏后模型组大鼠出现单侧前庭功能丧失的行为学表现特征为自发眼震、向前庭功能被破坏侧倾倒、头位向前庭功能破坏侧偏斜及绕圈运动的行为等。参考Petrosini报告的方法[9],对5个失衡症状:头偏斜,躯干卷曲,肢体外展,强迫环形运动,头震(或称眼震样头震)分别进行评分,每个失衡症状最严重为2分,症状消失为0分,总分0~10分。
头偏斜的测量方法(图1):连线1由骶骨中央至第一胸椎中央处,连线2由鼻尖至颅顶正中,测量两延长线间的夹角即为头偏斜的度数[10]。

图1 模型大鼠头偏斜度数测量示意图
1.3大鼠脑组织取材 造模成功后第3天,进行大脑组织样本采集,空白对照组随机抽取3只,余各组大鼠随机抽取6只,采用过量麻醉法处死,迅速将大鼠置于冰面上,断头取脑,完整取下全脑,浸泡于4%多聚甲醛溶液中,室温固定,用于免疫组织化学法检测各项指标。
空白对照组剩余6只、余各组剩余大鼠12只,同法完整取下全脑,将脑组织置于冰面上,分别分离出实验耳侧前庭内侧核、小脑绒球部组织,并用手术刀将术侧前庭内侧核部、小脑绒球部等分为2份(空白对照组大鼠取双侧前庭内侧核部、小脑绒球部),一份组织置于2 ml冻存管中,冻存于-80 ℃冰箱中,用于Western-blot法检测各项指标;另一份组织置于2 ml冻存管中,加入0.5 ml Trizol浸泡,冻存于-80 ℃冰箱中,用于RT-PCR法检测各项指标。
1.4免疫组化法分别检测各组大鼠前庭内侧核、小脑绒球中GLU-IR、GFAP、GABA B2的表达 取出固定好的组织充分冲洗后,将脑干旁内侧核部分及小脑绒球部分分别修饰成0.5 cm×0.5 cm×0.5 cm的正方形组织块,全自动脱水机脱水后,浸蜡、包埋,切片,片厚5 μm,烤片2 h。二甲苯及梯度乙醇脱蜡并水化,然后将切片浸泡于预热的柠檬酸盐缓冲液中,沸水浴20分钟,进行抗原修复。将玻片平摆于湿盒中,免疫组化笔圈涂组织薄膜,于圈中央滴加正常山羊血清封闭10 min,倾去封闭液,勿洗。加一抗(1∶300稀释),4 ℃孵育过夜。次日取出,室温复温1 h,PBS洗涤,5分钟/次,5次,于圈中央滴加即用型二抗工作液,37 ℃温箱中孵育60 min,PBS洗涤,5分钟/次,5次,甩干玻片上的残留液体,然后滴加DAB显色液,温室避光孵育1~10 min,随时观察染色情况。然后自来水轻轻冲洗,终止染色,滴加苏木素复染30 s~1 min,1%盐酸乙醇分化10~30 s,自来水冲洗。中性树胶封片,数码显微镜下观察并采集照片,每张切片随机选取5个视野,采用生物信号采集系统测定平均光密度值,以平均值作为该例样本目的蛋白相对表达水平。
1.5RT-PCR法检测各组大鼠前庭内侧核、小脑绒球中GLU-IR、GFAP、GABA B2的表达 取Trizol液浸泡的前庭内侧核组织,于液氮中研磨,将组织研磨成粉末,滴加Trizol液0.5 ml,提取组织中总RNA,测定浓度及质量后,采用一步法RT-PCR试剂盒检测GLU-IR、GFAP、GABA B2 mRNA的表达水平,引物序列详见表1。经ABI Prism 7500 HT序列检测系统检测出CT值,运用Livik(2-ΔΔCT)计算相对表达量[11],并进行统计分析。小脑绒球部位的实验处理同上。

表1 引物序列表
1.6Western-blot检测各组大鼠前庭内侧核、小脑绒球中GLU-IR、GFAP、GABA B2的表达 取冻存的新鲜前庭内侧核组织,室温融化后,称重,剪碎脑组织,置于2 ml EP管中,按照组织重量(mg)、裂解液(ml)比为100∶1的比例加入含PMSF的组织裂解液,EP管保持在冰面上完成操作。高速电动匀浆机制备组织匀浆,并在冰面上裂解15 min,12 000 g离心力、4 ℃ 离心15 min,分离上清液,即为总蛋白,采用BCA法进行蛋白定量,并调整蛋白浓度至5 mg/ml,加入6×蛋白上样缓冲液,沸水浴5分钟,进行蛋白变性。以每泳道50 μg的蛋白量进行垂直电泳,采用湿转法将凝胶中蛋白转印至PVDF膜上,转印结束后,将PVDF膜以5% BSA封闭液温室封闭1 h,然后将PVDF膜放在抗体孵育盒内,加入一抗(稀释度为1∶300)4 ℃孵育过夜,次日取出复温1 h,取出残余抗体,用TBST缓冲液洗膜6次,5分钟/次。末次洗膜后,用移液器吸干残余洗膜液,加入HRP标记的二抗(稀释度为1∶2 000),37 ℃恒温水浴振荡器孵育2 h,去除二抗,洗膜6次后,将PVDF膜甩干水分,放于凝胶成像分析系统中,膜上滴加ECL发光液,曝光并采集照片,测定目的蛋白条带和内参条带的灰度值,并以目的条带灰度值/内参条带灰度值的比值作为目的蛋白相对表达水平,进行统计分析。小脑绒球部位的实验处理同上。
1.7统计学方法 采用SPSS 22.0软件包对实验数据进行统计学分析,计量资料均先进行方差齐性检验,然后采用完全随机设计方差分析(One-way ANOVA法)进行单因素方差分析,组间两两比较采用LSD法,计量资料以均数±标准差表示。
2 结果
2.1模型评价 模型组大鼠鼓室内注射氯仿造成单侧前庭功能破坏后,均出现明确的前庭功能失衡症状,空白对照组及生理盐水注射组无相关症状出现。空白对照组失衡症状评分及头偏角度数与生理盐水注射组比较差异无统计学意义(P>0.05),模型组与空白对照组、生理盐水注射组比较,失衡症状评分及头偏角明显升高(P<0.01)(表2),说明模型组造模成功。
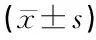
表2 各组造模后失衡症状评分及头偏角度数
2.2免疫组化法检测各组大鼠前庭内侧核、小脑绒球中GLU-IR、GFAP、GABA B2的表达 造模成功3天后,生理盐水注射组前庭内侧核、小脑绒球中GLU-IR、GFAP、GABA B2表达水平与空白对照组比较,差异无统计学意义(P>0.05);模型组与生理盐水注射组、空白对照组比较GLU-IR表达明显下调(P<0.05),GFAP、GABA B2的表达明显上调(P<0.05)。模型组前庭内侧核GLU-IR、GFAP、GABA B2含量与小脑绒球比较差异无统计学意义(P>0.05)(图2、表3)。

表3 各组大鼠前庭内侧核、小脑绒球中GLU-IR、GFAP、GABA B2的表达水平

图2 各组大鼠脑组织免疫组化染色(DAB显色×200)
2.3PCR法检测各组大鼠前庭内侧核、小脑绒球中GLU-IR、GFAP、GABA B2 mRNA表达 造模成功3天后,生理盐水注射组前庭内侧核、小脑绒球中GLU-IR、GFAP、GABA B2表达水平与空白对照组比较,差异无统计学意义(P>0.05),模型组与生理盐水注射组、空白对照组比较GLU-IR表达明显下调(P<0.05),GFAP、GABA B2的表达明显上调(P<0.05)。模型组前庭内侧核GLU-IR、GFAP、GABA B2表达量与小脑绒球比较差异无统计学意义(P>0.05)(表4)。

表4 PCR法检测各组大鼠前庭内侧核、小脑绒球中GLU-IR、GFAP、GABA B2的mRNA表达水平
2.4采用Western-blot检测各组大鼠GLU-IR、GFAP、GABA B2的表达 造模成功3天后,生理盐水注射组前庭内侧核、小脑绒球中GLU-IR、GFAP、GABA B2表达水平与空白对照组比较,差异无统计学意义(P>0.05);模型组与生理盐水注射组、空白对照组比较GLU-IR表达明显下调(P<0.05),GFAP、GABA B2的表达明显上调(P<0.05)。模型组前庭内侧核GLU-IR、GFAP、GABA B2含量与小脑绒球比较差异无统计学意义(P>0.05)(表5、图3)。

图3 Western-blot法检测各组大鼠前庭内侧核、小脑绒球GLU-IR、GFAP、GABA B2表达水平
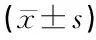
表5 Western-blot法检测各组大鼠前庭内侧核、小脑绒球中GLU-IR、GFAP、GABA B2的表达
3 讨论
单侧前庭功能丧失模型的实验动物可出现严重的姿势和视动障碍,随着时间推移,这些症状会逐渐好转至消失,这个过程即前庭代偿。既然单侧前庭被完全破坏,那么术侧外周前庭的神经输入即完全消失,这种代偿就被认为是中枢前庭系统功能重组的结果,所以此即中枢代偿的实验动物模型[12]。研究已证实前庭代偿的过程主要由前庭核、前庭核间连合纤维、小脑、网状结构、下橄榄核、舌下神经前置核等部位参与,其中以前庭内侧核最为重要。同侧前庭核的损伤能阻止单侧迷路破坏后的静态代偿,因此认为前庭核神经元的恢复对行为的恢复起到重要作用[13]。小脑皮层中特别是小脑绒球,对前庭适应亦起作用(Ito,1982),绒球对象性神经元与前庭内侧核(前庭内侧核中有15%到20%的神经元是对象性神经元),它们接受同侧小脑绒球的单突触抑制[14]。潘剑等[15]通过将荧光金注射入大鼠绒球进行神经元的逆行追踪,发现荧光金标记细胞出现在双侧前庭神经内侧核、脊髓前庭核、脑桥核和下橄榄核等核区,说明绒球与控制平衡的解剖结构联系颇为密切,小脑绒球是前庭眼动反射和平稳眼跟踪运动传导通路的中心部位,直接或间接地接收大脑视皮质、额叶眶区、颞上回、颞中回、内耳半规管的平衡觉感受器,小脑蚓小结、脑桥核、下橄榄核等的传入纤维联系[16]。因此,本研究以大鼠前庭神经内侧核及小脑绒球作为实验部位。
本研究结果表明,生理盐水注射组前庭内侧核、小脑绒球中GLU-IR、GFAP、GABA B2表达水平与空白对照组差异无统计学意义,说明注射生理盐水未对大鼠前庭功能造成影响。模型组与生理盐水注射组、空白对照组比较GLU-IR表达明显下调,考虑原因可能为GLU-IR介导兴奋性神经传导,当术侧前庭功能丧失后,术侧前庭神经失支配,因而兴奋性递质减少。模型组与生理盐水注射组、空白对照组比较GFAP表达明显上调(P<0.05),考虑原因为前庭功能受损时GFAP反应增强,表现为GFAP表达上调。模型组与生理盐水注射组、空白对照组比较GABA B2表达明显上调(P<0.05),考虑原因为GABA B2受体可促进急性期前庭代偿的恢复,对改善眩晕症状有积极作用,术侧前庭功能丧失,大鼠自身的前庭及中枢代偿机制使GABA B2表达上调。模型组前庭内侧核与小脑绒球比较GLU-IR、GFAP、GABA B2含量差异无统计学意义(P>0.05),说明前庭神经核及绒球均为中枢代偿的重要部位。
综上所述,单侧前庭功能丧失可导致前庭内侧核、小脑绒球中GLU-IR表达下调,GFAP、GABA B2表达上调,说明前庭内侧核、小脑绒球均参与前庭代偿,这可能为前庭代偿的机制。目前研究表明,修复、适应、习服是前庭受损后代偿的三种方式,临床上,单侧前庭功能障碍患者常常存在静态症状和动态症状,其中静态症状的缓解主要通过静态代偿,是脑部修复(生化、细胞水平)再平衡结果[17]。本研究在造模成功后第3天开展研究,目的是研究急性前庭损伤后的静态代偿期上述指标的变化,未来将深入研究大鼠单侧前庭功能丧失后不同时间上述指标的动态变化过程,深入探讨中枢代偿的机制,为今后防治前庭神经损伤及促进前庭功能代偿提供新思路。

