基于微生物群落特征解析的生物活性炭氨氧化机制
黄怡婷, 陈之歆, 魏忠庆, 郑 奋, 牛 佳, 刘鸿浩, 庄婉娥, 徐开钦
(1.福建工程学院生态环境与城市建设学院水科学与水质保障工程技术研究中心,福建 福州 350118; 2.福州市水务投资发展有限公司,福建 福州 350001;3.福建农林大学生命科学学院,福建 福州 350002;4.日本国立环境研究所资源循环与废弃物研究中心,日本 筑波 305-8506)
氨氮是地表水水源污染的主要指标之一,农业污染源的氨氮排放量占地表水体污染总负荷的22.4%[1].随着国家对保障农村饮用水安全的重视以及对城乡供水一体化的大力推进[2],如何提高农村饮用水水质,解决微污染水源中的氨氮问题,成为供水行业亟待解决的首要问题[3].
近年来,臭氧—生物活性炭(ozone-biological activated carbon, Ozone-BAC)技术被认为是降低水中氨氮浓度、提高饮用水水质的行之有效的技术之一,该技术已在欧洲、日本等发达国家的多个地区被广泛应用.在我国氨氮浓度较高的东南沿海地区该技术也已得到逐步推广.然而,BAC在实际运行过程中未能有针对性地解决水源水质问题.目前国内对BAC的研究也主要集中在参数调整、处理效果监测等方面[4,5],缺乏对其主要功能机理的阐述,使得对BAC的改进和优化较为盲目.
研究发现氨氧化作用主要依靠两大类氨氧化微生物[6,7]来实现,即氨氧化古菌(ammonia-oxidizing archaea, AOA)和氨氧化细菌(ammonia-oxidizing bacteria, AOB)[8,9],二者在不同环境下的存在数量不同,且对营养物质存在竞争性生长[7,10,11].然而,我国饮用水处理中BAC上是否同时存在这两种类型微生物、它们与其它微生物之间的关系以及对BAC氨氧化的贡献等问题尚不明确.
高通量测序技术[12]能够最大程度地反映样品中微生物群落的整体情况.另外针对目标功能微生物的T-RFLP技术以及Q-PCR技术可以通过引物设计,针对性地研究特定微生物的多样性,进一步揭示其主要功能.
基于此,本研究通过对水厂实际运行的BAC进行硝化潜势测定和微生物群落特征解析,并比较了BAC上和滤池水中的微生物群落特征,以期从微观角度阐明其氨氧化机理,为进一步改进和优化BAC提供依据.
1 材料与方法
1.1 样品采集
BAC和活性炭滤池中的水样于2019年1月采自国内某自来水厂.该水厂水处理工艺为“臭氧+上向流BAC滤池+砂滤+氯消毒”,其中臭氧投加浓度为1.2 mg·L-1,臭氧接触时间为10 min,BAC已投入使用1年,其基本参数如表1所示.

表1 活性炭的基本参数Table 1 Characteristics of biological activated carbon
1.2 硝化潜势测定
将湿重为20 g的BAC样品放入灭菌后的锥形瓶,加入250 mL含有1.4 mg·L-1氨氮的无机培养基.无机培养液的成分包括4 mg·L-1KH2PO4、84 mg·L-1NaHCO3、50 mg·L-1MgSO4·7H2O、20 mg·L-1CaCl2·2H2O和微量元素混合液,pH调节为7.5,设置3个平行和1个对照组.硝化潜势测定:将上述处理置于20 ℃、50 r·min-1的恒温摇床中,反应24 h,定期(0、0.25、0.5、0.75、1、2、4、8、12、24 h)收集上清液,并通过0.22 μm的滤膜(津腾公司)收集保存.培养结束后测定上清液中的氨氮、硝态氮和亚硝态氮.通过吲哚酚蓝比色法测定水中的氨氮浓度,使用离子色谱仪(Thermo Fisher Scientific公司提供)进行硝态氮和亚硝态氮的测定.硝化潜势的计算公式[13]表示如下:

1.3 活性炭和水样中微生物群落
1.3.1 样品处理及DNA提取 取适量活性炭样品,加入一定量的1×PBS溶液后用GL-88B旋涡混合器振荡,将表面菌体洗入液体中;将洗后液体在12 000 r·min-1下离心2 min,提取沉淀.500 mL原位采集的水样通过0.22 μm PTFE膜过滤(Advantec公司提供),滤膜样品经液氮冷冻,用组织破碎仪破碎,将破碎后的滤膜装入2 mL离心管中.活性炭样品和水样均用E.Z.N.ATM Mag-Bind Soil DNA Kit(OMEGA公司产品)进行DNA提取,并对提取的DNA进行琼脂糖凝胶电泳检测.
1.3.2 细菌和古菌群落的Illumina MiSeq高通量测序分析 BAC和水样均进行细菌和古菌的V3-V4区扩增.样品细菌共扩增两轮,第1轮采用Nobar_341F(序列为“CCCTACACGACGCTCTTCCGATCTGCCTACGGGNGGCWGCAG”)和Nobar_805R(序列为“GACTGGAGTTCCTTGGCACCCGAGAATTCCA GACTACHVGGGTATCTAATCC”)作为引物进行扩增.PCR扩增程序为94 ℃ 3 min,94 ℃ 30 s,45 ℃ 20 s,65 ℃ 30 s,共5个循环;94 ℃ 20 s,55 ℃ 20 s,72 ℃ 30 s,共20个循环;72 ℃延长5 min,最后保持在10 ℃.第2轮扩增引入Illumina桥式PCR兼容引物,扩增程序为95 ℃ 3 min,94 ℃ 20 s,55 ℃ 20 s,72 ℃ 30 s,共5个循环;72 ℃延长5 min,最后保持在10 ℃.
样品古菌引用巢式PCR扩增,共3轮.第1轮使用GU1ST-340F(序列为“CCCTAYGGGGYGCASCAG”)和GU1ST-1000R(序列为“GGCCATGCACYWCYTCTC”)作为引物进行扩增.第2轮采用349F(序列为“CCCTACACGACGCTCTTCCGATCTN GYGCASCAGKCGMGAAW”)和806R(序列为“GACTGGAGTTCCTTGGCACCCGAGAATTCCAGGACTACVSGGGTATCTAAT”)作为引物进行扩增.前两轮的PCR程序均为94 ℃ 3 min,94 ℃ 30 s,45 ℃ 20 s,65 ℃ 30 s,共5个循环;94 ℃ 20 s,55 ℃ 20 s,72 ℃ 30 s,共20个循环;72 ℃延长5 min,最后保持在10 ℃.第3轮扩增引入Illumina桥式PCR兼容引物,扩增程序与细菌相同.
各样本测序序列通过独特的标签序列区分,区分样本后对序列质量进行质控和过滤.采用UCLUST算法,按照97%相似性对非重复序列(不含单序列)进行OTU(operational taxonomic units)聚类,选择丰度最高的序列计算Alpha多样性指数.通过R语言分析做出样品OTU分布韦恩图,利用Excel做出优势物种相对丰度柱状图,利用FAPROTAX数据库对样品进行功能注释预测.
1.4 氨氧化古菌和细菌的群落
1.4.1 氨氧化古菌和细菌的amoA基因的实时荧光定量PCR分析 采用SYBR荧光染料法对氨氧化微生物功能基因(amoA基因)进行实时荧光定量PCR(quantitative polymerase chain reaction, Q-PCR)分析.AOA的amoA基因扩增引物为Arch-amoAF(序列为“STAATGGTCTGGCTTAGACG”)和Arch-amoAR(序列为“GCGGCCATCCATCTGTATGT”)[14].PCR扩增程序为95 ℃ 5 min,95 ℃ 10 s,53 ℃ 20 s,72 ℃ 30 s,共50个循环,然后进行溶解曲线检测.amoA基因克隆NG-B-081028_K1(accession No. AB550804)作为古菌的内参基因.
AOB的amoA基因扩增引物为amoA1F*(序列为“GGGGHTTYTACTGGTGGT”)和amoA2R(序列为“CCCCTCKGSAAAGCCTTCTTC”)[15].PCR扩增程序为95 ℃ 5 min,95 ℃ 10 s,54 ℃ 20 s,72 ℃ 30 s,80 ℃ 5 s,共50个循环,然后进行溶解曲线检测.NitrosomonaseuropaeaATCC 19718的amoA基因作为细菌的内参基因.
1.4.2 氨氧化古菌和细菌的amoA基因的末端限制性片段长度多样性分析 通过末端限制性片段长度多样性(terminal restriction fragment length polymorphism, T-RFLP)比较分析活性炭和水样中的氨氧化微生物群落结构,利用与Q-PCR相同的引物进行扩增,即AOA的amoA基因扩增引物为Arch-amoAF和Arch-amoAR, AOB的amoA基因扩增引物为amoA1F*和amoA2R[6].对其中Arch-amoAF和amoA1F*的5′ 端被6-羧基荧光素(6-FAM)进行标记;并采用10 U HhaⅠ(内切酶)处理古菌的amoA基因,用10 U TaqⅠ(内切酶)处理细菌的amoA基因[6];最后通过测序仪(美国ABI提供)对片段进行测序,通过Genemapper软件分析T-RFLP数据.大于50 bp的基因片段用于微生物多样性分析.
1.5 数据分析
运用单因素方差分析对氨氧化微生物数量进行统计分析,通过IBM SPSS Statistics 26软件得出结果.
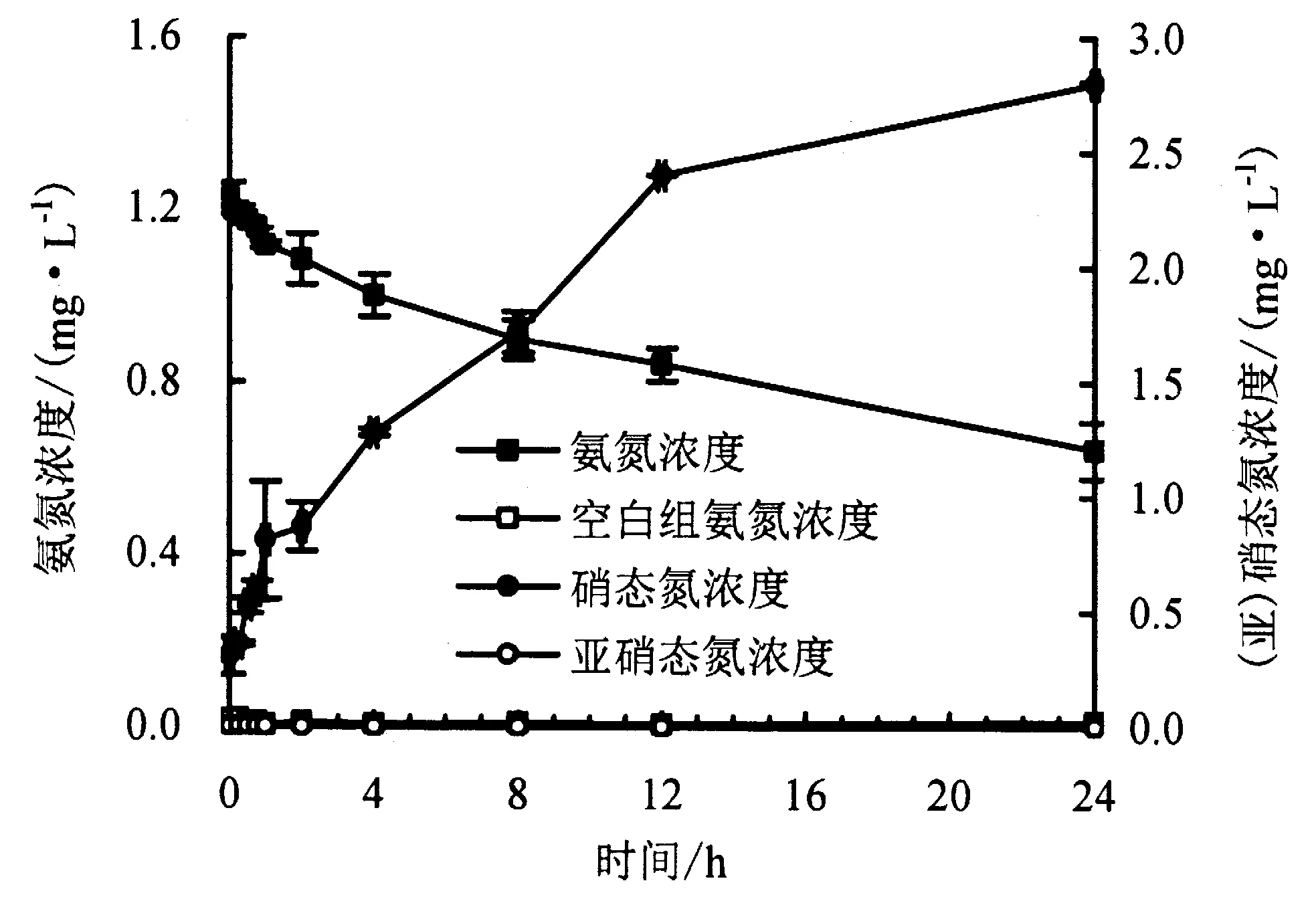
图1 BAC硝化潜势Fig.1 Nitrification potential of biological activated carbon
2 结果与分析
2.1 BAC硝化潜势
硝化潜势指BAC在氨氮浓度充足、最适条件下所能氧化氨氮的能力.硝化潜势测定过程中溶液氨氮、硝态氮、亚硝态氮的浓度随时间的变化情况如图1所示.BAC硝化潜势的计算结果为0.013 8 mg·L-1·h-1·g-1(干重).培养24 h后氨氮浓度从最初的1.22 mg·L-1降低到0.64 mg·L-1,硝态氮浓度从0.30 mg·L-1升高到2.80 mg·L-1,没有检测到亚硝态氮.
2.2 BAC和滤池水样中微生物群落
2.2.1 BAC和滤池水样中微生物的多样性 通过Illumina测序对原始序列进行数据预处理,结果如表2所示.BAC及滤池的水样分别用TB和TW表示,两种样品得到的细菌优质序列数分别为48 298和62 711,古菌优质序列数分别为58 272和63 620.将这些序列在97%的相似性水平下进行聚类分析,从而得出每个样本中细菌和古菌的OTU数量.从表2可以看出,测序结果可以覆盖样品中所有能检测到的序列(>97%).样品中细菌和古菌的群落多样性通过群落生态学中的Shannon指数、Chao1指数和Shannoneven指数来反映.Chao1指数用于反映样品中物种的丰富度.Shannon指数则可代表生物多样性,Shannon指数越大,生物多样性越高.Shannoneven指数表示物种个体数目在群落中分配的均匀程度指数,其数值越大不同物种个体的分布越均匀.TB样品中无论细菌还是古菌的Shannon指数、Chao1指数和Shannoneven指数均大于TW,表明TB的生物多样性高于TW,且TB的物种个体分布均匀性也高于TW.
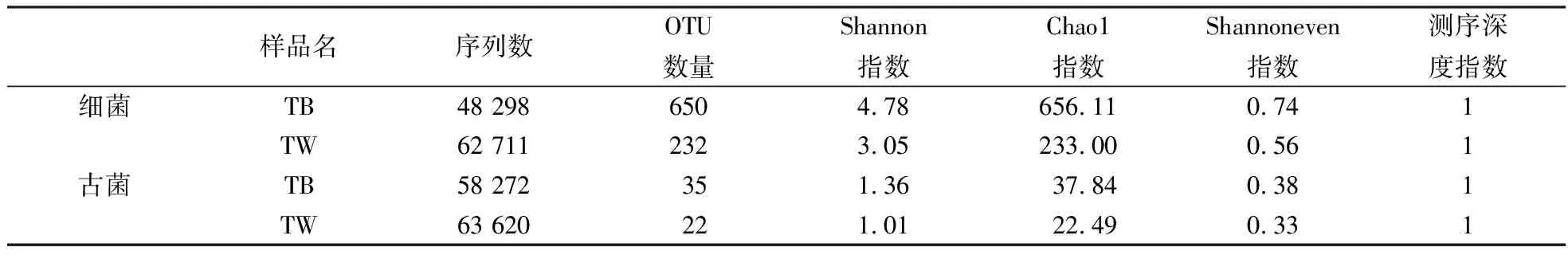
表2 BAC及其原水中微生物多样性Table 2 Microbial diversity of biological activated carbon and filtered water
TB与TW虽然来自同一活性炭滤池,但其细菌共有OTU数目仅为67,古菌共有OTU数目仅为5,远远小于它们各自拥有的OTU数目.从图2可以看出活性炭与水中微生物种类相差较大.
2.2.2 BAC和滤池水样中微生物群落结构对比 从图3可以看出,TW样品细菌中苯基杆菌属(Phenylobacterium)占比最大(31.67%),代尔夫特菌属(Delftia)占比(12.71%)次之.TW样品中古菌以甲烷短杆菌属(Methanobrevibacter)和甲烷丝菌属(Methanothrix)为主,分别占整个古菌群落的60.73%和39.12%.TB样品的细菌中除未分类的细菌(unclassified_Bacteria)和未分类的浮霉菌科(unclassified_Planctomycetaceae)外,只有Aquicella和Parcubacteria_genera_incertae_sedis占比超过10%,分别为19.05%和11.15%;TB样品中古菌除未分类的热原体纲(unclassified_Thermoplasmata)外,氨氧化古菌Nitrosopumilus和Nitrososphaera分别占整个古菌群落的54.20%和9.45%.
此外,基于FAPROTAX数据库的预测结果(图4)也表明TW样品中细菌没有硝化作用,古菌的硝化作用仅占0.016%.而TB样品中细菌群落的功能注释预测硝化作用仅占0.046%,但其古菌群落的硝化作用却占77.72%,表明BAC的硝化功能是以古菌为主.
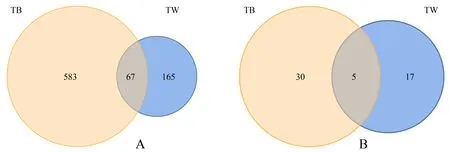
A为细菌的OTU;B为古菌的OTU.图2 TW和TB中微生物OTU的韦恩图Fig.2 Venn diagram of OTU distribution of microorganisms in biological activated carbon and filtered water
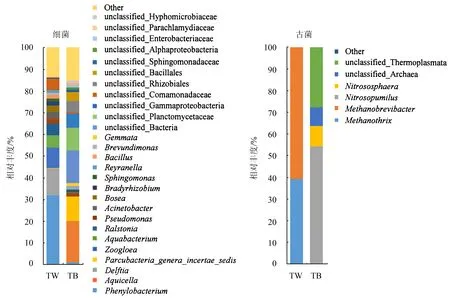
图3 TW和TB中细菌和古菌的群落结构组成Fig.3 Bacterial and archaeal community structure in biological activated carbon and filtered water
2.2.3 氨氧化微生物(AOA和AOB)的群落结构 运用Q-PCR技术对BAC上AOA和AOB的amoA基因进行定量分析,结果表明AOA数量为(49.10±4.45)×105个·g-1(干重),AOB数量为(23.20±2.55)×104个·g-1(干重), AOA数量显著大于AOB(P<0.01).
运用T-RFLP技术对水中和BAC上的AOA和AOB的amoA基因多样性进行分析,指纹图谱如图5所示.图5中不同峰代表不同种氨氧化微生物.从图5可以看出,AOA共得到4种氨氧化古菌,A-OTU1、A-OTU2、A-OTU3、A-OTU4的片段长度分别为58、87、95、219,其中BAC上有A-OTU1、A-OTU2和A-OTU3,以A-OUT3为优势种.水中主要有A-OTU3和A-OTU4,以A-OTU4为主.AOB共得到7种不同氨氧化细菌,即B-OTU1、B-OTU2、B-OTU3、B-OTU4、B-OTU5、B-OTU6、B-OTU7,其片段长度分别为65、73、79、87、119、155、216,其中BAC上是以B-OTU1和B-OTU2为主.而水中则同时检出7种氨氧化细菌,以B-OTU1、B-OTU3和B-OTU4为主,表明AOB在水中的多样性高于BAC.
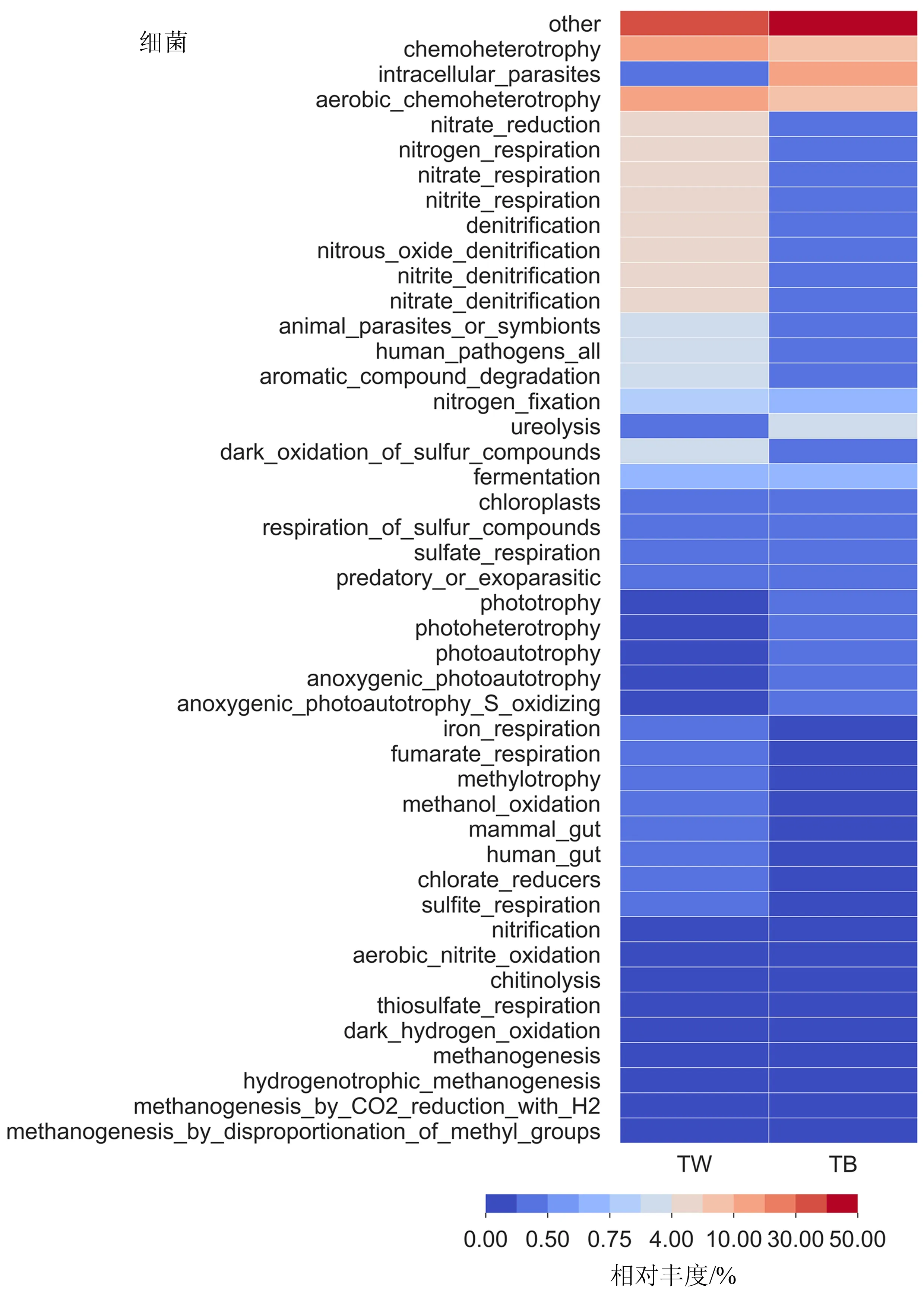
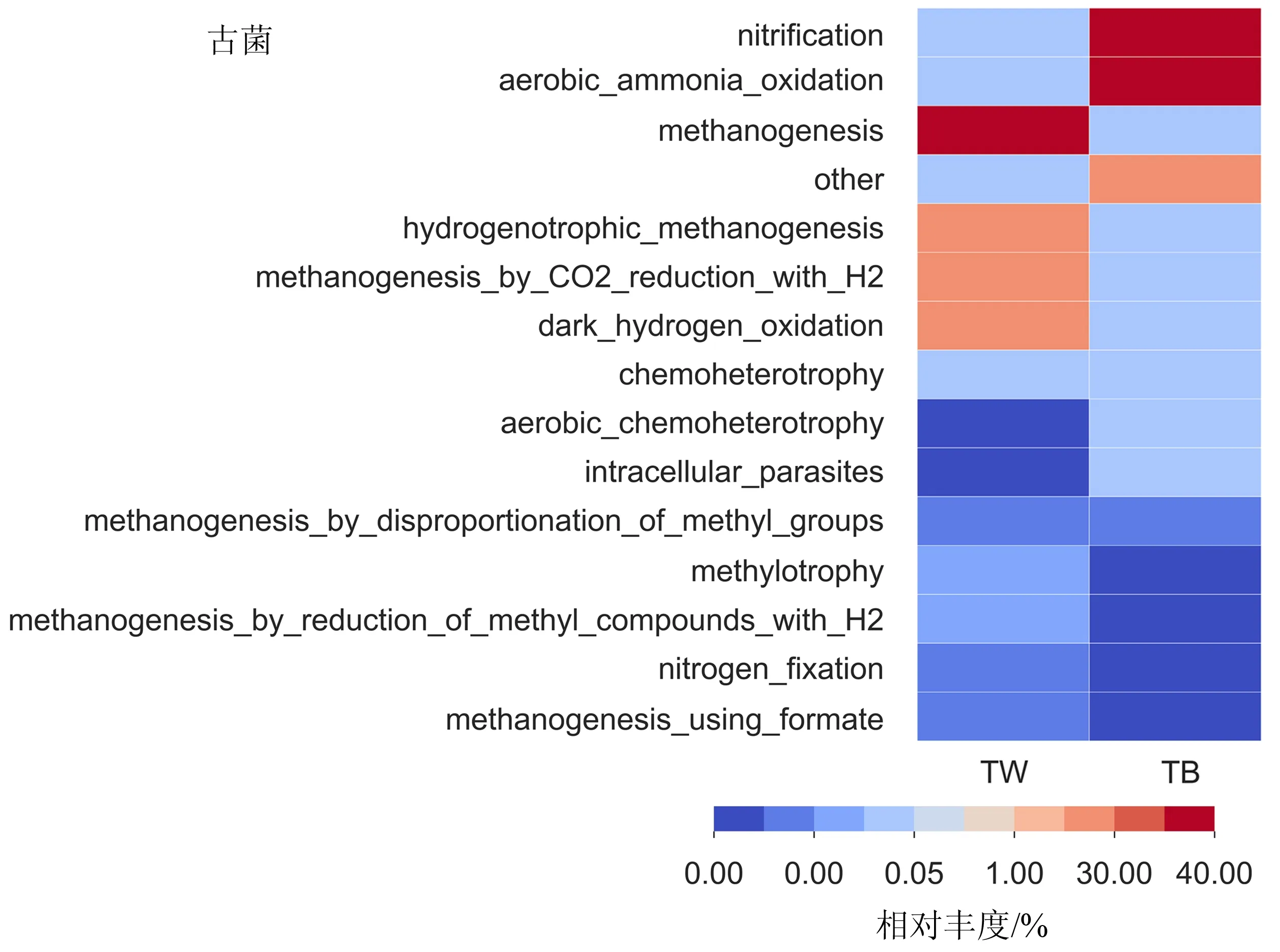
图4 TW和TB的功能预测热图 Fig.4 Heat map of function prediction of biological activated carbon and filtered water
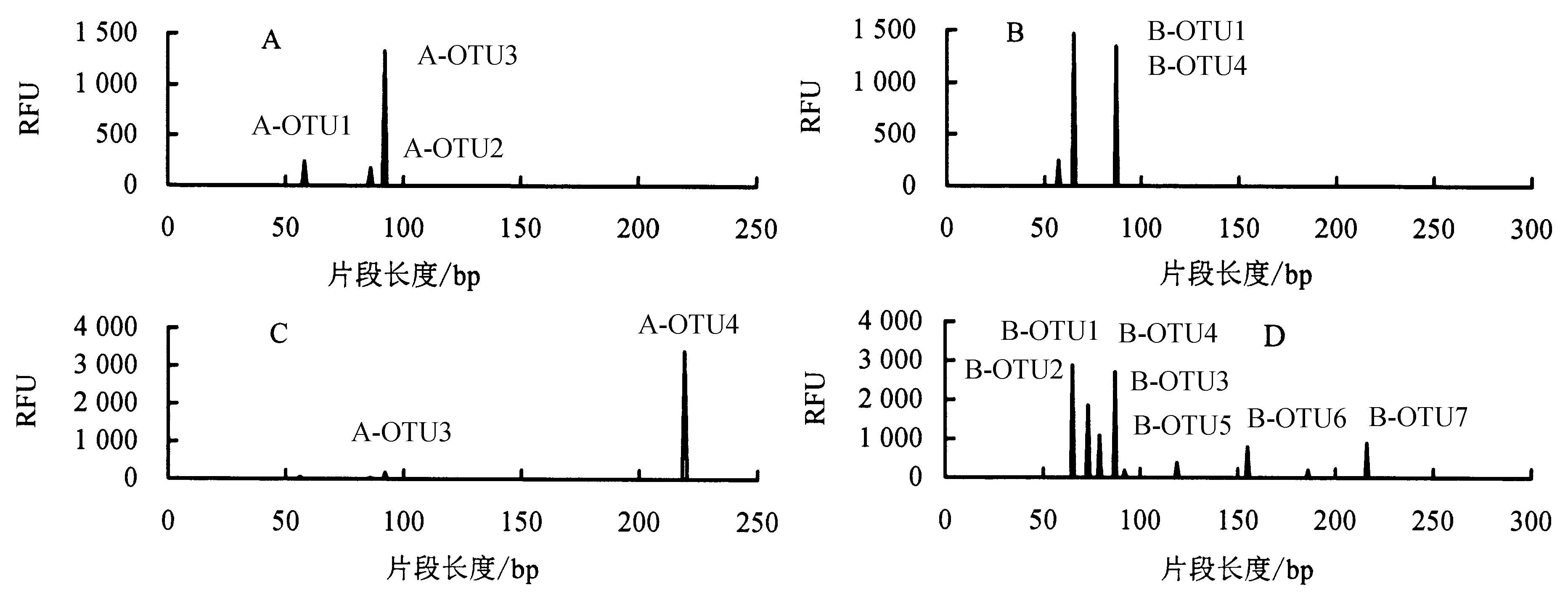
A为TB的古菌amoA基因图谱,B为TB的细菌amoA基因图谱,C为TW的古菌amoA基因图谱,D为TW的细菌amoA基因图谱.图5 TB和TW的T-RFLP图谱Fig.5 T-RFLP map of biological activated carbon and filtered water
3 讨论与小结
本研究从BAC的硝化潜势入手,结合总体微生物群落结构和氨氧化微生物的丰度以及多样性,探究了BAC上微生物的主要特征、硝化功能微生物在总体微生物群落所占比例,以及两大类不同氨氧化微生物之间的关系.此外,通过将BAC和滤池水样进行对比,探讨了BAC上微生物形成的原因及可能的来源.
从BAC硝化潜势结果可以看出,溶液中没有检测到亚硝态氮的存在,表明亚硝态氮在培养试验中能够很快被氧化成硝态氮.此外,溶液中存在总氮化学不平衡的现象,推测产生这一现象的原因是BAC在水厂的长期运行过程中已吸附了处理水中一定量的硝态氮,吸附的硝态氮随着培养时间而逐渐释放.BAC的硝化潜势为 0.013 8 mg·L-1·h-1·g-1(干重),与Niu et al[16]报道的日本水厂BAC在冬季硝化潜势值[0.019 mg·L-1·h-1·g-1(干重)]相当,但低于夏季的硝化潜势[0.027~0.037 mg·L-1·h-1·g-1(干重)].本研究采样时间与文献[16]中报道的冬季采样时间一致,表明采样时间有可能影响对BAC硝化能力的评价.
通过高通量测序发现BAC和滤池水中的微生物群落结构差异较大,且BAC的群落多样性和个体均匀程度均高于水体,这可能是由于活性炭较大的比表面积及其表面的一些大孔使微生物有效地定植生长且不受水流作用而脱落[13].同时,由于活性炭对水中的营养成分有较高的吸附能力[17],且对氧的亲和力较高[18],为微生物的富集生长提供了可能.对属水平的微生物群落组成的研究发现滤池水中甲烷古菌占主导地位.活性炭的种群结构及功能预测则显示氨氧化古菌在BAC上起着至关重要的作用,表明活性炭上的微生物群落结构不受处理水中的微生物组成影响.
为进一步探讨氨氧化机制,运用Q-PCR和T-RFLP方法对BAC上两种类型的氨氧化微生物AOA和AOB进行数量和多样性比较,发现BAC上AOA的数量多于AOB,且与东京水厂的冬季BAC上的AOA数量[(1.8×105~1.5×109)个·g-1)]相当.但AOB数量则略低于东京水厂的冬季BAC上的AOB数量[(4.5×105~4.1×107)个·g-1(干重)][16].AOA在活性炭上处于主导地位,这与AOA对环境因子的适应性比AOB高有关[19].酸碱度是AOB的限制性因子,但AOA却能适应环境中更广范围的pH值.又如Klotz et al[20]发现AOA对温度的适应范围比AOB大,其对温度的耐受性也更好.此外对比水中和BAC上氨氧化微生物的T-RFLP图谱,发现无论是AOA还是AOB,其在BAC和水中的群落结构并不一致,表明氨氧化微生物在BAC上的定植、富集是具有选择性的.同时也说明BAC上微生物种类及数量并不受处理水的影响.从T-RFLP得到的氨氧化微生物片段长度可以看出本研究的OTU片段长度与国外已报道的BAC上的OTU长度不一致[7,21],说明BAC上所存在的氨氧化微生物种类与国外水厂不同.国内外饮用水厂中BAC上氨氧化微生物的差异与BAC所处理的水源水质、运行条件、材质、粒径等有关.
本研究得到如下结果:(1)BAC的硝化潜势测定结果表明其硝化能力与已报道的BAC的硝化能力相当,但采样时间可能是影响硝化潜势差异的主要原因;(2)BAC和滤池水中的总体微生物群落结构差异较大,且氨氧化微生物(AOA和AOB)在BAC上和水中的群落组成也不一样,表明微生物在BAC上的定植具有选择性;(3)BAC上氨氧化古菌和氨氧化细菌数量及群落结构的研究结果都表明AOA在BAC上占主导地位.

