食品环境中单核细胞增生李斯特菌菌膜形成、转移及防控措施研究进展
孙琳珺,张红芝,方太松,王 园,3,刘阳泰,王 翔,李红梅,李代禧,董庆利,*
(1.上海理工大学医疗器械与食品学院,上海 200093;2.上海市疾病预防控制中心,上海 200336;3.上海中侨职业技术大学,上海 201514)
单核细胞增生李斯特氏菌(Listeria monocytogenes)是一种革兰氏阳性杆菌,常见于生鲜或加工食品、家养或野生动物中,它能够引起李斯特菌病,导致幼儿、老年人以及易感人群患败血症、脑膜炎等疾病以及孕妇流产[1]。欧洲食品安全局和欧洲疾病预防控制中心报道了欧洲2018年由单核细胞增生李斯特菌引起的食源性疾病2 549 例,其中死亡病例229 例[2]。美国疾病预防控制中心在2019年报道了24 例李斯特菌病例,其中22 例住院病例,2 例死亡病例[3]。2013—2017年,中国也报道了211 例李斯特菌病病例,致死率达26.1%[4]。因此,单核细胞增生李斯特菌对食品环境的污染值得加强关注。
单核细胞增生李斯特菌能够在极端环境如低温、高盐和低pH值条件下存活,其菌膜形成可能是其耐受极端环境的原因之一[5-6]。菌膜是镶嵌在自身产生且能够黏附于生物或非生物表面的胞外物质中相同或不同属的微生物群落[7]。在食品环境中,细菌可以在传送带、切割物表面、管道、墙壁等食品接触表面形成菌膜[5],相比于游离细胞,菌膜对消毒剂具有更好的抗性,并且能够在不同条件的极端环境下适应和生存[8],甚至可以提高单核细胞增生李斯特菌的毒性。单核细胞增生李斯特菌菌膜形成后就难以完全去除,从而成为交叉污染的传播中心,并成为食品安全隐患,进而导致食源性疾病暴发以及经济损失[9]。当前关于单核细胞增生李斯特菌菌膜的研究主要分为两个方向:1)关注单核细胞增生李斯特菌菌膜在不同条件下的形成及转移情况;2)针对单核细胞增生李斯特菌菌膜的预防及控制措施研究。
本文首先总结了食品环境中单核细胞增生李斯特菌菌膜形成能力的研究,其次综述了单核细胞增生李斯特菌菌膜形成和转移影响因素的研究进展,最后着重对单核细胞增生李斯特菌菌膜从预防和控制两个方面进行较为全面的概述,以期为研究单核细胞增生李斯特菌在食品环境中的菌膜污染因素及途径提供参考,同时也为食源性致病菌的风险评估提供理论依据。
1 食品环境中单核细胞增生李斯特菌菌膜形成能力
目前单核细胞增生李斯特菌菌膜的测定方式主要有微孔板结晶紫染色法以及菌膜菌量计数法两种。结晶紫染色法是将培养一定时间后的菌膜通过结晶紫进行染色,进而测定菌膜的OD值并与对照组OD值进行比较来判断菌膜形成能力的强弱。获得的菌膜OD值将与阴性对照组OD值(ODc)的1、2、4 倍进行比较从而判定菌膜的形成能力[10-11]。结晶紫染色法可以在筛菌的过程中加清晰地了解到每株菌的菌膜形成能力,但是由于这一过程中一并测定了胞外物质的OD值并且结果相对不稳定,因此并不适用于观察菌膜中细菌的生长与转移过程。另外,随着研究的深入,以OD值对菌膜形成能力强弱进行评判的标准也发生了一些改变。Osman等[12]将OD值为0.1和1作为菌膜形成能力弱、强和非常强的分界线。Stoller等[13]则使用一株菌膜形成能力强的菌株与一株菌膜形成能力弱的菌株作为对照组,将其OD值与其余菌株的菌膜OD值进行比较,进而判断菌膜形成能力的强弱。因此就结晶紫染色法而言,菌膜形成能力的强弱判定标准需一致。
菌膜菌量计数法是将菌膜通过拍打或者漩涡的方式将菌膜脱落,进而测定菌膜中所含的菌量,通过菌膜中菌量来判定菌膜形成能力。Piercey等[14]发现在肉品工厂与海鲜工厂中采样的单核细胞增生李斯特菌菌膜量都大于7(lg(CFU/cm2))。另外,标准菌株经常作为参考菌株来判定其他菌株的形成能力[15-17]。菌膜菌量计数法能够较为直观地看出菌膜中的菌量,从而可以更好地判断在形成以及转移过程中细菌数量的变化。然而,目前标准菌株的选择并没有一个统一的参考,因此,菌膜菌量法只能比较菌膜菌量的高低,但是对于菌膜的形成能力强弱无法确定。
近5 年来,食品生产中养殖、屠宰、加工以及零售等阶段的单核细胞增生李斯特菌菌膜形成能力如表1所示。单核细胞增生李斯特菌具有良好的菌膜形成能力且不同菌株的菌膜形成能力有所差异,因此,更多具有代表性的单核细胞增生李斯特菌菌株需要进行进一步的研究,从而更加深入了解单核细胞增生李斯特菌的菌膜形成过程。其次,对于单核细胞增生李斯特菌菌膜的判断标准也各有不同,并且不同测定方法获得的数据也不具有可比性。此外,就1 种单核细胞增生李斯特菌菌膜测定方法来说,不同研究对菌膜的强弱判断标准也有所不同。以上两个问题导致数据之间缺乏可比性,从而对单核细胞增生李斯特菌菌膜形成强弱的判断缺乏依据。所以,统一菌膜强弱评判标准以及建立菌膜测定方法之间的联系是目前亟待解决的问题。
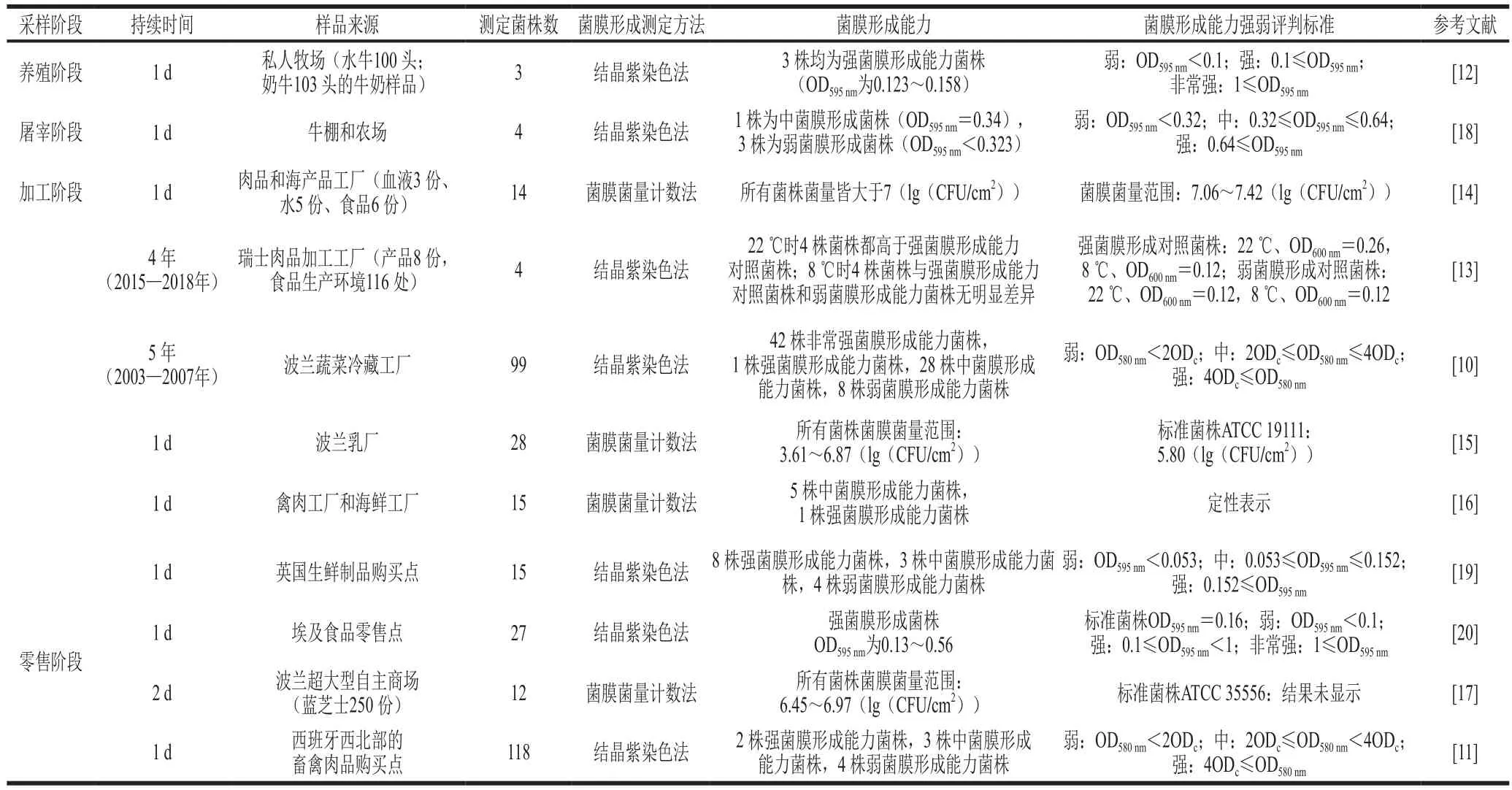
表1 食品环境中不同阶段检出的单核细胞增生李斯特菌形成能力Table 1 Biofilm formation ability of L. monocytogenes in food environment at the stages of farming, slaughter, processing and retail
2 单核细胞增生李斯特菌菌膜形成与转移影响因素
2.1 单核细胞增生李斯特菌菌膜形成影响因素
2.1.1 内部形成影响因素
单核细胞增生李斯特菌菌膜形成受多种内部因素的影响。首先,菌株表面特性例如疏水性、黏液产生能力以及自聚能力等对菌膜形成可能产生影响,Choi等[21]在研究中发现菌膜形成与自聚能力无关联,而与细菌的黏液产生能力以及疏水性呈正相关。然而,也有研究发现菌膜形成与细胞表面疏水性并无显著性关联[22]。
其次,不同采样来源的单核细胞增生李斯特菌形成菌膜的能力也有所差异。Rodríguez-Campos等[23]发现分别取样自不锈钢材质以及聚苯乙烯材质上的单核细胞增生李斯特菌在原材质上的菌膜形成能力更强。同时,其还探讨了采样后单核细胞增生李斯特菌的持续性或偶发性对菌膜形成的影响。有研究发现单核细胞增生李斯特菌菌膜形成与菌株的偶发性或持续性均无关联[24-25]。然而,Nowak等[24]通过对比采样自禽类加工工厂中的持续性和偶发性单核细胞增生李斯特菌发现,持续性菌株的菌膜形成能力高于偶发性菌株。
除此之外,单核细胞增生李斯特菌中的胞外核糖核酸和质粒对菌膜的形成也具有显著影响。Zetzmann等[26]对脱氧核糖核酸酶敏感或抵抗单核细胞增生李斯特菌的胞外核糖核酸进行研究,结果证实了胞外核糖核酸在低渗透活性物质浓度的介质中对单核细胞增生李斯特菌菌膜形成具有重要作用。pLMSZ08质粒也被发现对单核细胞增生李斯特菌菌膜的形成产生显著影响,实验发现,质粒的缺失对细菌黏附前期并无显著影响,然而在30 ℃下培养48 h后的正常菌株有能力形成更加致密的菌膜[27]。
最后,大量研究表明基因的调控与单核细胞增生李斯特菌菌膜的形成也具有显著联系。当一些毒力基因或者胁迫基因(表2)缺失后,单核细胞增生李斯特菌的初步黏附以及菌膜形成量呈现下降趋势并在极端环境下的存活能力降低。

表2 影响单核细胞增生李斯特菌菌膜形成的基因Table 2 Genes related to biofilm formation of Listeria monocytogenes
单核细胞增生李斯特菌自身特性对菌膜的形成具有影响,每株菌的特性不同导致了菌膜形成的变异性,因此内部影响因素导致单核细胞增生李斯特菌菌膜形成的不同需要更多具有代表性菌株去验证。此外,许多内部形成因素对菌膜形成的机理并未了解清楚,需要进一步的基础研究。
2.1.2 外部形成影响因素
温度和培养成分是研究最多的两个外边形成因素。当温度上升时,通常会促进单核细胞增生李斯特菌菌膜的形成[39-41]。然而,Zetzmann等[42]发现在稀释的培养基中,较37 ℃下培养,25 ℃下培养的单核细胞增生李斯特菌菌膜形成量更多。Nowak等[39]也发现了这一现象,分析可能原因为过少的营养虽然使大部分细菌处于初步黏附状态无法形成菌膜[43],但也迫使单核细胞增生李斯特菌在适宜的温度下形成菌膜从而对抗极端环境。
综上,单核细胞增生李斯特菌菌膜的形成与培养环境中的营养成分也有重要的联系。在普通培养基中,胰酪大豆胨液体培养基和营养肉汤中形成的单核细胞增生李斯特菌菌膜具有显著性差异[44];在实际食品培养介质中,猪肉汁、牛肉汁与鸡肉汁中的单核细胞增生李斯特菌菌膜形成量也有所不同,其中在猪肉汁中的形成量最多[45]。除此之外,碳源的研究也是重要的考量指标之一。Ibusquiza[40]、Kyoui[46]等发现仅加入葡萄糖的培养基中单核细胞增生李斯特菌菌膜形成量显著下降,而其余培养基中菌膜形成量并无显著差异,然而葡萄糖能够促进菌膜胞外物质的产生。另外,乳糖的加入使对抗逆境条件的sigB基因上调[47],从而使单核细胞增生李斯特菌形成更多菌膜,因此乳糖的利用会触发强烈的SigB因子依赖性应激反应,这可能对食品接触表面单核细胞增生李斯特菌菌膜形成有益。同样的,壳寡糖在研究中也显示出具有相同的促进效果[48]。
另外,菌膜的湿度、培养时间和黏附材质也影响了单核细胞增生李斯特菌菌膜的形成量。Piercey等[14]发现在湿度较低的环境中单核细胞增生李斯特菌菌膜量随时间的延长而降低。Ripolles-Avila等[49]将单核细胞增生李斯特菌培养24、48、72 h后的菌膜量进行对比,发现48 h是最适宜的培养时间。有研究表明,当粗糙度越大时,单核细胞增生李斯特菌菌膜越容易形成[50]。另外,在不同材质上单核细胞增生李斯特菌菌膜的黏附也具有显著性差异[51]。
在复杂的微生物环境中,两菌和多菌之间的相互作用也影响了单核细胞增生李斯特菌菌膜的形成,当单核细胞增生李斯特菌与其他菌株混合培养时,其菌膜形成量将低于单菌培养时菌膜形成量。例如植物乳杆菌的增加会导致环境pH值下降,从而使单核细胞增生李斯特菌在酸环境中被杀灭[8],或者如枯草芽孢杆菌可以改变单核细胞增生李斯特菌菌膜的形态从而降低其酶活性、黏附能力、毒力、溶血活性以及细胞运动,最后导致单核细胞增生李斯特菌菌膜的减少[52]。另外,当两菌生长过程中存在竞争关系时,优势菌群例如假单胞菌属[53-55]等在生长的过程中使单核细胞增生李斯特菌的生长缓慢,从而在两菌菌膜中促进优势菌群的菌膜形成,而单核细胞增生李斯特菌菌膜的形成没有变化。两菌或多菌对单核细胞增生李斯特菌菌膜形成的影响(表3)说明外部形成因素往往可以激发单核细胞增生李斯特菌内部形成因素的改变,从而使单核细胞增生李斯特菌菌膜的形成发生改变,因此,了解外部形成因素与内部形成因素的关系能够更好地了解菌膜形成的机理。

表3 两菌或多菌对单核细胞增生李斯特菌菌膜形成的影响Table 3 Effect of dual- or multi-species on Listeria monocytogenes biofilm formation
2.2 单核细胞增生李斯特菌菌膜转移影响因素
单核细胞增生李斯特菌菌膜一旦形成,就难以彻底去除,继而会导致交叉污染,扩大了单核细胞增生李斯特菌的传播与污染范围。目前关于单核细胞增生李斯特菌菌膜转移的研究主要是模拟不同食品环境因素对菌膜转移的影响以及对比有无菌膜下单核细胞增生李斯特菌的转移情况以及消杀状态下单核细胞增生李斯特菌菌膜的转移,通过建立模型,可以更直观地了解在食品环境中单核细胞增生李斯特菌菌膜的转移情况(图1)。

图1 单核细胞增生李斯特菌菌膜转移图解Fig 1 Schematic representation of the transfer of Listeria monocytogenes biofilm
不同环境因素可以影响单核细胞增生李斯特菌菌膜的转移效果。Midelet等[57]模拟了7 种因素对单核细胞增生李斯特菌单菌或混菌菌膜在胰蛋白胨大豆琼脂上的黏附和连续转移的影响,并且运用Veulemans公式和3 种双相以及单相脱落动力学进行黏附强度和转移能力的测定以及斜率。
单核细胞增生李斯特菌是否形成菌膜对其转移能力也有一定的影响。Hansen等[58]模拟了三文鱼生产环境中单核细胞增生李斯特菌在形成或未形成菌膜情况下的转移,并通过转移效率来衡量菌膜中细菌的转移程度。结果发现在不同极端环境下,菌膜对细菌具有保护作用,且对食品加工过程中交叉污染具有潜在风险。另外,研究发现无菌膜情况下的细菌转移能力要高于有菌膜下的转移能力,但是菌膜的存在大大提高了二次污染的概率。在食品环境中,消毒杀菌会导致单核细胞增生李斯特菌及其菌膜被杀灭,从而导致菌膜的转移。Keskinen等[59]对比了有无冷应激与消毒处理情况后单核细胞增生李斯特菌混菌菌膜的损伤与在肉制品中的转移情况。结果表明,冷应激对单核细胞增生李斯特菌菌膜存活与转移有一定影响,而消毒情况则随食品成分、菌膜形成时间的不同有所差异。Pang Xinyi等[54]模拟了不同成膜顺序下单核细胞增生李斯特菌和荧光假单胞菌两菌菌膜在三文鱼工厂中的消毒杀菌效果对菌膜转移的效果。结果发现荧光假单胞菌先于单核细胞增生李斯特菌形成菌膜,对干燥环境和消毒剂处理的抗性更好。
以上诸多研究表明在不同的加工环境因素下,单核细胞增生李斯特菌的菌膜形成能力都有所不同。其次,食品接触表面形成的菌膜会保护细菌免受极端环境和消毒剂的杀灭,从而提高交叉污染和二次污染的风险。然而,当前模拟实际情况中菌膜的转移情况研究较少,这就意味着当前的菌膜转移研究并不能更好地贴合工厂实际情况进行菌膜转移的模型建立。因此,模拟真实食品介质以及复杂微生物环境下单核细胞增生李斯特菌菌膜的转移研究值得进一步深入推进。
3 单核细胞增生李斯特菌菌膜防控措施
单核细胞增生李斯特菌菌膜的形成与转移会导致污染的传播,影响食品安全,同时也使食品企业受到巨大损失,因此针对于单核细胞增生李斯特菌菌膜的防控措施研究也是当下研究热点。单核细胞增生李斯特菌菌膜的防控措施可分为物理、化学、生物措施或者联合处理措施。
3.1 物理措施
近年来,物理控制措施不断改进,最初研究发现通过在设备表面镀铜纳米粒子膜层可以明显对单核细胞增生李斯特菌与铜绿假单胞菌单菌的初期黏附具有显著抑制效果[60]。随着研究的深入,目前物理措施主要分为两种,一种是光动力灭菌技术,另一种则是冷大气等离子体灭菌技术。李红爱等[61]将质量浓度10 μg/mL亚甲基蓝作为光敏剂,通过光动力灭菌技术,经200 mW/cm2的可见光照射30 min后单核细胞增生李斯特菌菌膜的失活率可达99.99%以上。姜黄素作为介导光动力学的灭活物质也被发现能够改变单核细胞增生李斯特菌菌膜的形态以及黏附能力,因此可以有效消除单核细胞增生李斯特菌菌膜[62]。相比于光动力灭菌技术来说,冷大气等离子体的研究更为广泛。Kim等[63]应用大气等离子体喷射装置对3 种不同材质储藏一段时间后形成的单核细胞增生李斯特菌菌膜进行3 种时间的处理。结果发现10 min处理后,单核细胞增生李斯特菌菌膜在任一材质上的菌量都减少3~4(lg(CFU/cm2))。
此后冷大气等离子体被进一步应用于单核细胞增生李斯特菌与其他菌株的混合菌膜处理中。Govaert等[64]对不同培养介质、培养温度、初始接菌量比例以及培养时间下的单核细胞增生李斯特菌与沙门氏菌两菌菌膜进行冷大气等离子体处理并分析不同处理时间后的结果。随后,该团队进一步研究了冷大气等离子体在不同放电方式、氧气水平及输入电压下对单核细胞增生李斯特菌和鼠伤寒沙门氏菌菌膜的灭活作用[65]。最后,他们尝试运用大气等离子体预冷液处理单核细胞增生李斯特菌菌膜,结果表明该方法也具有很好的处理效能[66]。冷大气等离子体对单核细胞增生李斯特菌及与荧光假单胞菌形成的菌膜也被证明具有较好的去除效果[67]。
以上物理防控措施能够较好地去除单核细胞增生李斯特菌菌膜,然而目前的研究较少,并且在食品加工工厂中的可操作性较差。另外,物理控制措施的机器成本也较高,并不能完全适应商业化生产,还需要进一步优化与改进。
3.2 化学措施
食品工厂消毒杀菌剂如季铵盐消毒剂、氯溶液、次氯酸溶液、过氧乙酸等常用于工厂设备表面的化学消毒杀菌剂[68]。Poimenidou等[22]研究了商业杀菌剂的最小抑菌浓度以及去除菌膜浓度并且观察各株单核细胞增生李斯特菌在72 h后菌膜对杀菌剂的抗性后发现单核细胞增生李斯特菌菌膜形成能力与最小抑菌浓度呈正相关,而菌膜形成能力越好,对杀菌剂的抗性也越大。
另外,其他具有杀菌消毒效果的化学试剂例如乙酸[69]、乳酸、次氯酸钠以及乙酰丙酸加硫酸钠混合杀菌剂[70]等对单核细胞增生李斯特菌混菌的杀菌效果也受到关注和研究。Lee等[69]运用乙酸对单核细胞增生李斯特菌在两种不同材质表面形成的菌膜进行不同时间处理的失活研究。结果发现处理60 s后菌膜菌量几乎全部失活,而到180 s时细胞全部破坏。Chen Dong等[71]发现2%乳酸钠加3%乳酸对单核细胞增生李斯特菌菌膜灭活效力最好。Liu Fang等[70]对比了3-苯基乳酸、乳酸以及乙酰丙酸-硫酸钠在不同浓度以及不同处理时间下对单核细胞增生李斯特菌菌膜的灭活作用。结果表明,3-苯基乳酸对单核细胞增生李斯特菌菌膜甚至成熟菌膜都具有良好的灭活作用。然而,此研究中所有方法都不能完全去除单核细胞增生李斯特菌菌膜。
化学防控措施是目前食品加工工厂中常用的消毒杀菌方法,虽然能够去除较多的菌膜,但是本身具有一定毒性,这无疑对消费者的安全具有一定风险隐患。另外,单核细胞增生李斯特菌对化学消毒杀菌剂具有一定抗性和敏感性[72-73],因此并不能完全去除单核细胞增生李斯特菌菌膜。
3.3 生物措施
如表4所示,在当前研究中,生物控制措施主要分为植物精油及其提取物、噬菌体、乳杆菌及其细菌素以及抑菌肽等。大量研究表明植物精油及其提取物对单核细胞增生李斯特菌菌膜具有有效抑制效果。植物精油及其提取物能够抑制单核细胞增生李斯特菌的生长,并且改变单核细胞增生李斯特菌菌膜的形状。

表4 单核细胞增生李斯特菌菌膜生物防控措施Table 4 Biocontrol measures of Listeria monocytogenes biofilm
除了植物精油及其提取物,噬菌体、乳杆菌及其细菌素以及抑菌肽也受到关注和研究。噬菌体可以侵袭细菌从而抑制细菌生长,同样地,产细菌素的菌株也可以抑制单核细胞增生李斯特菌生长并且破坏其菌膜的形状,关于抑菌肽通过抑制细菌生长而减少单核细胞增生李斯特菌菌膜的研究也在逐步进行中。
生物控制措施作为较为安全且环保的方法逐渐引起研究者关注,然而生物防控措施对细菌控制的普适性以及精油的挥发气味及效力、剂量与成本都有待评判。另外,关于抑菌肽和噬菌体的研究较少,需要进一步研究对其抑菌效果以及对食品安全进行评估。
3.4 联合处理控制措施
冷大气等离子体、化学消毒剂以及植物精油都被作为联合处理措施之一进行更好的菌膜去除。冷大气等离子体可以结合其他化学或者生物控制措施从而提高其杀菌效果。Govaert等[97]发现对单核细胞增生李斯特菌菌膜进行冷大气等离子体处理后加入过氧化氢可以更好地去除菌膜。而经过等离子体处理后的包装,加入细菌素衍生肽1018K6后可以有效减少单核细胞增生李斯特菌菌膜在工厂中形成的风险[98]。
化学消毒剂也常与其他措施混用从而达到更好的杀菌效果。Ban等[99]将4 种消毒杀菌剂(次氯酸钠、过氧化氢、碘化物以及氯化苯)与蒸汽加热方式结合具有协同增效作用,其中蒸汽加热20 s后使用质量浓度20 mg/L碘化物消毒30 s可使测定菌量低于可检测范围。Rodríguez-López等[100]将链霉蛋白酶与氯化苯联合可以更有效去除大肠杆菌和单核细胞增生李斯特菌两菌晚期菌膜。乙二胺四乙酸与乳酸菌细菌素结合也具有协同增效的作用,然而两者结合也并不能完全去除单核细胞增生李斯特菌菌膜[101]。
在联合处理控制措施中,植物精油常作为其中的措施之一。Smith等[102]将乳酸链球菌素(Nisin)或Nisin衍生物M21A与两种食品级添加剂(柠檬酸与肉桂醛)混合,结果发现M21A的效果更佳。柠檬醛精油配合纳米乳液[103]的组合也可以有效抑制菌膜,其抑制率为83.51%。Vitanza等[104]发现冬季香薄荷精油和庆大霉素结合可以有效减少单核细胞增生李斯特菌形成并改变其菌膜形状。然而,Tajik等[105]结合扎塔利亚多花波斯精油和紫外线照射模拟工厂环境下共同作用时却发现,共同作用情况下单核细胞增生李斯特菌菌膜去除能力更弱,这可能是由于精油本身的强抗氧化性以及具有吸收紫外线的物质削弱了紫外线对单核细胞增生李斯特菌的杀灭,因此不建议将两者混合使用。
除此之外,两种生物措施的联合处理也具有更好的抑菌膜效果。Pu Chuanfen等[106]研究了不同温度下不同浓度的抗菌肽-几丁质膏体组合对单核细胞增生李斯特菌在冷冻鸡肉冻融水中的抑制菌膜效果较好。表面活性剂与鼠李糖脂组成的生物表面活性剂也对单核细胞增生李斯特菌菌膜的形成具有抑制的效果[107]。
联合处理的防控措施一定程度上可以有效去除单核细胞增生李斯特菌菌膜,然而并非所有联合处理都具有增效作用。因此选择合适的防控措施组合才能够更好地去除单核细胞增生李斯特菌菌膜。
4 结 语
本文首先对近5 年食品环境中采样获得的单核细胞增生李斯特菌菌膜形成能力进行了总结,发现采样获得的所有单核细胞增生李斯特菌都能够形成菌膜,然而其形成能力有所不同;其次,本文概述了单核细胞增生李斯特菌菌膜形成的内部因素和外部因素,并且发现两者之间存在相互作用,同时也发现不同因素下单核细胞增生李斯特菌菌膜的转移也各不相同;最后对单核细胞增生李斯特菌菌膜防控措施通过预防和控制两个方面进行阐述,其中控制措施中包括物理控制措施、化学控制措施、生物控制措施以及联合处理控制措施。
单核细胞增生李斯特菌作为食品中重要的食源性致病菌受到了广泛的关注和研究,在食品加工、运输、零售等环节中,单核细胞增生李斯特菌菌膜的存在无疑是降低交叉污染的一大挑战。针对于目前的单核细胞增生李斯特菌菌膜研究展望如下:1)单核细胞增生李斯特菌各菌株之间的菌膜形成具有变异性,不同菌株形成菌膜的能力各有不同。因此,只研究单一的单核细胞增生李斯特菌菌株菌膜特性并不能完全概括整体单核细胞增生李斯特菌的菌膜形成规律。所以,在研究中增加单核细胞增生李斯特菌的菌株数量有利于更好地了解单核细胞增生李斯特菌在不同因素下的菌膜形成和转移情况,由此给菌膜防控措施作理论参考;2)目前针对于单核细胞增生李斯特菌菌膜形成的测定方法各有不同,且彼此之间并无关联,除此之外,菌膜强弱评判标准也并未有统一的定论,不同的菌膜测定方法得出的数据不具有可比性,因此需统一菌膜强弱的评判标准以及建立起菌膜形成测定方法之间的关联;3)针对于单核细胞增生李斯特菌菌膜研究大多都处于实验室模拟阶段,然而,培养介质的不同往往影响单核细胞增生李斯特菌菌膜的形成量与结构特征。同时,在复杂的食品微生物环境中,单核细胞增生李斯特菌常与其他菌株共同存在,产生互相作用。因此模拟真实食品介质中单核细胞增生李斯特菌两菌或多菌菌膜的形成与转移更符合实际意义;4)目前关于单核细胞增生李斯特菌菌膜的防控措施目前已有较多研究,但是大多研究只能尽可能地抑制菌膜,能够完全清除菌膜又易于操作的方法鲜见报道。研究出一种更便捷更有效的防控措施是当前急需进一步探究的内容;5)不同因素下单核细胞增生李斯特菌菌膜形成量的研究已经开展,但是菌膜形成的机理及相关影响因素对菌膜作用的机制等尚不明确,因此,基于其相关的机理和机制的研究,有助于提升后续菌膜防控的高效性。

