桂西北峰丛洼地农作区土壤真菌多样性对不同耕作模式的响应
蔡芸霜,张建兵,*,钟丽雯,陆双龙,黄丽排,闫妍,罗为群,朱同彬,胡宝清
1 北部湾环境演变与资源利用教育部重点实验室, 南宁 530001 2 广西地表过程与智能模拟重点实验室, 南宁 530001 3 南宁师范大学 地理科学与规划学院, 南宁 530001 4 国土资源部岩溶生态系统与石漠化治理重点实验室, 桂林 541004
全球碳酸盐岩分布面积达陆地面积的12%,其中我国分布有344万km2,约占国土面积的1/3,我国西南更是全球三大碳酸盐岩连续分布区之一[1]。峰丛洼地是该区典型的喀斯特地貌类型之一,面积约9.7万km2[2]。在早期不合理人类活动的影响下,桂西北峰丛洼地区石漠化现象严重,导致当地土地生产力低、居民生活贫困[3]。从2000年开始,我国开始了大规模的石漠化治理工程,如封山育林、退耕还林还草、生态移民等,极大改善了该区的生态环境状况[4]。但在该区还分布着较大面积的农作区,是当地居民生活、生产(主要为耕作活动)的集中区,对土壤的干扰强度大,土壤流失与石漠化风险高,是峰丛洼地区生态演变热点区与生态保育的焦点区。因此,评价该区不同耕作模式的土壤安全效应,选择适宜的耕作模式,对降低该区石漠化风险,保持土地可持续利用及持久脱贫具有重要意义。
土壤安全是指土壤持续地为人类提供食物、纤维和淡水资源等生态系统服务,同时维持生物多样性和相对稳定性的一种状态[5-7],是土壤物理、化学、生物性质的综合反映。土壤微生物是地球化学循环中的主要驱动力,是土壤生态系统中最为活跃的部分,对生态系统的功能及其可持续性发挥着重要作用[8]。真菌作为土壤动植物残体的分解者、互助者或病原体,其通过调节土壤能量流动和养分转化、有机质积累、土壤结构形成、动植物残体分解和抑制病虫害等重要的土壤生态过程,在维持生态系统功能的基础和生态系统健康方面发挥重要功能[9-10]。同时,土壤真菌对环境变化敏感,地理空间变化[11]、生境改变[12]、耕作模式变更[13]、植被演替[14]等都将引起真菌群落结构与多样性的变化。因此,真菌群落与功能特征及其对外界环境变化的响应已成为评价土壤安全的重要指标之一[15-16]。
目前,耕作模式对土壤真菌影响的报道较多,大部分研究发现保护性耕作管理可增加微生物量的积累,改善土壤真菌特征[17-19]。关于耕作模式对喀斯特峰丛洼地土壤真菌影响的研究较少,该区已有研究主要集中在植被恢复的土壤,如刘雯雯等[20]对喀斯特区不同植被恢复阶段土壤真菌进行分析,发现乔木林、灌木林阶段土壤真菌群落结构相近,灌草过渡阶段与草本群落阶段真菌群落结构各成一类;Liang等[21]研究发现植被恢复过程中丛枝菌根真菌的多样性依次为灌木≈原生林≈次生林<草地,何敏红等[22]发现石漠化程度对真菌组成及多样性的影响大于植被演替的影响,随石漠化程度加深,土壤真菌多样性总体呈现下降趋势。因此,本文以典型峰丛洼地农作区—广西果化岩溶生态研究基地为研究区,采用高通量测序技术,对不同耕作模式土壤真菌群落多样性进行比较,并结合FUNGuild工具预测真菌功能,系统分析该区不同耕作模式对土壤真菌功能的影响,以期为该区土壤安全及农业生产的可持续性评价与管理提供科学依据。
1 材料与方法
1.1 研究区概况
广西果化岩溶生态研究基地建于2001年,现为国家自然资源部野外科学观测研究基地,位于广西平果县果化镇西南方向约5 km处(107°22′30″—107°24′47″E,23°22′30"—23°24′32″N)。该区地处南亚热带季风气候区,日照充足,年日照时数平均1682 h,日照百分率38%;气候温和湿润,年均气温21.5℃,无霜期345 d以上;雨量充沛,平均年降雨量1400—1550 mm。该区属典型的喀斯特峰丛洼地,地层主要为石炭系上统,岩石主要为纯石灰岩。土壤类型主要为棕色石灰土。
该基地属于典型的峰丛洼地农作区,人口密度高,耕作强度大。建设初期,该区植被覆盖率低(不足10%),石漠化程度严重、类型齐全,生态极度脆弱。在封山育林、坡地退耕还林还草、土地整理、水土保持等系列石漠化治理措施下,该区石漠化得到了较好的控制,现植被覆盖率已提高至75%左右,同时,洼地区和部分坡耕地得以继续耕作,种植作物除传统的玉米、甘蔗、水稻以外,还有引进作物火龙果。其多种模式的种植样地为本研究的开展提供了良好的野外试验平台。
1.2 研究方法
1.2.1样地选取
为评价研究区不同耕作措施对土壤真菌的影响,选择该区主要的农田类型(耕作模式)——火龙果地(相当于保护性耕作模式,HF)、玉米地(相当于翻耕模式,MF)、甘蔗地(相当于少耕+秸秆还田耕作模式,SF)和水稻田(PF)为研究对象,并以退耕还林地(人工林,FL)、退耕还草(自然演替,AF)为对照样地,各样地情况介绍于表1。

表1 样地描述
1.2.2样品采集与处理
在2018年4月,利用土钻(钻头直径5 cm)采集不同耕作模式样地土壤样品,各模式选择典型样地至少3块,每块样地采用S形布点法采集5点样品,然后混合为该地块样品。采集土层为0—10 cm、10—20 cm、20—40 cm(退耕还草地仅有0—10 cm、10—20 cm)。共采集混合样品51个,每个样品一分为二,分别用于测试土壤微生物性质(装入样品袋后,速置于带冰块的保温箱中,然后带回保存于-80℃冰箱中)、土壤理化性质(装入样品袋带回自然风干待处理)。
1.2.3土壤理化性质的测定
将自然风干后的土壤样品,去除根系、砾石等杂质,按需磨碎过筛,然后分别采用酸度计法测定土壤pH 值(土水比1∶5,pH计S400-K,梅特勒-托利多国际贸易有限公司),K2Cr2O7氧化-外加热法测定土壤有机质含量,凯氏定氮法测定土壤全氮含量(全自动凯氏定氮仪K1100F,济南海能仪器股份有限公司),钼锑抗比色法测定土壤全磷含量(紫外可见分光光度计L9,上海仪电分析仪有限公司),马尔文激光粒度分析仪(Mastersize 2000,英国马尔文仪器有限公司)测定土壤粒度[23]。各耕作模式下的土壤理化性质如表2所示。按照国际制土壤质地分级标准,火龙果地的土壤质地属于壤质粘土,其他耕作模式土壤质地为粉砂质粘壤土。
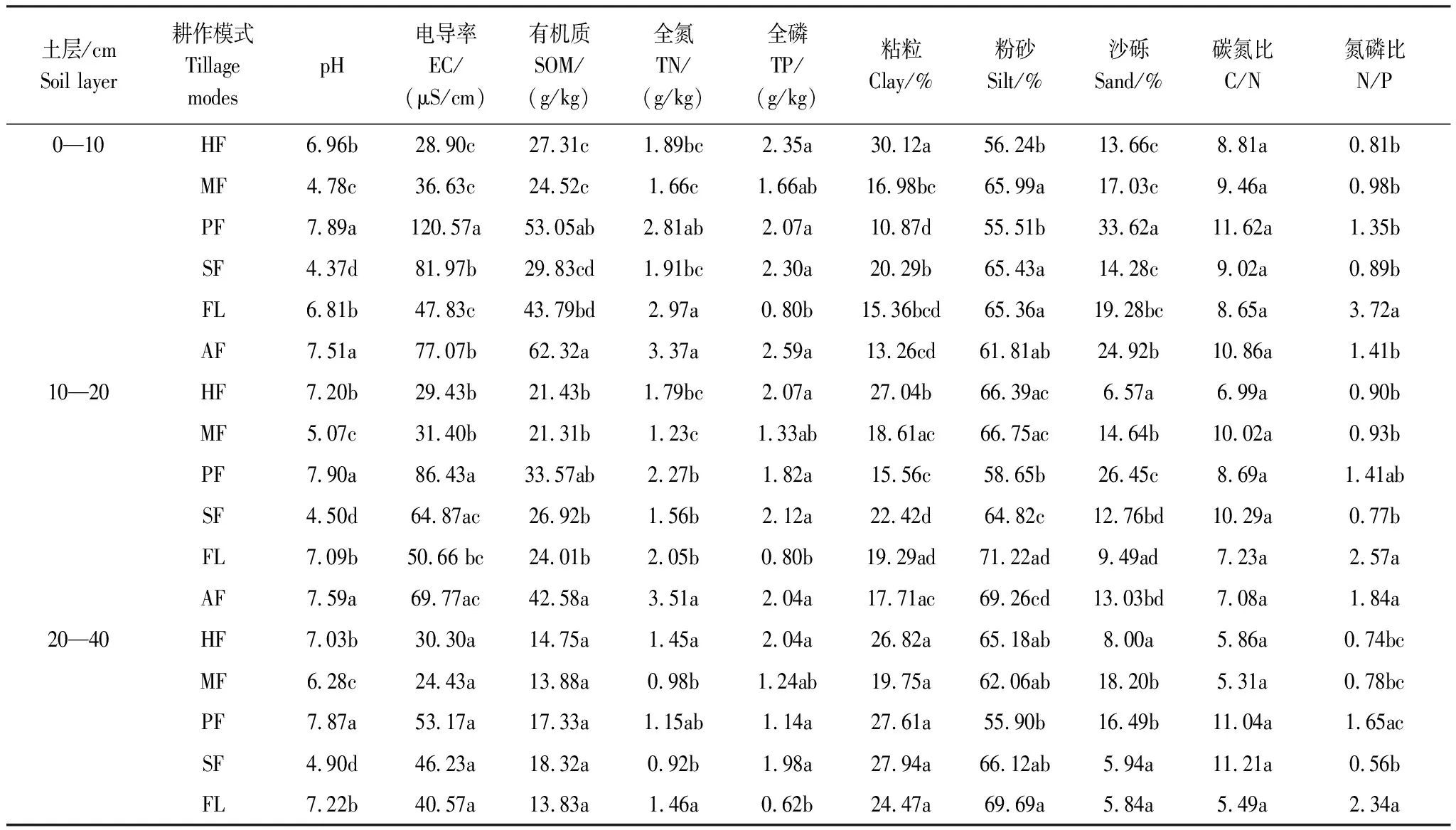
表2 不同耕作模式下的土壤理化性质特征
1.2.4样品DNA 提取、扩增和高通量测序
土壤样本DNA的提取采用CTAB标准法,DNA提取完成后利用浓度1%琼脂糖凝胶进行电泳检测其纯度和浓度。选择引物ITS5-1737F(5′-GGAAGTAAAAGTCGTAACAAGG-3′)和ITS2-2043R(5′-GCTGCGTTCTTCATCGATGC -3′)对土壤真菌ITS基因ITS1区进行PCR扩增。反应使用New England Biolabs公司的Phusion® High-Fidelity PCR和高效高保真酶进行PCR扩增,确保扩增效率和准确性。得到的产物使用2%浓度的琼脂糖凝胶进行电泳检测,对目的条带使用Qiagen公司提供的胶回收试剂盒回收产物。根据所扩增的ITS1区域特点,基于Illumina HiSeq测序平台,使用TruSeq® DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和Q-PCR定量,文库合格后,使用HiSeq2500 PE250进行上机测序(由诺禾致源生物信息科技有限公司完成)。
1.2.5数据处理与统计分析
原始测序数据经过严格的过滤处理,去除标签序列(barcode)、引物序列,过滤低质量和短长度的序列,得到高质量的Tags数据。运用Uparse软件(Uparse,Version 7.0.1001)对序列进行聚类,默认以97%的一致性(Identity)将序列聚类成为OTUs(Operational Taxonomic Units),用Mothur方法与SILVA的SSUrRNA数据库进行物种分类,在门类水平上统计各样本的真菌群落组成。使用Qiime软件(Quantitative Insights Into Microbial Ecology,Version 1.9.1)计算ACE指数、Shannon指数、Weighted Unifrac距离、构建UPGMA(Unweighted pair-group method with arithmetic means)样本聚类树等,ACE、Shannon指数箱型图使用Oringin(Version 2017)软件绘制,稀释曲线(Rarefaction Curve)、维恩图(Venn plot)、花瓣图(Flower plot)、主坐标分析(Principal Co-ordinates Analysis,PCoA)、典型关联分析(CanoicalCorrelation Analysis,CCA)、UPGMA聚类分析通过R软件(Version 2.15.3)完成。基于线性判别分析流程[Linear discriminant analysis (LDA) effect size pipeline,LEfSe],使用LEfSe软件分析,默认设置LDA Score的筛选值为3.5,分析分组样本间具有显著差异的Biomarker。真菌群落功能预测使用FUNGuild(Fungi+Functional+Guild)工具,该方法基于已发表文献,对真菌的生态功能进行了归类,构建FunGuild数据库。土壤理化数据的统计分析和显著性检验选用SPSS 22.0软件。
2 结果与分析
2.1 土壤样品测序深度及合理性分析
真菌ITS基因测序结果显示,51个土壤样本共检测出4369767条序列,经过质量控制,总共得到4216941条高质量序列(每个土壤样品序列数在47866—97427之间,平均值=82685)。以97%的相似度将序列聚类成为OTUs,得到11702个OTU。为检测样本的数据量是否合理,从样品中随机抽取一定测序量的数据,统计它们所代表物种数目(即OTUs数目),以抽取的测序数据量与对应的物种数来构建稀释曲线(图1),稀释曲线表明,随着测序量的增加,稀释曲线逐渐趋于平坦,虽尚未达到饱和,但更多的测序量只会产生少量新的OTU,表明本次试验的测序数据量合理,测序结果包含了绝大多数真菌类群,能够较真实地反映研究区不同耕作模式土壤样品的真菌群落,可用于分析不同耕作模式对土壤真菌群落结构与组成的影响。
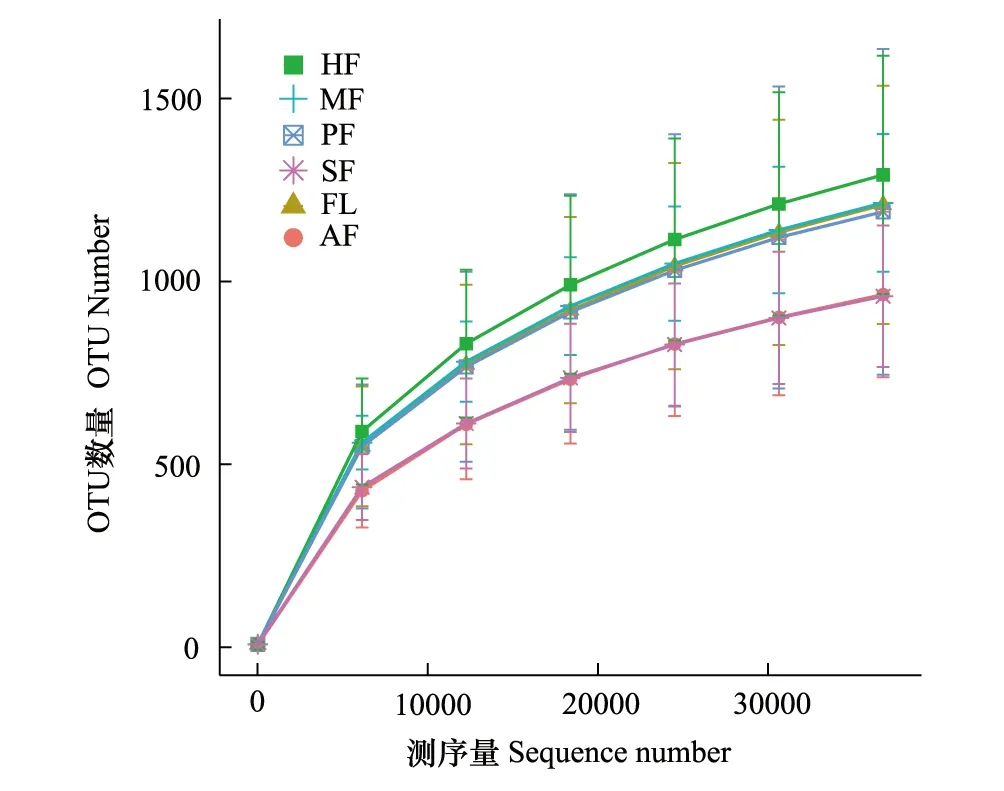
图1 不同耕作模式土壤真菌稀释曲线 Fig.1 Dilution curve of soil fungi under different tillage modesHF: 火龙果地 Pitaya field; MF:玉米地 Maize field; PF: 水稻田Paddy field; SF: 甘蔗地Sugarcane field; FL: 林地 Forestland; AF: 草地Grassland
2.2 土壤真菌α-多样性分析
2.2.1土壤真菌群落丰富度及多样性
微生物物种α-多样性用于分析样本内的微生物群落多样性,本文包括代表土壤真菌群落丰富度的ACE指数和体现菌群的多样性的Shannon指数。研究结果表明,各土层不同耕作模式土壤真菌丰富度和多样性无显著差异(P>0.05),20—40 cm土层土壤真菌多样性(P<0.05)除外。土壤真菌ACE指数与Shannon指数在0—10 cm、10—20 cm土层中的变化趋势较为一致,整体表现为HF、PF、MF、FL维持较高的土壤真菌丰富度及多样性,SF、AF土壤真菌丰富度及多样性较低;在20—40 cm土层,PF土壤真菌丰富度最低,而FL土壤真菌多样性指数最低。随着土壤深度增加,各耕作模式的土壤真菌ACE指数与Shannon指数均呈下降趋势(图2)。
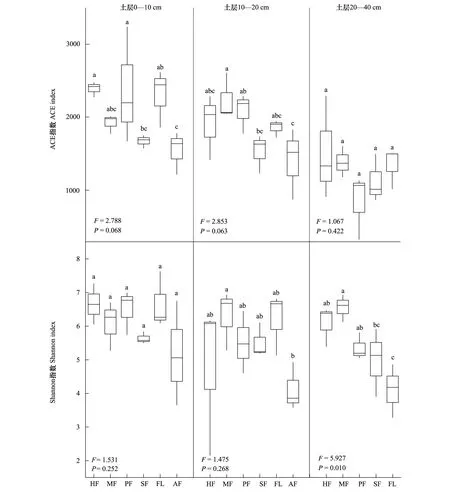
图2 土壤真菌ACE指数、Shannon指数箱型图Fig.2 Box plots of ACE index and Shannon index of the soil fungi不同小写字母表示差异性显著(P<0.05)
2.2.2土壤真菌群落组成分析
研究区土壤真菌ITS高通量测序所得序列经物种注释后分属18门、63纲、163目、370科、860属、1049种。在门类水平上,相对丰度排名前10的有Ascomycota(子囊菌门)、Basidiomycota(担子菌门)、Mortierellomycota(被孢霉门)、Rozellomycota(罗兹菌门)、Glomeromycota(球囊菌门)、Olpidiomycota(油壶菌门)、Mucoromycota(毛霉门)、Chytridiomycota(壶菌门)、Zoopagomycota(捕虫霉门)、Blastocladiomycota(芽枝霉门),其中前3者为优势菌门(相对丰度均>1%),3者相对丰度总和为25.93%—83.78%。SF的Ascomycota相对丰度(69.877%—74.242%)明显高于其他耕作模式(9.312%—60.194%),同时PF的Ascomycota相对丰度(9.312%—20.598%)最低;FL的Basidiomycota相对丰度(11.864%—12.550%)比其他耕作模式(2.704—10.212%)高,除0—10 cm土层的HF(19.099%);SF、AF的Mortierellomycota相对丰度明显低于HF、MF、PF和FL;Rozellomycota在MF的相对丰度(0.646%—2.875%)最高;Glomeromycota在FL具有最高的相对丰度(0.848%—2.486%);PF的Olpidiomycota相对丰度(0.171%—1.804%)最高;Mucoromycota在HF具有最高的相对丰度(0.457%—1.379%);HF、PF、MF的Chytridiomycota相对丰度高于SF、FL、AF;Zoopagomycota、Blastocladiomycota在各耕作模式土壤的相对丰度无明显差异。各耕作模式土壤真菌群落组成中均存在相对丰度较高的目前数据库无法鉴定的真菌门。
随土层深度的增加,HF、SF的Ascomycota相对丰度表现为先增加后减少的趋势,MF、PF、FL则表现为先减少后增加的趋势,AF表现为增加的趋势;HF、MF、FL、AF的Basidiomycota表现为递减趋势,而PF表现为先减少后增加,SF则是先增加后减少的趋势;HF、PF、SF、AF的Mortierellomycota相对丰度随土壤深度增加逐渐减少,MF、FL表现为增加趋势(图3)。
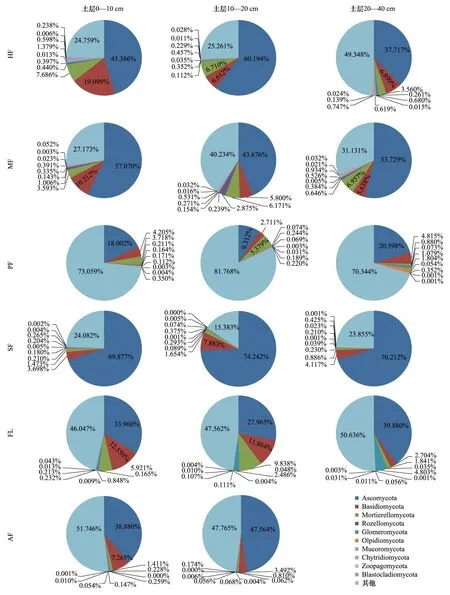
图3 土壤真菌群落在门类水平上的组成及相对丰度Fig.3 Composition and relative abundance of the taxonomic classes of soil fungi
2.2.3土壤真菌群落共有OTUs与特有OTUs
花瓣图和Venn图可直观展现并反映组间或样品之间OTU数量组成相似性、重叠情况以及特异性。在0—10 cm、10—20 cm、20—40 cm土层,各样地间土壤真菌群落共有OTU数量分别为300、275、194,占各层真菌总数比例分别为3.47%、3.35%、3.00%。
土壤真菌特有OTUs方面, PF在0—10 cm土层的土壤真菌特有OTUs(1050)最多,占真菌总数的12.15%,MF的土壤真菌特有OTUs比例最低(3.09%),其他耕作模式的土壤真菌特有OTUs占比在5.76%—7.53%之间;10—20 cm土层中,PF土壤真菌特有OTUs(958)最多,占真菌总数的11.68%,HF的土壤真菌特有OTUs比例最低(3.78%),其他耕作模式的土壤真菌特有OTUs比例在5.83%—7.81%之间;在20—40 cm土层,HF特有OTUs(914)的比例最高,为14.16%,其他耕作模式的土壤真菌特有OTUs的比例在9.79%—11.21%之间(图4)。

图4 不同土层土壤真菌群落共有OTUs及特有OTUsFig.4 Shared OTUs and specific OTUs of fungal communities in different soil layers
同一耕作模式不同土层间土壤真菌群落大体相似,共有OTUs数量大于各层特有OTUs数量,0—10 cm与10—20 cm土层间的共有OTUs数量大于0—10 cm与20—40 cm共有OTUs数量,并整体表现出表层拥有最大数量的OTUs总量与特有OTUs数量。HF、MF、PF、SF、FL、AF不同土层共有OTU数目分别为936、960、516、2829、964、1133,占各耕作模式全部OTUs数量的19.01%、22.19%、11.22%、22.30%、23.75%、41.19%(图5)。
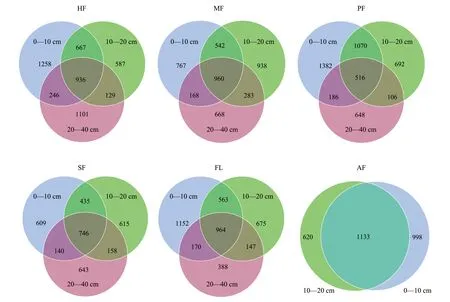
图5 同种耕作模式的不同土层间土壤真菌共有OTUs及特有OTUsFig.5 Total and specific OTUs of soil fungi between different soil layers under the same farming mode
2.3 土壤真菌β-多样性分析
2.3.1基于Weighted Unifrac距离的聚类分析
该区土壤样本真菌的聚类亲缘关系分析结果显示(图6),不同耕作模式、土层之间的土壤真菌群落结构具有一定的差异性。耕作模式方面,AF、FL为一簇,MF、SF、HF为一簇,PF单独成簇。土层之间,0—10 cm、10—20 cm土层土壤真菌群落相似性较高,与20—40 cm土层真菌群落相似度不高。
2.3.2土壤真菌LEfSe分析
各耕作模式具有不同数量和类型的显著差异物种(Biomarker),数量方面,FL(33)、SF(29)和 HF(28)具有较多的显著性差异物种,MF(16)、PF(12)、AF(4)最少;在门类水平上,不同耕作模式中,SF的显著差异真菌门为Ascomycota,PF为Olpidomycota,MF为Rozellomycota,HF为Mortierellomycota,FL为Glomeromycota,AF在门类水平无显著差异物种(图7)。
2.4 土壤真菌群落结构与土壤环境因子的CCA分析
分析结果可以看出,同种耕作模式的土壤样本能够清晰地聚集在一起,说明同一耕作模式生境相似,哺育了相似的真菌群落;其中FL、AF的样本距离比较接近,HF、MF、SF样本距离接近,与PF相距较远,说明FL、AF土壤真菌群落结构相近,HF、MF、SF土壤真菌群落结构相似;PF土壤真菌群落结构聚集为单独的一簇,与旱地系统差异明显,与β-多样性分析结果一致。轴1和轴2的特征值分别为15.78%和14.62%,共解释了30.40%的土壤真菌物种-环境关系,说明理化因子对土壤真菌群落结构有一定的影响。土壤pH、TN、N/P的射线较长,粒度(砂砾、粉砂、粘粒)含量、SOM、EC、TP、C/N的射线较短,表明pH、TN、N/P是影响土壤真菌群落的重要环境因素,其中pH是最主要的影响因子,土壤pH值与PF、FL、AF的真菌群落结构呈正相关,与HF、MF、SF土壤真菌群落结构呈负相关(图8)。

图8 OTU 水平上基于 Weighted Unifrac差异的CCA分析Fig.8 Weighted UniFrac distance-based CCA analysis at the OTU levelTN: 全氮 Totalnitrogen; TP:全磷 Total phosphorus;EC:电导率Electrical conductivity;SOM: 有机质Soil organicmatter
2.5 土壤真菌群落功能预测
研究区土壤真菌主要分为病理营养型、腐生营养型和共生营养型以及其他无法鉴定营养型的种群,将注释获得功能的 OTUs进行统计,无法鉴定营养型的种群占据土壤真菌成分的绝大部分,说明目前还缺少对这些土壤真菌功能的认识。在土壤真菌功能类群中,腐生营养型真菌比例最大,其次为病理营养型真菌,共生营养型真菌的比例最小。耕作模式对土壤功能类真菌影响明显,HF、MF、SF、PF土壤腐生营养型真菌、病理营养型真菌的含量显著高于FL、AF,说明耕作活动提高腐生营养型真菌含量的同时也刺激病理营养型真菌的生长;相对其他耕作模式,SF明显促进土壤腐生营养型真菌的生长。值得说明的是,各耕作模式中,HF明显提高共生营养型真菌数量,表明保护性耕作有利于共生营养型真菌的富集(图9)。
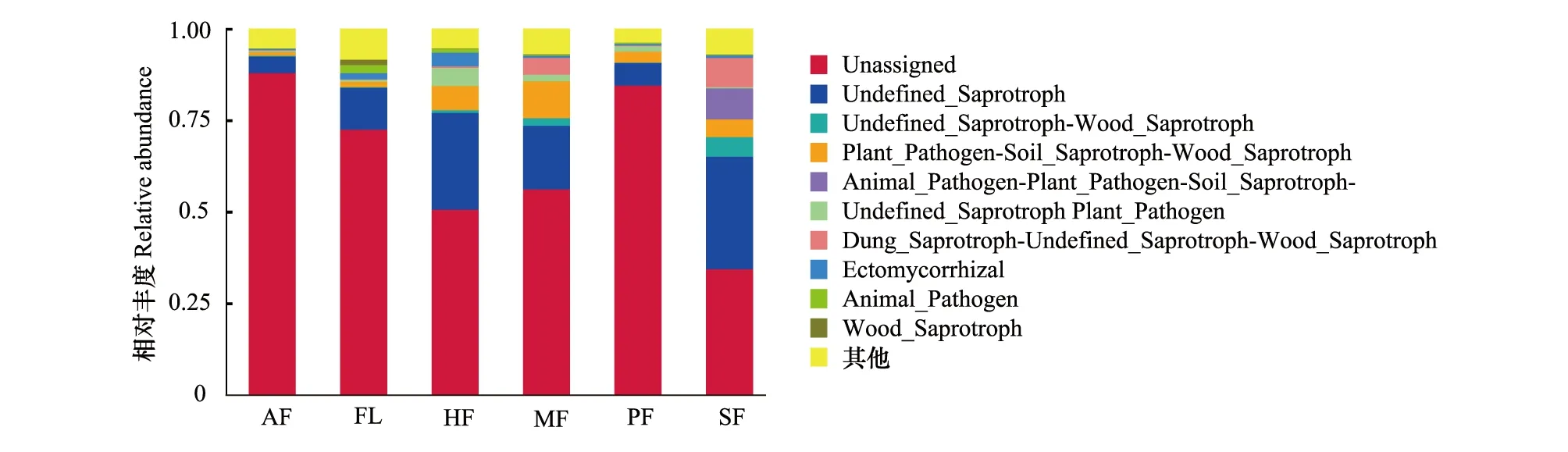
图9 不同耕作模式土壤真菌群落功能预测Fig.9 Functional predictions of the fungal communities in soils under different tillage modes
3 讨论
3.1 耕作模式对土壤真菌α-多样性的影响
本文对桂西北峰丛洼地土壤真菌多样性的研究结果表明,不同耕作模式下的土壤真菌ACE指数和Shannon指数整体表现为:HF、MF、PF、FL的土壤真菌丰富度和多样性明显提高,而SF、AF丰富度和多样性降低。其原因可能与石灰土质地粘重有关,因为石灰土的成土母质主要为碳酸盐岩风化溶蚀存留的酸不溶物,且多为粘土成分。而耕作活动可增加土壤通透性,利于土壤水、热和养分的迁移转化,从而利于土壤真菌的生存繁衍。随着土壤深度增加,各耕作模式下的土壤真菌的丰富度和多样性均有下降趋势。这主要是由于深层土壤缺乏通透性,其土壤温度、氧气、活性碳库等状况均变差,土壤真菌多样性也随之降低[24]。
各耕作模式所共有的OTUs数量大于各自特有的OTUs数量,表明耕作模式对土壤真菌群落产生影响,但整体上没有改变某一区域土壤真菌群落的主要构成。真菌群落组成分析显示Ascomycota、Basidiomycota、Mortierellomycota是研究区土壤的优势菌门,与喀斯特区的相关研究结果相似[25];这也表明耕作活动一般不会显著改变土壤优势真菌的种类,但会影响其相对丰度。
3.2 耕作模式对土壤真菌β-多样性的影响
通过对不同耕作模式下土壤真菌群落结构之间的相似性和差异性的分析,发现HF、MF、SF(旱作)土壤真菌结构相似,FL、AF(退耕)土壤真菌群落结构相似,均与PF(水田)土壤真菌群落结构差异明显,同时,随着土壤剖面深度增加,土壤真菌群落结构也存在差异。这是由于土壤水分、通气性、温度、养分等土壤真菌生存状况不同,导致土壤真菌丰度、组成存在差异,进而引起真菌群落结构存在差异。值得指出的是,尽管FL与AF土壤真菌α-多样性不相似,但β-多样性却接近,可见,α-多样性并不总是与β-多样性存在正相关[26]。
3.3 土壤理化性质对真菌群落结构的影响
土壤理化性质的变化会直接或间接地影响土壤微生物群落特征[27]。多数研究发现,土壤 pH是决定细菌群落变化的主要因素,而真菌群落结构通常与土壤养分含量密切相关[28-29]。然而,该区土壤真菌群落结构受土壤pH值影响最为明显。同时,TN、N/P对土壤真菌群落结构显著相关[30],有研究表明,当微生物氮的利用率过高时,会抑制N 吸收相关酶的活性,刺激P 吸收相关酶的活性[31-33],加剧土壤对磷的需求[34],说明土壤氮、磷可促进真菌物种之间的相互作用[35]。
3.4 耕作模式对土壤真菌群落功能的影响
从土壤微生物群落中的关键真菌功能类群来看,如果选择适宜的耕作措施,可以预防或减少植物根系病害的发生和危害,在保持土壤质量和健康方面可发挥至关重要的作用[36]。本研究结果显示,该区土壤中未鉴定营养型真菌含量较高,可见,这类真菌类群还无法依据现有研究结果进行区分,还缺少深入研究。该区土壤真菌功能类群中,腐生营养型真菌比例最大,其次为病理营养型真菌,共生营养型真菌的比例最小。耕作模式对土壤功能类真菌影响明显,HF、MF、SF、PF土壤腐生营养型真菌、病理营养型真菌的含量显著高于退耕模式(FL、AF),耕作活动在提高腐生营养型真菌含量的同时,也刺激病理营养型真菌的生长,说明耕作活动较为频繁的土壤容易造成腐生营养型真菌的富集,同时增加了从宿主细胞获取营养来源、对植物生长具有一定危害影响的病理型真菌[37]。SF 明显促进腐生营养型真菌的生长,这可能是田间填加秸秆作为有机肥的措施为腐生真菌的生长提供了营养。已有研究结果表明,共生营养型真菌可能在作物健康、营养和品质方面发挥重要作用[38]。值得说明的是,保护性耕作(HF)共生营养型的真菌类群最为丰富,共生营养真菌在作物健康、营养和品质方面发挥着重要作用,可降低农田病虫害风险,促进作物生长,提高产量与品质。因此,相对其他耕作活动来说,HF是对土壤健康和作物生长的较优处理方式。FUNGuild虽然在一定程度上解析了真菌的功能,但由于这种方法是基于已有文献和数据,具有一定的局限性,因此,依该方法确定的土壤真菌类群结构和功能群数据库仍有待进一步完善。
4 结论
农作区是喀斯特峰丛洼地区土地利用与生态环境变化的热点区域,生态风险高,耕作活动是引发该风险的导火线之一。本研究认为,不同耕作模式通过改变土壤性质与环境状况,改变了土壤真菌群落构成、丰度和功能。保护性耕作模式(HF)的土壤真菌多样性与群落结构具有与退耕模式相似的特征,且HF土壤共生营养型真菌最为丰富,能较好地维持土壤真菌群落结构特征和提高作物健康和品质,具有良好的生态环境效应。此外,本研究中保护性耕作模式的火龙果还具有较高的经济效益,因此,火龙果种植模式可作为峰丛洼地农作区生态、经济双提升的一种耕种模式。

