基于Illumina MiSeq测序技术对冰川棘豆(Oxytropis glacialis)不同组织内生菌多样性的研究
许国琪,刘怡萱,曹鹏熙,姬亚丽,李敬科,李小燕,刘 星,,*
1 张家口学院, 张家口 075000 2 西藏大学理学院, 拉萨 850000 3 西藏大学青藏高原生态学研究中心极端环境生物适应与进化实验室, 拉萨 850000 4 武汉大学生命科学学院, 武汉 430072
植物内生菌(Endophyte)广泛存在于植物体内,且大部分植物内生菌对植物有益,具有促生作用、降解有毒物质、抗逆境、抗动物摄食以及其他化感作用等[1-2]。在与宿主植物长期共存的过程中,内生菌与植物互为条件、相互选择,在宿主植物不同组织器官中形成相对稳定的微生态系统,发挥其相应的生态功能。植物内生菌在相关学科领域中影响不断扩大,特别是在医药方向和农业方向中植物内生菌资源调查与开发方面受到广泛关注[3-4]。而极端环境下植物内生菌经过植物和环境的双重选择,特殊的内生菌资源得以富集,并在植物组织中形成了其独特的生态位和对极端环境的适应能力,具有极高的研究价值[5-6]。青藏高原极端且多样的生态环境孕育了丰富的植物资源,也为植物内生菌的研究提供了宝贵的天然资源储备库[7-8]。目前,基于青藏高原高海拔、强辐射、寒冷气候等极端环境下对植物内生菌的相关研究已相继开展,如矮火绒草[9]、青稞[1]、紫花针茅[10]、西藏沙棘[11]等,但对于青藏高原草地有毒植物的内生菌多样性及其对极端环境的适应性研究却鲜有报道。
草地有毒植物的发生作为全球变暖与干旱大背景下生态演变的基本规律,但牲畜超载加速了这种演替的过程[12]。作为我国4大牧区之一,西藏畜牧业成为支柱产业的同时,也成为受有毒植物-疯草危害较严重的省区之一[13]。对冰川棘豆等疯草类植物的毒性来源分析表明,植物体内的致毒物质是由其植物内生真菌所产生的一种吲哚里西啶类生物碱苦马豆素(Swainsonine,SW),动物误食毒草后,作为一种高效的甘露糖苷酶竞争性抑制剂,致使相关组织器官的功能紊乱甚至丧失,表现出以慢性神经机能障碍为特征的中毒或死亡,严重威胁西藏畜牧业可持续发展[14]。但另一方面冰川棘豆在荒漠化草原、沙漠地区广泛分布,具有防风固沙的重要生态功能[14]。此外,由于冰川棘豆作为一种高营养价值[15]的潜在可利用的豆科牧草资源及其植物体内苦马豆素药用价值[16-17]的发现,冰川棘豆的综合防治与利用得到了广泛的关注。目前,围绕冰川棘豆植物微生物组的研究已从不同生态环境下内生细菌多样性[7]、内生菌互作网络[18]、根系微生物多样性[19]等角度开展,但以植物不同组织内生菌多样性为视角的相关研究尚未见报道。
本研究基于Illumina MiSeq测序技术对冰川棘豆不同组织中的内生菌进行研究,分析不同组织间内生菌菌群结构差异,探究内生菌菌群结构、功能差异及其与环境因子间的关系,从植物不同组织内生菌角度完善冰川棘豆微生物组研究,也为进一步挖掘冰川棘豆内生菌协同宿主植物适应极端环境的机制研究提供参考。
1 研究方法
1.1 区域概况及样品采集
本研究于2018年8月份对青藏高原高寒草原植被区[20]冰川棘豆生长旺盛期进行采样,共采集冰川棘豆根(10)、叶(11)组织21个样品。采样时将根部脱落土壤收集用于测定土壤理化性质,将根、叶组织分段置于无菌管中,暂存在-20 ℃车载冰箱(美固Mobicool,CF-50)。在超净工作台(苏净安泰,SW-CJ-1F)中将植物组织取出,按无菌水(30 s), 70%无菌乙醇(2 min),2.5% NaClO(含0.1% Tween80)(5 min), 70%无菌乙醇(30 s)进行表面无菌化处理,最后使用无菌水洗涤3次[21]。并将材料保存在新的无菌管中置于-80 ℃超低温冰箱(江苏盛蓝,DW86L-158)用于内生菌总DNA提取。
1.2 植物内生菌DNA提取与PCR扩增、测序
植物内生菌总DNA使用E.Z.N.A.® Soil DNA Kit试剂盒(Omega Bio-Tek, Inc.)提取,使用ABI GeneAmp® 9700型PCR仪进行DNA扩增实验。对细菌16S rRNA V5-V7区进行扩增[21],引物为799F(5′-AACMGGATTAGATACCCKG-3′)、1193R (5′-ACGTCATCCCCACCTTCC-3′)。20 μL体系: 5×FastPfu Buffer 4 μL,2.5 mmol/L dNTPs 2 μL,5 μmol/L正反引物各0.8 μL,2.5 U/μL FastPfu Polymerase 0.4 μL,BSA 0.2 μL,模板10 ng, ddH2O补至20 μL。PCR程序:95 ℃ 3 min; 第一轮扩增:95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,27次循环; 72 ℃ 10 min;第二轮扩增13次循环,扩增条件不变,10 ℃保温。对真菌ITS1区进行扩增[22],引物为ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)、ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)。20 μL体系:10× Buffer 2 μL,2.5 mmol/L dNTPs 2 μL,5 μmol/L正反引物各0.8 μL,5 U/μL rTaq Polymerase 0.2 μL,BSA 0.2 μL,模板10 ng,ddH2O补至20 μL。PCR程序:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s, 37次循环; 72 ℃ 10 min,10 ℃保温。对PCR产物纯度和浓度以及DNA完整性进行检测, PCR扩增及Illumina MiSeq测序工作由上海美吉公司完成,原始数据已上传至GenBank,项目登录号为PRJNA613354。
1.3 环境因子测定
使用GPS+北斗双星接收机(GARMIN,eTrex 209X)测定采样点经纬度和海拔地理位置信息,对土壤理化性质和大气环境中的13个环境因子进行测定, 6个环境因子对菌群结构或功能具有显著影响,用电位计法测定(HANNA,HI98103) 土壤pH值,用恒温干燥箱(上海精宏,DK-420S)烘干测定土壤含水量(Soil moisture,SM),使用托普云农TPJ-26-I-G测定采样点的空气相对湿度RH (Relative humidity)和露点DPT (Dew-point temperature)以及大气温度AT (Atmospheric temperature),土壤速效磷AP (Available P)用便携型土壤成分测定仪(北京优普通用,UPA-B506)测定。样品采集点信息见表1。
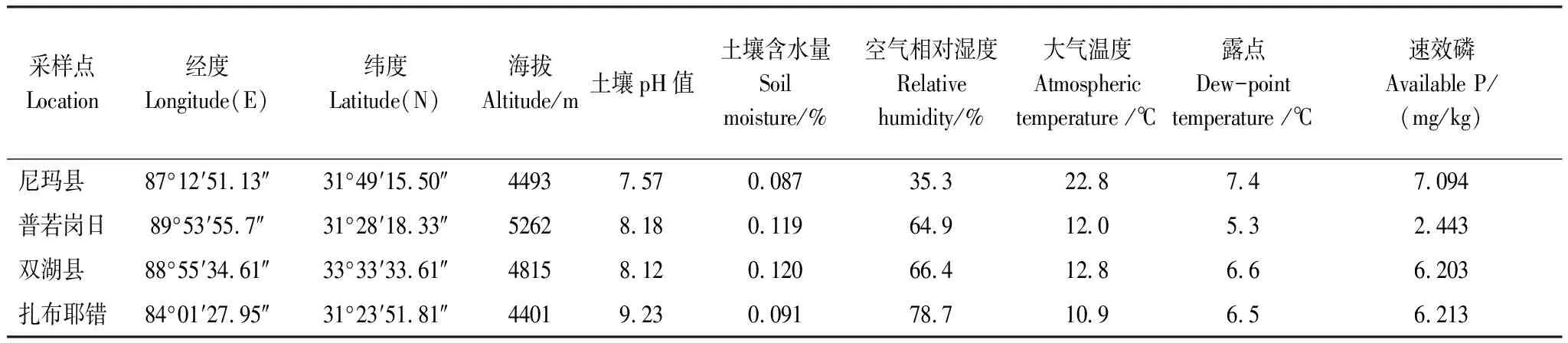
表1 样品采集点信息
1.4 数据分析
基于上海美吉生物I-Sanger云平台(https://www.i-sanger.com/)进行生物信息学分析。利用Flash 软件(version 1.2.7)对原始测序数据进行拼接, Trimmomatic软件(version 0.33)对拼接数据进行过滤,基于Silva (Release128,http://www.arb_silva.de) 和Unite (Release 7.2,http://unite.ut.ee/index.php) 数据库比对注释后,经Usearch软件 (version 7.0)以97%的序列相似度水平划分分类单元(operation taxonomic units,OTU)。Mothur软件 (version 1.30.1)计算Alpha多样性指数,R软件 (version 3.5.1)进行Alpha多样性指数组间T 检验差异分析。基于Qiime软件 (version 1.17)计算Beta多样性距离矩阵,综合ANOSIM组间差异检验结果,对样本进行NMDS非度量多维尺度分析。
LEfSe多级物种差异判别分析评价对样本差异产生显著性影响的菌群, LDA线性判别分析筛选出对组间差异有重要影响的菌群(LDA分值>2)[23]。VIF方差膨胀因子分析筛选出相互作用较小的因子(VIF值<10)进行CCA典型分析得到对菌群结构有显著影响的环境因子,并与多样性指数进行线性回归分析进一步筛选出显著影响多样性指数的环境因子,计算其与菌属之间的Spearman相关系数。
EggNOG数据库对内生细菌进行功能预测分析,比对获得内生细菌OTU对应的COG家族信息。FUNGuild[24]预测工具将内生真菌群落划分为病理营养型(pathotroph,PA)、共生营养型(symbiotroph,SY)、腐生营养型(saprotroph,SA)及其组合和未知类型(unknown,UN)共 8种功能营养类型。Wilcox秩和检验的组间显著性差异检验确定存在显著差异的菌群功能, Permanova置换多元方差分析评价环境因子对组织间内生菌差异功能的解释度,计算其与功能之间的Spearman相关系数。
2 结果与分析
2.1 冰川棘豆植物内生菌多样性分析
本次测序得到175791条内生细菌有效序列,注释到428个OTUs; 757113条内生真菌有效序列注释到391个OTUs;平均测序覆盖率分别达到99.88%和99.99%。
Alpha多样性分析中(表2),不同内生菌种类群落丰富度Chao指数(P=0.803、P=0.303)在分组间均无显著差异;而群落多样性Shannon指数在内生细菌中根小于叶但无显著差异(P=0.127),内生真菌中根大于叶且存在显著差异(P=0.015)。Beta多样性分析中基于ANOSIM组间差异检验下的NMDS分析表明(图1),组织间内生细菌菌群结构(R=0.164,P=0.043)和内生真菌菌群结构(R=0.294,P=0.004)均存在显著性差异,分组对内生细菌、真菌菌群结构的差异均具有一定的解释意义(stress=0.140、stress=0.153)。

表2 基于T检验(Student′s t test)的冰川棘豆内生菌菌群Alpha多样性指数分析
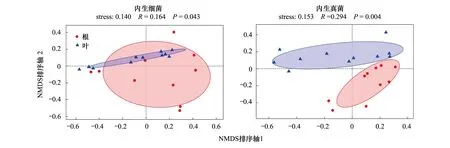
图1 冰川棘豆内生菌菌群Beta多样性分析Fig.1 Beta diversity analysis of endophyte in Oxytropis glacialis
2.2 冰川棘豆植物内生菌组成分析和差异分析
428个内生细菌OTUs比对到19个门和267个属。在门分类水平上(图2),变形菌门(Proteobacteria)在根和叶样本中占主要优势(58.87%、76.65%),放线菌门(Actinobacteria) (6.95%、8.42%)和拟杆菌门(Bacteroidetes) (3.68%、11.50%)以及其他菌门(0.14%、0.42%)的相对丰度占比在叶样本中均高于根样本,根样本中仅有厚壁菌门(Firmicutes) (30.36%、3.02%)相对丰度占比要高于叶样本。在属分类水平上,根样本中有194个菌属,Lachnoclostridium5(20.84%)、假单胞菌属(Pseudomonas,18.99%)和泛菌属(Pantoea,9.04%)等8个菌属相对丰度占比大于3%,其他菌属占比为17.83%;叶样本中有199个菌属,假单胞菌属(30.66%)、代尔夫特菌属(Delftia,12.59%)、丛毛单胞菌(Comamonas,7.61%)等10个菌属相对丰度占比大于3%,其他菌属占比为21.53%。根和叶样本中126个共有菌属,占内生细菌所有种类的47.19%,占菌群总丰度的97.54%。
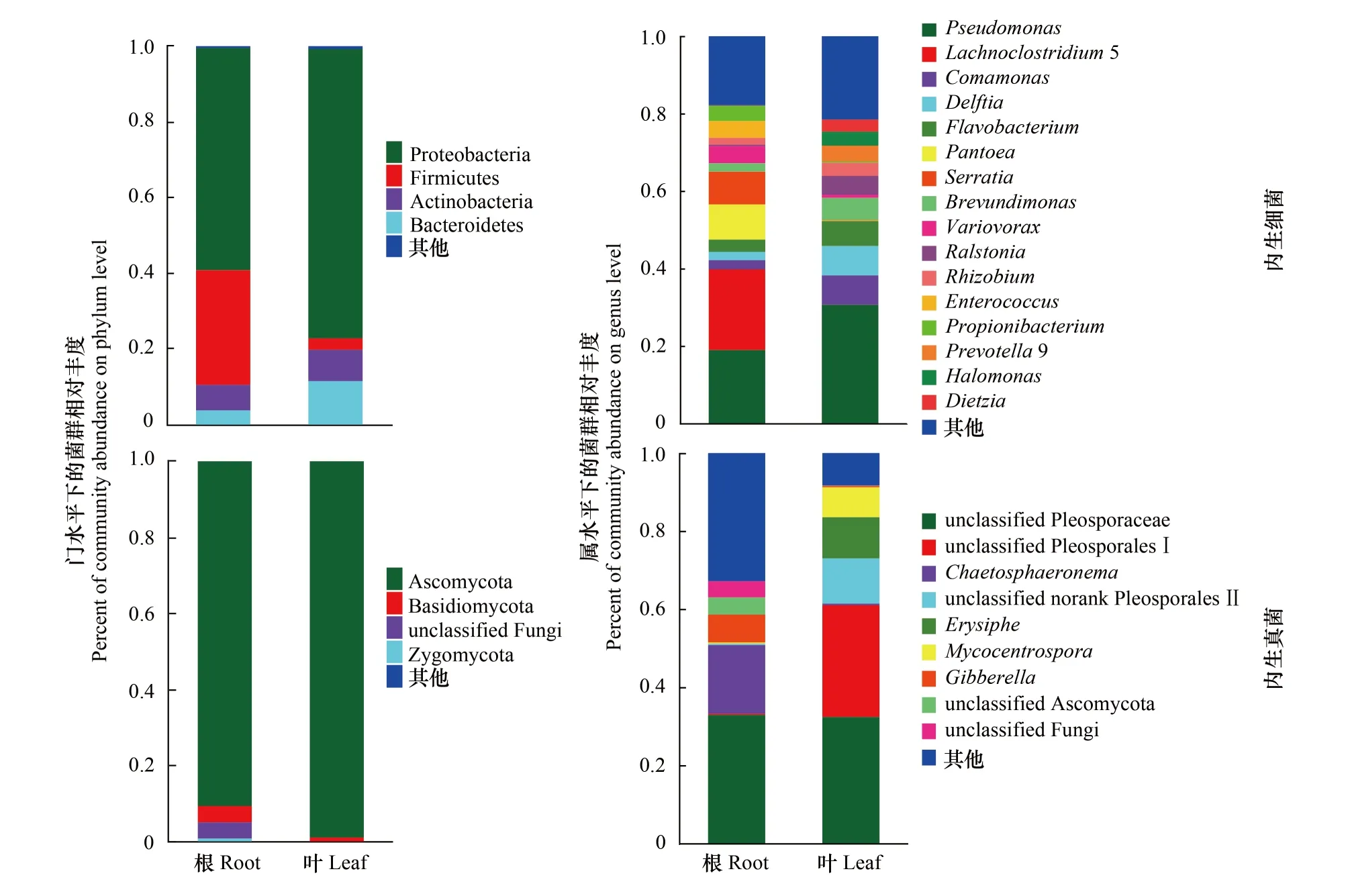
图2 基于门和属水平的内生菌群落结构分析Fig.2 Microbial community structure analysis of endophyte based on genus and phylum level
391个内生真菌OTUs比对到7个门和149个属。在门水平上(图2),子囊菌门(Ascomycota)在根和叶组织中均占主要优势(90.36%、98.83%)且相对占比在叶样本中高于根样本,而其他菌门包括担子菌门(Basidiomycota) (4.29%、1.11%)、接合菌门(Zygomycota) (1.12%、0.01%)和未知真菌(4.15%、0.05%)的相对占比在根样本中均高于叶样本。从属分类水平来看,根样本中有117个菌属,格孢腔菌科未知属(unclassified Pleosporaceae,32.95%)、Chaetosphaeronema(17.57%)以及赤霉菌属(Gibberella,7.13%)等5个菌属相对丰度占比大于3%,其他菌属占比为32.83%;叶样本中有76个菌属,格孢腔菌科未知属(32.44%)、格孢腔菌目未分类属Ⅰ(unclassified Pleosporales Ⅰ,28.58%) 、格孢腔菌目未分类属Ⅱ(unclassified norank Pleosporales Ⅱ,11.59%)等5个菌属相对丰度占比大于3%,其他菌属占比为8.31%。根和叶样本中44个共有菌属,占内生真菌全部种类的29.53%,占菌群总丰度的91.54%。
LEfSe多级物种层级分析显示(图3),内生细菌中拟杆菌门在叶样本中具有相对优势,内生真菌中子囊菌门在叶样本中占相对优势,担子菌门、接合菌门、未知菌门在根样本中占相对优势。从属水平来看,内生细菌在根样本中具有相对优势的有2个菌属,而叶样本则有14个菌属占相对优势;内生真菌中9个菌属在根中占相对优势,5个菌属在叶中具有相对优势。LDA线性判别分析表明(图3),内生细菌中鞘脂单胞菌目未分类属(norank Sphingomonadales)、生丝微菌属(Hyphomicrobium) 、芽孢杆菌属(Bacillus)等15个菌属对不同组织间差异具有显著影响,内生真菌中Chaetosphaeronema、子囊菌门未分类属、格孢腔菌目未分类属Ⅰ等14个菌属对样本间差异具有显著影响。
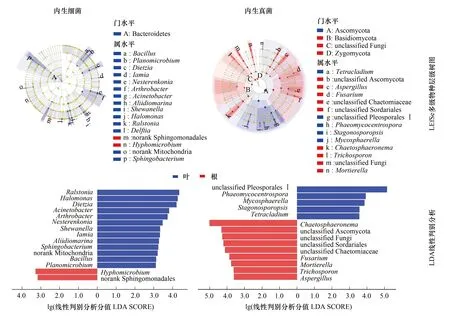
图3 冰川棘豆内生菌菌群差异分析Fig.3 Microbial community difference analysis of endophyte in Oxytropis glacialis LEfSe多级物种层级树图由内至外的圈层表示菌群从门至属的分类级别,节点圆圈直径大小与相对丰度大小呈正比,黄色节点表示样本间无显著差异的菌群,红色与蓝色节点表示样本间存在显著差异的菌群,其中红色节点表示菌群在根组织中具有相对优势,蓝色节点表示菌群在叶组织中具有相对优势
2.3 环境因子对植物内生菌菌群结构的影响
方差膨胀因子VIF分析筛选相互作用较小的环境因子,结果表明仅有pH(VIF=1.00)、SM(VIF=1.00)到达分析要求(VIF<10)。CCA典型分析和线性回归分析表明(图4),组织间内生细菌菌群结构受pH (R2=0.669,P=0.001)、SM(R2=0.684,P=0.001)的显著影响,pH (R2=0.074,P=0.233)对组间Beta多样性的影响不显著,组间Beta多样性主要受到SM(R2=0.241,P=0.024)影响。内生真菌中pH (R2=0.771,P=0.001)、SM(R2=0.762,P=0.001) 对不同组织间菌群结构的差异具有显著性影响,其中SM (R2=0.223,P=0.031)显著影响组间Beta多样性,pH (R2=0.571,P<0.001)对于Chao指数影响显著,但上述环境因子对组间内生真菌中存在显著差异的Shannon指数解释并不显著(P>0.05)。
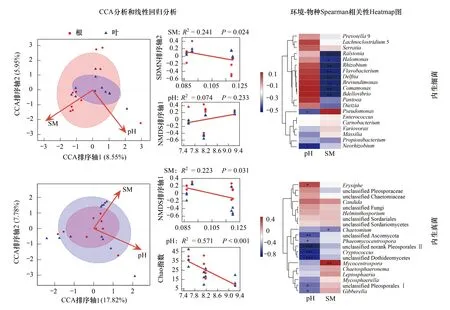
图4 环境因子对冰川棘豆内生菌菌群结构的影响Fig.4 Effect of environmental factors on the microbial community structure of endophyte in Oxytropis glacialis* 0.01 对上述具有显著性影响的环境因子与丰度前20的菌属进行相关性分析表明(图4), 50%的优势菌属受环境显著影响。从内生细菌来看,pH与假单胞菌属、新根瘤菌属(Neorhizobium)呈显著负相关关系,而劳尔氏菌属(Ralstonia)、盐单胞菌属(Halomonas)、根瘤菌属(Rhizobium)等8个菌属与SM呈显著的负相关关系。从内生真菌来看,pH与白粉菌属 (Erysiphe) 呈显著正相关关系,与子囊菌门未分类属、Phaeomycocentrospora、格孢腔菌目未分类属Ⅱ等7个菌属呈显著负相关关系,SM与菌刺孢属(Mycocentrospora)呈显著正相关关系,与毛壳菌属(Chaetomium)呈显著负相关关系。 通过比对EggNOG数据库得到24种COG功能,组织间COG功能组成分析显示(图5),根组织中排名前10的COG功能依次为未知功能(S)、氨基酸运输与代谢(E)、一般功能预测(R)、转录(K)、糖类运输与代谢(G)、无机离子运输与代谢(P)、能量产生与转换(C)、细胞壁、膜、囊膜生物起源(M)、信号转导机制(T)以及翻译、核糖体结构和生物起源(J),叶组织中S>E>R>K>P>C>M>T>G>J。此外,在冰川棘豆根(2.10%)和叶(2.39%)组织中次生代谢产物生物合成、分解代谢(Q) 相关基因均有表达。对全部COG功能进行组间显著性差异检验结果表明(图5),G、M、转录后修饰、蛋白转运、分子伴侣(O)在组织间存在显著性差异。Permanova置换多元方差分析结果表明,无环境因子对组织间内生细菌差异功能具有显著的解释意义。其中显著影响菌群结构的土壤pH值和土壤含水量对不同组织中内生细菌功能结构均无显著性影响(图5)。 FUNGuild分析显示(图5),内生真菌营养模式 UN (33.74%、43.86%)在冰川棘豆根和叶组织中均占比最大, PA-SA(33.23%)、PA(12.35%)和PA-SA-SY(11.58%)在根组织中占比较大,而叶组织中PA-SA(32.80)、PA(20.42%)占优势。对全部营养型进行组间显著性差异检验结果表明(图5),PA-SA-SY、SA-SY在不同组织间具有显著性差异(P<0.05)。Permanova置换多元方差分析表明,AL(R2=0.140,P=0.044)、RH(R2=0.159, P=0.021)、AT(R2=0.180,P=0.014)、AP(R2=0.204,P=0.003)、DPT(R2=0.229,P=0.004)对营养模式结构具有显著影响。对上述显著影响功能结构的环境因子与各营养模式进行相关性分析表明(图5),PA与AL(R=0.659,P=0.023)和RH(R=-0.581,P=0.046)呈显著正相关关系,PA-SA与AT(R=-0.700,P=0.017)、AP(R=-0.600,P=0.040)、DPT(R=-0.600,P=0.040)呈显著负相关关系,但上述环境因子对组织间存在显著差异的营养类型影响并不显著。 植物体在自然界的实际生存状态被认为是微生物和植物相互依存的状态[25],植物内生菌在这一过程中形成了自身独特的宿主保守性和地域特异性以及组织专一性等适应性特点,本研究主要从组织专一性角度对冰川棘豆内生菌多样性进行探讨。从组织间内生菌多样性来看,已有研究表明植物组织间内生菌多样性结构随植物不同并不具有一致性[26]。本研究中,冰川棘豆根部内生细菌群落多样性小于叶但差异并不明显,而根部的内生真菌群落多样性显著大于叶。这与水稻和翅碱蓬的研究相似,水稻叶组织中内生细菌的群落多样性最丰富[27],而翅碱蓬根中内生真菌群落多样性要远远超过茎和叶[28]。这可能与植物内生菌的来源密切相关,目前普遍认为内生菌主要来源于土壤,土壤中微生物在进入根系后,随着蒸腾作用沿着维管束向叶部迁移。但由于组织间的生理特性不同,内生真菌对根部的侵染程度较地上部分要强[29],导致根部内生真菌群落多样性显著高于其他组织,而叶中除来自根部的内生细菌传递外还存在空气等其他途径为微生物进入植物体内提供可能[27],因此表现出较高的群落多样性。从内生菌群落组成来看,与其他植物内生菌研究结果相一致,冰川棘豆不同组织内生细菌的优势菌门为变形菌门[9],内生真菌的优势菌门为子囊菌门[25],这与其他植物内生菌在门水平上的研究结果相一致存在普遍共性。属水平下,不同组织中共有菌属丰度占比达90%以上,可能提示共有菌属作为基础菌群发挥重要作用,如对假单胞菌属的研究中发现,该属的许多菌株可以分泌吲哚乙酸或赤霉素以及多种不同的抗生素,能有效促进植物的生长和抑制多种病原菌活性以及显著提高植物的抗病性[30-31]。而差异性菌属可能表现出菌属相应功能的强弱或在组织间特异性生理活动中发挥作用,如叶组织中占优势的内生真菌格孢腔菌目菌属作为深色有隔内生真菌(Dark septate endophytes,DSE)的常见菌属,被认为能提高宿主抗病虫能力及在干旱、寒冷的高海拔胁迫环境中的抗逆性[32]。根组织中差异性的内生细菌生丝微菌属,被报道能产生吡咯喹啉醌以提高其他细菌对毒性和辐射等极端条件的耐受性[33]。 除植物组织生理特性差异的影响外,外部环境条件的改变成为驱动植物组织间内生菌群落结构差异的一个关键因素[34-35]。本研究中冰川棘豆不同组织的内生菌菌群结构受土壤pH和土壤含水量的显著影响,其中土壤pH对组织间内生真菌的Alpha多样性丰富度有显著影响,而土壤含水量对内生细菌和内生真菌的Beta多样性影响显著。与醉马草研究中发现土壤有机质显著影响组织间内生菌多样性的结论不同,土壤有机质等对冰川棘豆内生菌无显著性影响,这可能与宿主植物的特性有关,冰川棘豆通过高效利用土壤有机质适应贫瘠土壤,这为其植物体内的内生菌提供了一个稳定的生存环境,避免受土壤有机质的显著影响,实现对贫瘠土壤环境的适应。与差异性菌群作用相似,受环境影响的内生菌可能通过丰度的改变帮助冰川棘豆在变化或多样的生态环境中适应和扩散。如盐单胞菌属作为耐盐细菌和具有固氮功能的根瘤菌属与土壤含水量呈现显著性的负相关关系,这可能有助于冰川棘豆在干旱胁迫下对盐碱环境的适应和固氮功能的实现。但同时也存在有使宿主致病,抑制宿主的生长的部分病菌,如白粉菌属[36]和菌刺孢属[37]作为植物病原菌被报道,可能提示冰川棘豆在高土壤pH值和高土壤含水量的地区易发生相应的疾病。 植物内生菌因受植物保护而具有相对稳定的内环境,内生细菌通过与宿主植物之间发生基因横向转移,参与植物各种生命活动[38-39],而内生真菌在宿主内长期演化过程中,具备有在共生、寄生和腐生之间转换的生存策略以应对宿主植物的不同的生理状态,并在这种表型可塑性的过程中发挥其重要的生态作用[25,40-41]。本研究中,氨基酸运输与代谢(E)等在组织间保守性的相关基因为不同组织提供了基础性的保障,糖类运输与代谢(G)的相关基因在根组织中占比较为显著,这可能有助于冰川棘豆的根系不断扩展,而叶组织中与细胞过程相关的细胞壁、膜、囊膜生物起源(M)、转录后修饰、蛋白转运、分子伴侣(O)的占比较为显著,这可能是由于青藏高原高海拔、强辐射的生态环境对叶组织易造成损害,进而促使参与细胞过程相关的内生菌基因资源在叶组织中显著富集,帮助植抵御极端环境对叶组织的伤害。此外,次生代谢产物因其多样的生物活性被认为是内生菌发挥各种功能作用的物质基础[25,42],冰川棘豆不同组织中均存在一定比例的次生代谢产物生物合成、分解代谢(Q) 相关基因,这为内生细菌参与宿主植物代谢提供可能。就内生真菌而言,一方面可能由于FUNGuild数据库解析不全面[24],不同组织内生真菌营养模式中未知营养型占比最大,但同时也反映出冰川棘豆中存在大量未知的内生真菌资源有待发掘。基于生物多样性的保险效应理论,内生真菌多样的功能营养型可以为宿主植物在新的环境条件下承担更多功能的可能性就越高[43],冰川棘豆中不同的功能营养型将有助于宿主对外界环境的适应。而组织间差异的菌群功能为内生真菌在宿主植物不同组织中发挥特异性功能提供可能。综合环境因子分析来看,部分内生细菌的功能或内生真菌的营养型存在显著差异的原因可能是受本研究测定外的环境因子影响或与组织生理结构等其他因素有关。2.4 冰川棘豆内生菌菌群功能组成和环境因子对功能结构的影响

3 讨论

