非酿酒酵母菌的分离鉴定及产酯关键酶活性的研究
徐晓裕,万瑞琪,马延琴,葛正凯,李 甜,王 斌,史学伟*
(石河子大学 食品学院,新疆 石河子 832000)
不同种的酵母菌株用于葡萄酒的酿制,可能会使葡萄酒产生不同的感官品质[1]。在目前的葡萄酒行业中,非酿酒酵母在葡萄酒中的作用逐渐受到了酿酒师们的重视。因为它不但可以转换葡萄汁和其他含糖液体中的一部分糖类物质,还能通过自身代谢产生有益于葡萄酒的风味物质,从而提升葡萄酒的感官品质[2]。通常在发酵初始阶段,非酿酒酵母菌的生长较为旺盛,会产生一些影响葡萄酒酒体香气的重要成分。它们使葡萄酒拥有更加复杂的口感和香气。一般来说,非酿酒酵母菌与酿酒酵母(Saccharomyces cerevisiae)混合发酵的葡萄酒的酒体香气等方面都远远优于单一酿酒酵母菌发酵的葡萄酒[3-4]。
如果在酿造过程中,葡萄酒中的挥发性成分种类、含量以及平衡关系发生改变,那么酒体最后呈现的香气也会不同。其中,挥发性物质中最主要的是醇类物质和酯类物质[5]。然而,大部分的醇类物质与刺激性的气味有关,而酯类物质是葡萄酒中果香味的主要来源[6]。通常将葡萄酒中的酯类物质分为乙酸酯类和乙基酯类。在以往的研究中,关于乙酸酯的研究较多,因为它的生成量比乙基酯多,更易于分析研究[7]。醇类和乙酰辅酶A是醇乙酰基转移酶(alco hol acyltransferases,AAT)生成乙酸酯途径过程中的底物。AAT是一个巯基转移酶,能将供体上的基团转移到受体上,而这个供体就是乙酰辅酶A[8]。乙醇和高级醇都可作为AAT的底物[9]。而乙醇脱氢酶(alcohol dehydrogenase,ADH)的特异性则决定了醇可用于酯的形成。另外一条途径是乙酸和相应的醇类在酯酶的作用下合成乙酸酯。该反应是一个可逆反应,即酯酶既可以催化乙酸酯的合成,也可以催化乙酸酯的分解[10]。酯酶的存在形式有两种,它既可以以单体的形式存在,也可以以低聚物的形式存在。酯酶的主要作用是催化酯类的水解,从而调节葡萄酒中酸与酯的平衡[11]。
酯类物质一般是在ADH、AAT和酯酶的作用下形成的。目前对酿酒酵母的酶学特性研究较为成熟,而对非酿酒酵母中关于酯生成关键酶活性的研究鲜见报道。因此,本研究通过从来自新疆维吾尔自治区昌吉回族自治州玛纳斯中信国安的葡萄表皮分离筛选非酿酒酵母,并对代表菌株进行分子生物学鉴定,最后,分析不同非酿酒酵母产酯含量及体内ADH、AAT和乙酸酯水解酶的活性,有助于分析解释非酿酒酵母代谢酯类物质的差异性,为以后能更高效率的分离筛选出能产香的非酿酒酵母奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 原料及菌种
在玛纳斯中信国安的葡萄园中,用五点取样法在不同葡萄种植地中采取不同品种(克里木波西(K)、巴柯(B)、红巴克特(HB)、爱费立奥(AF)、希姆劳特(XM)、赫尔松(HE)、曼道万卡(MD)、赤霞珠(C)、美乐(ML)以及西拉(XL))的葡萄样品。在采集过程中,要避免人为的污染,将采集的葡萄样品先装入无菌的保鲜袋之后再贴标,在24 h以内送往实验室储存,4 ℃条件下保存。
酿酒酵母(Saccharomyces cerevisiae)Sc288:上海杰兔工贸有限公司。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基[12]:葡萄糖20 g/L,酵母浸粉10 g/L,蛋白胨20 g/L,121 ℃高压蒸汽灭菌20 min。YPD培养基中添加琼脂20 g/L。
WL营养琼脂培养基[13]:葡萄糖50 g/L,酵母浸粉5 g/L,蛋白胨5 g/L,琼脂20 g/L,氯化钙1.25 g/L,硫酸镁1.25 g/L,氯化钾4.25 g/L,氯化铁0.25 g/L,磷酸二氢钾5.5 g/L,硫酸锰0.25 g/L,溴甲酚绿0.44 g/L,pH 5.5,121 ℃高压蒸汽灭菌20 min。
液体发酵培养基[14]:MgSO4·7H2O 0.5 g/L,NH4NO33 g/L,吐温80 10 g/L,KH2PO44 g/L,酵母浸粉10 g/L,蛋白胨20 g/L,葡萄糖2.0 g/L。
1.1.3 试剂
真菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:北京博迈斯生物科技有限公司;5,5'二硫代双(2-硝基苯甲酸)(5,5'-dithio bis-(2-nitrobenzoic acid),DTNB)、DL-二硫苏糖醇(DL-dithiothreitol,DTT):上海麦克林生化科技有限公司;乙酰辅酶A(acetyl coenzyme A,acetyl-CoA):北京索莱宝科技有限公司;5-(6-)羧基荧光素二乙酸酯(5(6)-carboxyfluorescein diacetate,cFDA):北京索莱宝科技有限公司;2×Taq聚合酶链式反应(polymerase chain reaction,PCR)Master Mix、Ladder Marker、DNA扩增引物:上海生工生物技术有限公司。所用试剂均为分析纯或生化试剂。
1.2 仪器与设备
SPX-250B生化培养箱:常州诺基仪器有限公司;DYY-8CLHP电泳仪:北京六一生物科技有限公司;GelDOCXR凝胶成像系统:美国BioRad公司;CX21FS1光学显微镜:日本Olympus公司;B250恒温水浴锅:上海予卓仪器有限公司;X7酶标仪:美国伯腾仪器有限公司。
1.3 方法
1.3.1 菌株的分离纯化
取完整且不同品种的葡萄分别装于含有150 mL无菌水的锥形瓶中,在28 ℃、150 r/min条件下培养1 d,制成菌悬液[15]。之后取1 mL的菌悬液于9 mL的无菌水试管,摇匀,将其标为10-1稀释梯度,依次梯度稀释至10-7。每个梯度分别取100 μL的稀释菌悬液分别涂布于YPD培养基中,28 ℃条件下培养1 d[16]。将分离出的单菌落平板划线进行纯化。
1.3.2 菌株形态及表型鉴定
将分离纯化后的单个菌落接种到WL培养基上,在28 ℃条件下培养5 d,并结合NIKOLAOU E等[17]对酵母菌在WL培养基上的描述,对分离纯化的酵母菌进行初步分类。依据WL培养基的初步分类,将挑选出的每个表征形态的菌株在YPD培养基上划线培养,挑选单菌落进行形态观察。
1.3.3 代表菌株的分子生物学鉴定
根据真菌基因组DNA提取试剂盒的说明书提取代表菌株的DNA。采用引物NL1(5'-GCATATCAATAAGCGGAGGAAAAG-3')和NL4(5'-GGTCCGTGTTTCAAGACGG-3')对菌株进行PCR扩增[18]。PCR扩增体系:酵母菌DNA样品1μL,正向反向引物各1 μL,SuperMix 25 μL,双蒸水(ddH2O)补至50 μL,空白不加模板DNA。PCR扩增条件:95 ℃预变性5 min;55 ℃退火30 s,72 ℃延伸1.5 min,共循环35次;72 ℃再延伸3.5 min。将PCR扩增产物点样至1%琼脂糖凝胶电泳检测合格后,送至上海生工测序公司进行测序。将测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank核酸序列数据库中,通过基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对,获得同源酵母标准菌株的序列后,使用ClustalW程序将菌株序列进行对齐排列,采用软件MEGA-X中的邻接(neighbor-joining,NJ)法建立系统发育树[19]。
1.3.6 总酯含量的测定
将甘油保藏的菌株,按5%(V/V)的接种量接入10 mL YEPD培养基,28 ℃活化培养2 d;取2.5 mL接入50 mL YEPD培养基,于28 ℃、180 r/min条件下培养2 d;然后取10 mL接入到180 mL液体发酵培养基,于28 ℃、150 r/min条件下培养3 d。采用皂化中和法测定酵母菌的总酯含量[20]。
1.3.7 酶活力的测定
以商品酿酒酵母Sc288为对照,将产酯含量较高的酵母菌接入15 mL YEPD培养基中,于28 ℃、150 r/min条件下培养1 d;将培养后的酵母转接入200 mL YEPD培养基中,相同条件下培养1 d。取发酵液于8 000 r/min条件下离心15 min,收集细胞,并在磷酸盐缓冲溶液(phosphate buffer saline,PBS)(pH 7.4)中洗涤3次,最后再悬浮在PBS中,采用超声破碎机破碎细胞13 min。将菌体悬浮液在8 000 r/min条件下离心15 min,吸取上清液作为粗酶液。参照文献[21]测定ADH酶活力,参照文献[22-23]测定乙酸酯水解酶活性,参照文献[24-25]测定AAT酶活力。
1.3.8 数据处理
用MEGA-X软件建立系统发育树,在实验过程中每组实验平行做3次后取平均值,最终结果以“平均值±标准偏差”表示,同时用Origin 2019b软件进行实验图的绘制,用SPSS 23.0进行差异显著性分析。
2 结果与分析
2.1 分离酵母菌的及菌落形态
采用YPD培养基从不同品种的葡萄中共分离出72株酵母菌,编号为K1~K10、B1~B6、HB1~HB6、AF1~AF4、XM1~XM6、HE1~HE6、MD1~MD6、C1~C10、ML1~ML8、XL1~XL10。根据不同种类的酵母菌会在WL培养基上呈现不同的形态,采用WL培养基对酵母菌进行复筛,部分菌株的菌落形态见图1。
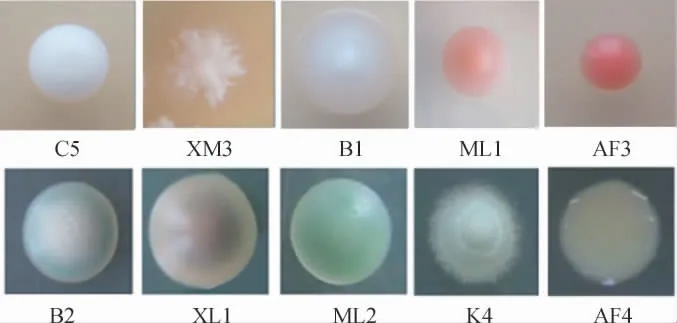
图1 WL培养基上部分酵母菌的菌落形态特征Fig.1 Colony morphology characteristic of some yeast strains on WL medium
根据菌落在WL培养基上不同的形态特征,按照CAVAZZA A等[17]方法对分离纯化的菌株进行分类描述,结果见表1。由表1可知,供试酵母在WL培养基上呈现不同颜色和培养类型,将其初步分为10类。

表1 分离酵母菌的菌落形态描述及分类Table 1 Colony morphology description and classification of isolated yeasts
2.2 分离酵母菌的显微形态
经过显微镜观察,可将菌株显微形态分为5类,挑取具有代表性的单菌落,在光学显微镜下观察显微结构(400×),结果见表2,具体描述及分类结果见图2。

图2 代表酵母菌的显微形态Fig.2 Microscopic morphology of representative yeasts

表2 分离菌株的显微形态描述及分类Table 2 Microscopic description and classification of isolated yeasts
由图2和表2可知,通过对分离菌株的细胞显微观察,供试菌株呈现圆形、椭圆、棒状和梭状,单端芽殖,均符合酵母菌的基本菌落形态特征。
2.3 酵母菌的分子生物学鉴定
从72株分离出的酵母菌株中挑选表型生长活性较好的33株代表菌株,基于26S rDNA D1/D2区域基因序列构建系统发育树,结果见图3,鉴定结果见表3。

图3 基于26S rDNA基因序列33株酵母菌株的系统发育树Fig.3 Phylogenetic trees of 33 yeast strains based on 26S rDNA gene sequences
由图3及表3可知,33株代表菌株被鉴定为11个属共13个种,包括红酵母属(Rhodotorula)、隐球酵母属(Cryptococcus)、酿酒酵母属(Saccharomyces)、有孢圆酵母属(Torulaspora)、克鲁维酵母属(Kluyveromyces)、有孢汉生酵母菌属(Hanseniaspora)、洛德酵母属(Lodderomyces)、梅奇酵母属(Metschnikowia)、棒孢酵母属(Clavispora)、毕赤酵母属(Pichia)和锁掷酵母属(Sporidiobolus)。
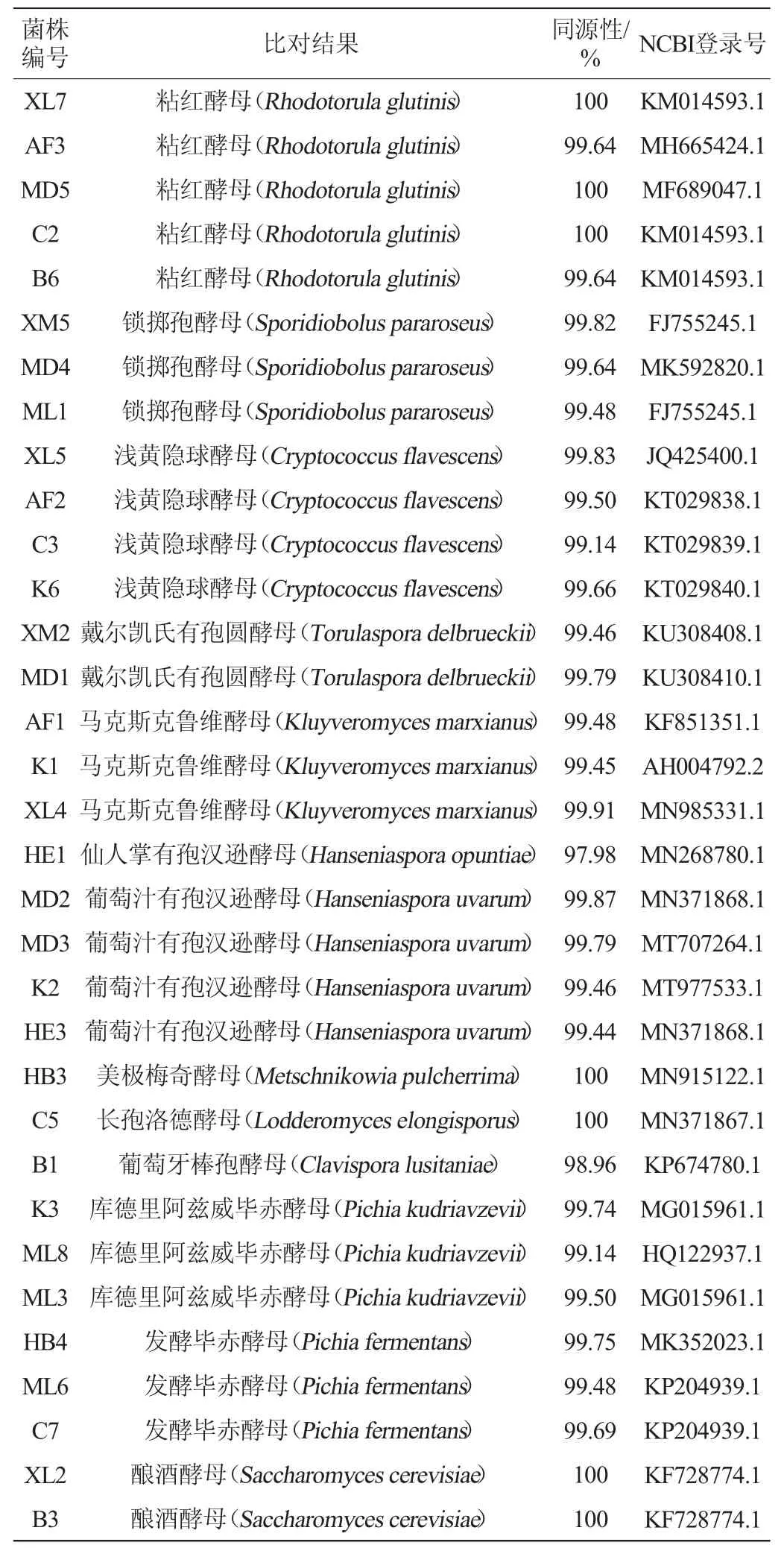
表3 33株酵母菌株的鉴定结果Table 3 Identification results of 33 yeast strains
2.4 非酿酒酵母种属占比分析
对不同非酿酒酵母在分离非酿酒酵母菌株所占比例进行分析,结果见图4。

图4 不同非酿酒酵母在分离非酿酒酵母菌株中所占的比例Fig.4 Proportion of different non-Saccharomyces cerevisiae in isolated non-Saccharomyces cerevisiae strains
本研究鉴定出31株非酿酒酵母酵母菌,其中Rhodotorula酵母有5株,占比16.13%;Sporidiobolus酵母有3株,占比为9.68%;Cryptococcus酵母有4株,占比12.9%;Torulaspora酵母有2株,占比为6.44%;Kluyveromyces酵母有3株,占比9.68%;Hanseniaspora酵母有5株,占比16.13%;Lodderomyces、Metschnikowia酵母以及Clavispora酵母各仅有1株,分别占比3.23%;Pichia酵母则有6株,占比19.35%。其中,Rhodotorula、Hanseniaspora以及Pichia含量较多,分别占16.13%、16.13%和19.35%,说明这三类酵母属为此葡萄产地非酿酒种属中的主要类别。
2.5 酵母菌的总酯产量
33株代表酵母菌以及一株商品酿酒酵母Sc288的总酯含量见表4。
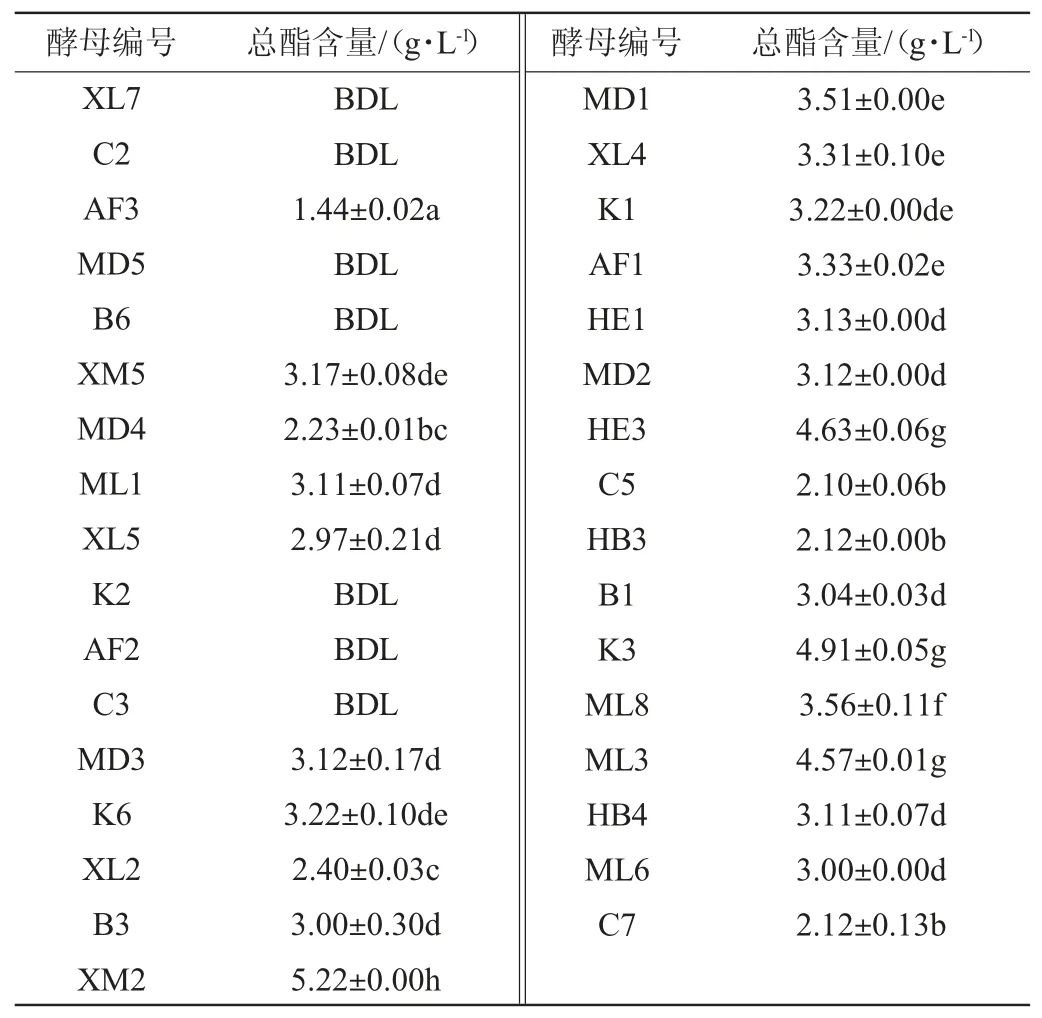
表4 33株代表酵母菌的总酯产量Table 4 Total ester yield of 33 typical yeast strains
由表4可知,33株酵母菌中除菌株XL7、C2、MD5、B6、K2、AF2及C3外,其余菌株的发酵液中均检测出了酯类物质,且60%的菌株酯类含量差异不显著(P>0.05)。不同菌株的总酯含量为1.44~5.22 g/L,其中商品酿酒酵母Sc288的酯类含量为4.04 g/L,选取比商品酿酒酵母Sc288产酯含量高的非酿酒酵母XM2(5.22 g/L)、K3(4.91 g/L)、HE3(4.63 g/L)和ML3(4.57 g/L)进行产酯关键酶的活性的研究。
2.6 关键酶活性的研究
2.6.1 非酿酒酵母菌株的ADH活性
不同底物的醇类(乙醇、正丁醇、苯乙醇、异戊醇)分别以烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)和烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADP)为辅因子进行ADH活性的测定,结果分别见表5和表6。

表5 以NAD为辅因子酵母菌株的乙醇脱氢酶活性Table 5 Activity of alcohol dehydrogenase of yeast strains with NAD as coenzyme U/mL
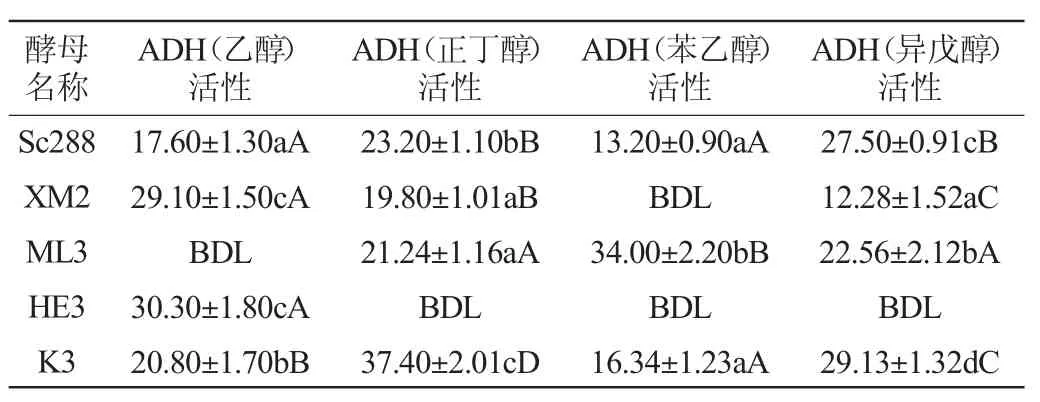
表6 以NADP为辅因子酵母菌株的乙醇脱氢酶活性Table 6 Activity of alcohol dehydrogenase of yeast strains with NADP as coenzyme U/mL
由表5及表6可知,以NAD为辅因子,乙醇为底物时,商品酿酒酵母Sc288的ADH活性[(2 138.03±326)U/mL]最高,且是以正丁醇为底物时[(179.66±11)U/mL]的11.9倍。以NAD为辅因子,以苯乙醇为底物时,仅有商业酿酒酵母Sc288有ADH活性[(34.26±3)U/mL],而以异戊醇为底物时,所有菌株均未检出ADH活性。与使用NAD作为辅因子的情况相比,NADP作为辅因子的ADH活性则更低。
关于菌株XM2,以NAD为辅因子,正丁醇为底物时,ADH活性是以乙醇作底物时的3.23倍,分别为(572.18±40)U/mL和(177.46±21)U/mL。与使用NAD作为辅因子的情况相比,NADP作为辅因子的ADH活性较低。以乙醇为底物时的ADH活性相对较高[(29.10±1.50)U/mL],而以苯乙醇为底物的ADH活性低于检测限。关于菌株ML3,以NAD为辅因子,乙醇为底物时,ADH活性是以正丁醇为底物时的1.65倍,分别为(937.45±88)U/mL和(567.87±28)U/mL。而以NADP作为辅因子,乙醇作为底物的酶活低于检测限度,以苯乙醇作为底物的ADH活性[(34±2.20)U/mL]高于以其他醇作为底物的ADH的活性。关于菌株HE3,以NAD为辅因子,乙醇为底物时,ADH活性是以丁醇作底物时的2.43倍,分别为(504.09±49)U/mL和(207.56±23)U/mL。以NADP作为辅因子的ADH活性在正丁醇、苯乙醇以及异戊醇中均未检测到,只有在乙醇中检测到,为(30.30±1.80)U/mL。关于菌株K3,以NAD为辅因子,乙醇为底物的ADH活性是以正丁醇为底物的2.12倍,分别为(1 078.44±126)U/mL和(504.15±40)U/mL。以NADP作为辅因子,正丁醇和异戊醇为底物时,ADH酶活较高,分别为(37.40±2.01)U/mL和(29.13±1.32)U/mL,其次是以乙醇以及苯乙醇,分别为(20.80±1.70)U/mL和(16.34±1.23)U/mL。
综合表4、表5及表6,未观察到ADH酶活性与相应的总酯含量之间的相关性。一般来说,ADH的酶活性受到酮酸的生成及其进一步脱羧为醛的限制[26-27]。因此可以预测,酵母菌在发酵培养基中生成的挥发性醇的供应不是酯类物质生产的限制步骤。
2.6.2 非酿酒酵母菌株的乙酸酯水解酶活性
由图5可知,乙酸酯水解酶活性最高的菌株为非酿酒酵母ML3,为14.3 U/mL,活性最低的是菌株XM2,为5 U/mL。结合表4分析可知,乙酸酯水解酶与酯类含量呈现负相关。值得注意的是,在研究中,乙酸酯水解酶活性是用5(6)-羧基二乙酸荧光素琥珀酰亚胺酯(5-(6)-carboxyfluorescein diacetate,succinimidyl ester,cFDA)法测定的,这为高通量荧光筛选并测定酵母菌株乙酸酯水解酶的活性以及确定酵母菌株生长历史对这一活性的影响提供了一种选择。

图5 酵母菌株乙酸酯酶活性Fig.5 Acetate esterase activity of yeast strains
2.6.3 非酿酒酵母菌株的AAT活性
由图6可知,AAT活性最高的是菌株XM2,为22.3 U/mL,活性最低的为菌株ML3,为9 U/mL。五种酵母菌的AAT活性从大到小依次为XM2>K3>HE3>Sc288>ML3。结合表4分析结果可知,AAT水解酶的活性与酵母菌总酯含量呈现出一定的正相关。但有研究表明,AAT的酶活性可能会受到乙酸酯水解酶活性的影响[28],故酵母菌AAT酶活的测定的方法还需要进一步的优化。
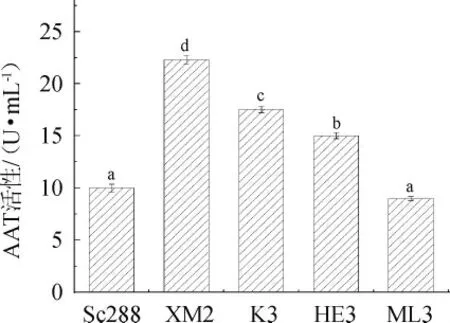
图6 酵母菌株的醇乙酰基转移酶活性Fig.6 Alcohol acyltransferases activity of yeast strains
通过对以上三个酶活性的测定分析,可以看出不同非酿酒酵母ADH酶活的差异性是较为明显的,且ADH酶的活性与酯的含量没有发现一定的相关性。以NAD为辅因子的酵母ADH酶的活性整体要高于以NADP为辅因子的ADH酶的活性。菌株ML3和K3的ADH活性均高于其他两株非酿酒酵母。乙酸酯水解酶活性与酯类含量呈现负相关,AAT酶活性与酯类含量呈现正相关,由此可以推测乙酸酯水解酶以及AAT对酯类物质的生成可能有极大地影响。对比乙酸酯水解酶的活性与AAT酶的活性可以发现,AAT酶的活性普遍比乙酸酯水解酶的活性要高,即推测AAT对酯类物质的生成的作用更明显。
3 结论
采用传统培养分离方法从新疆维吾尔自治区昌吉回族自治州玛纳斯中信国安所选酿酒葡萄表皮筛选得到72株酵母菌,结合形态观察及WL培养基鉴定,筛选出33株生长表型较好的酵母菌,经分子生物学鉴定,其中31株为非酿酒酵母,归属于10个属,分别为红酵母属(Rhodotorula)、隐球酵母属(Cryptococcus)、有孢圆酵母属(Torulaspora)、克鲁维酵母属(Kluyveromyces)、有孢汉生酵母菌属(Hanseniaspora)、洛德酵母属(Lodderomyces)、梅奇酵母属(Metschnikowia)、棒孢酵母属(Clavispora)、毕赤酵母属(Pichia)和锁掷酵母属(Sporidiobolus),且其中红酵母属(16.13%)、有孢汉生酵母菌属(16.13%)和毕赤酵母属(19.35%)为此地非酿酒酵母种属的主要类别。非酿酒酵母中TorulasporaXM2(5.22 g/L)、PichiaK3(4.91 g/L)、HanseniasporaHE3(4.63 g/L)和PichiaML3(4.57 g/L)总酯含量较高。通过对其产酯关键酶活性的测定推测乙酸酯水解酶以及AAT对酯类物质的生成可能有极大地影响。本研究为筛选优良的非酿酒酵母提供理论依据,为新疆本地开发具有明显地域特色的葡萄酒产品的提供帮助。

