乳酸菌混菌发酵制备豆清液多肽动力学模型的建立
尹乐斌,廖 聪,刘桠丽,何 平,李乐乐,杨爱莲,刘 丹
(1.邵阳学院 食品与化学工程学院,湖南 邵阳 422000;2.豆制品加工与安全控制湖南省重点实验室,湖南 邵阳 422000)
豆清液又称为黄浆水或大豆乳清(soybean whey),在酸沉大豆蛋白提取过程中,在等电点pH 4~5时,80%大豆蛋白沉淀成为豆腐的主要组成,而部分酸溶蛋白溶解于水中,并随着豆腐的压榨工艺被析出,成为豆清液[1]。豆清液蛋白大部分为大豆蛋白2S组分,含乳球蛋白、乳白蛋白、免疫球蛋白等,大豆乳清蛋白占大豆蛋白总量的6%~7%[2],由于蛋白质提取工艺的限制和大豆乳清蛋白的性质,豆清液中有较多营养物质未能得到有效利用。目前工厂对豆清液的处理仍多采取直接排放的方式,这不仅不符合环境保护要求,也是对资源的浪费,因此对豆清液进行高值化利用是目前的研究热点。为解决目前豆清液所存在的问题,陆洲等[3]利用植物乳杆菌发酵豆清液获取细菌素,尹乐斌等[4]利用豆清液制备乳酸饮料,王容等[5]利用豆清液制备酸汤类火锅调味品。通过微生物发酵食品加工副产物中的相关成分并降解抗营养因子是一项极具前景的食品加工副产物深加工技术。通过建立细胞生长、产物生成和基质消耗的发酵动力学模型,可深入了解产物形成机制,对发酵试验模拟放大、条件优化和自动化控制有重大意义[6-7]。ZHANG A H等[8]建立了包含菌体死亡、产物抑制、副产物抑制等因素的新动力学模型,用于分析丁酸梭菌(Clostridium butyricum)发酵甘油生产丙二醇的过程。关于发酵动力学的研究也可见于酒类发酵[9]、菜籽粕制备多肽[10]、小麦秸秆发酵生产抗氧化多糖[11]等。乳酸菌的蛋白水解系统可产生金属离子螯合、抗氧化、抗菌、降血压等功能肽,同时也可为自身的生长提供氨基酸[12-13]。利用微生物发酵豆清液制备多肽并开展应用研究大有潜力,然而目前鲜有关于利用乳酸菌发酵豆清液制备多肽并研究发酵体系中的代谢过程的文献报道。
本研究利用鼠李糖乳杆菌(Lactobacillus rhamnosus)、副干酪乳杆菌(Lactobacillus casei)、玉米乳杆菌(Lactobacilluszeae)三株乳酸菌对豆清液进行混菌发酵,以菌总量、还原糖含量、多肽含量为参数建立乳酸菌混菌发酵动力学模型,并测定发酵过程中豆清液的pH、蛋白酶酶活、钙螯合活力,为进一步放大试验及工业化生产豆清液多肽提供理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 原料和菌株
豆清液(蛋白质含量(2.36±0.05)g/100 mL,还原糖含量(1.36±0.03)g/100 mL):湖南省邵阳市豆制品加工基地豆清发酵液点浆豆腐时收集;鼠李糖乳杆菌(Lactobacillus rhamnosus)、玉米乳杆菌(Lactobacillus zeae)、副干酪乳杆菌(Lactobacillus casei):本实验室分离保藏。
1.1.2 化学试剂
谷胱甘肽(纯度≥99%):上海源叶生物科技公司;植酸酶(酶活50 U/mg):美国Sigma公司;无水氯化钙(分析纯):山东九重化工公司;3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)(分析纯):厦门海标科技有限公司;三氯乙酸、硼酸、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)(均为分析纯):上海阿拉丁生物科技公司;双缩脲蛋白定量试剂盒:北京雷根生物技术公司。
1.1.3 培养基
MRS培养基:广东环凯微生物科技公司。称取培养基干粉54 g加蒸馏水至1 000 mL,调pH至6.4,加入2.0%琼脂,121 ℃灭菌20 min。
1.2 仪器与设备
PHS-3C pH计:梅特勒-托利多(上海);DH-360恒温培养箱、101-1电热鼓风干燥箱:北京中兴伟业仪器公司;BA210恒温振荡器:苏州捷美电子公司;VELOCITY14R台式冷冻离心机:美国Dynamica Scientific 有限公司;UV-2006i紫外分光光度计:日本岛津公司;SX-4-10型马弗炉:天津泰斯特仪器公司。
1.3 方法
1.3.1 乳酸菌混菌发酵豆清液
种子液的制备:将甘油冻存管中的玉米乳杆菌(Lactobacillus zeae)、副干酪乳杆菌(Lactobacillus casei)、鼠李糖乳杆菌(Lactobacillus rhamnosus)接种至MRS培养基中37 ℃活化2代。将活化菌种转接至pH 6.4豆清液中37 ℃培养24 h,调整菌浓度为108CFU/mL,得到乳酸菌种子液。
乳酸菌混菌发酵:将新鲜豆清液置于烧杯中,添加400 U/L植酸酶酶解(pH 5.0,25 ℃)1 h,在前期摸索的基础上发酵,经高压蒸汽灭菌(115 ℃、15 min)冷却至40 ℃左右后将三株菌种按1∶1∶1的比例接种到加入含0.5%葡萄糖豆清液中,菌液添加量为豆清液体积的4.7%,初始pH值为6.4,温度为40 ℃[14],60 r/min摇床振荡发酵36 h。每隔2 h取豆清液样品,测定活菌数、多肽含量、还原糖含量、pH值,隔4 h测定酸性和中性蛋白酶酶活性。
1.3.2 生长曲线测定
采用稀释平板法计数。每2 h取豆清发酵液10倍稀释。将0.2 mL三个适当稀释倍数的乳酸菌悬浮液接种到MRS培养基中,在37 ℃恒温培养箱中培养48 h,然后进行菌落计数以绘制乳酸菌的生长曲线。
1.3.3 分析检测
(1)多肽含量测定
参考尹乐斌等[14]的方法并适当修改测定多肽含量。以0.5 mg/mL为梯度配制0~6 mg/mL谷胱甘肽标准溶液。标液与双缩脲试剂以1∶4体积比混合,室温反应0.5 h,波长540 nm处测吸光度值。以谷胱甘肽标准溶液的质量浓度(x)为横坐标,吸光度值(y)为纵坐标绘制谷胱甘肽标准曲线。
将样品溶液与等体积10%三氯乙酸混合,静置10 min,然后离心去除高分子蛋白。按标准曲线回归方程计算样品中多肽含量。
(2)蛋白质含量测定
将发酵液10 000 r/min离心10 min除菌体,参考国标GB 5009.5—2016《食品中蛋白质的测定》凯氏定氮法[15]测定蛋白质含量。
(3)还原糖含量测定
参照王容等[5]的方法,采用分光光度法测定豆清液中还原糖含量。
(4)pH值测定
采用pH计测定混菌发酵过程中豆清液的pH值。
(5)蛋白酶活性测定
发酵液经离心去除菌体后,按照国标GB/T 28715—2012《饲料添加剂酸性、中性蛋白酶活力的测定》福林酚法[16]测定发酵过程中酸性及中性蛋白酶活性。
(6)钙结合量及豆清多肽-钙螯合率测定
取发酵后的豆清液多肽液10 mL,调节pH 6.5,加入10 mmol/L氯化钙溶液5 mL,摇匀后放入40 ℃、80 r/min摇床,螯合90 min后取出,待冷却至室温后在反应体系中加入3倍无水乙醇,摇匀后静置1 h,10 000 r/min离心5 min。取沉淀物50 ℃电热鼓风干燥,将产品灰化后定容至25 mL。参考国标GB 5009.92—2016《食品中钙的测定》滴定法[17]测定样品中的钙结合量(每毫升豆清多肽所结合钙含量)另取多肽液10mL与10mmol/L氯化钙溶液5 mL,灰化后定容至25 mL,测定钙含量后计算所得的钙含量为反应体系中的总钙含量,通过与螯合后的样品钙结合量相比,可得出钙螯合率(钙螯合率可反映在在发酵过程中豆清液多肽得钙螯合活力)。根据(1)、(2)式计算出豆清多肽-钙螯合率。

式中:H为钙结合量,mg/mL;T为滴定酸度,即滴定用EDTA溶液相当于钙的质量数,mg/mL;V1为滴定时消耗EDTA溶液的体积,mL;50为样品消化液的定容体积与滴定用待测液体积之比。

式中:A为钙螯合率,%;V2为相同体系的多肽溶液与钙溶液的混合溶液滴定时所消耗的EDTA的体积,mL。
1.3.4 发酵动力学方程的建立
对于发酵后期菌体浓度较大的体系,一般采用描述生长曲线为S形的Logistic模型[18]。针对本实验情况,用Logistic方程模拟发酵体系豆清液菌体生长变化;Luedeking-Piret方程模拟多肽生成及蛋白质消耗变化。
(1)菌体生长动力学方程
Logistic方程微分式:

求积分:

式中:CX为菌体生物量,108CFU/mL;t为时间,h;k为微生物最大比生长速率,108CFU/h;Cm为最大菌浓度,108CFU/mL;C0为初始菌浓度,108CFU/mL。
(2)产物生成动力学方程
发酵过程中,产物生成与菌体生长有部分偶联、偶联、非偶联关系。本实验采用的混合乳酸菌为部分偶联型,当菌体处于稳定期时,采用Luedeking-piret方程[5]。模型方程如下:
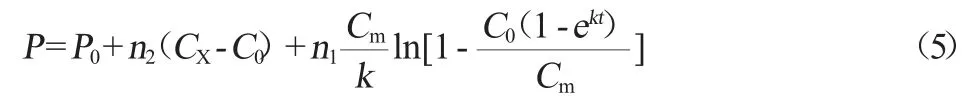
式中:P为多肽含量,mg/mL;P0为初始多肽含量,mg/mL;n1为与乳酸菌有关合成系数;n2为与菌体生长有关合成系数。
可得简写方程(6)式,求n1和n2及(5)式中C0,和k。

(3)基质消耗动力学方程
发酵体系中,菌体生长、产物的生成、细胞活动维持的相关关系式如下:
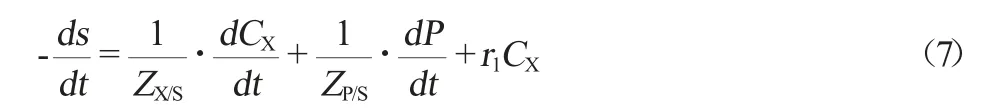
在理想状态下,可忽略产物生成的基质消耗,将(4)式代入(7)式得(8)式:
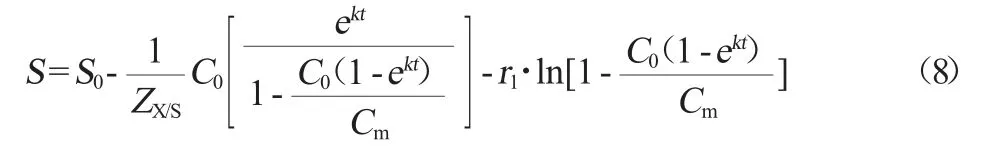
式中:S为蛋白质质量浓度,mg/mL;S0为初始蛋白质质量浓度,mg/mL;ZX/S为底物用于菌体生长得率系数;ZP/S为底物用于产物合成得率系数;P为产多肽量,mg/mL;r1为微生物维持常数。

得简化方程(10)式:

做菌种进入稳定期时S~t的线性方程求r1和r2,得基质蛋白质消耗的动力学模型。
(4)动力学方程的验证
将原有数据绘为散点图,将求解方程作为趋势线添至散点图,得到和方程有关的P值和相关系数R2,对动力学模型进行验证。
2 结果与分析
2.1 乳酸菌混菌发酵制备多肽动力学模型
2.1.1 乳酸菌混菌发酵制备多肽体系中的代谢情况
混合乳酸菌在豆清液中发酵代谢情况见图1。由图1可知,发酵周期36 h,乳酸菌生长曲线为S形,蛋白消质耗曲线则呈反S形,多肽豆清液水解蛋白质产物和菌体次级代谢产物与菌体生长曲线部分偶联。混合乳酸菌的发酵过程可分为3个阶段。延滞期0~4 h,菌体增长速率低,产物生成少,底物消耗缓慢;4~18 h为对数期,氮、碳源充足,乳酸菌生长迅速,底物快速消耗,多肽含量不断增加,多肽含量最高时达到5.31 mg/mL;18~36 h进入稳定期,此时乳酸菌繁殖速度下降、死亡数增加,菌体繁殖与死亡数量达到平衡,菌落总数稳定在5×108CFU/mL左右。乳酸菌最适pH为5.5~7.0,且具有耐酸特性,但由于的乳酸菌产酸特性,豆清液的pH值在发酵后期较低(3.7左右),抑制了菌体生长,同时蛋白质消耗殆尽,多肽合成速度降低。在蛋白酶和酸水解的作用下,肽链继续水解,多肽开始朝转化成氨基酸的方向进行,多肽含量趋向于小幅度降低。

图1 乳酸菌混菌发酵制备多肽动力学曲线Fig.1 Kinetic curve of peptide preparation by mixed fermentation of lactic acid bacteria
2.1.2 发酵动力学拟合
对(4)式线性拟合得到的菌体数y随时间x变化的方程为:y=0.353 3x-3.712 0,相关系数R2=0.991 9。可得最大比生长速率k=0.353 3 h-1,初始菌浓度C0=0.119 2×108CFU/mL。
对菌体稳定期多肽含量进行拟合,得产物P与菌体量有关的合成系数n的方程:P=0.100 4 n+3.603 7,相关系数R2=0.825 8,与菌体量有关的合成系数n1=0.020 1。将最大比生长速率k,初始菌浓度C0,菌体最大生物量Cm,与菌体量有关的合成系数n1,初始多肽浓度P0=0.895 0 mg/mL,代入(6)式并过原点线性拟合,得方程:P=0.863 8n+0.382 2,相关系数R2=0.930 8,由此得n2=0.863 8。
取菌体稳定期蛋白质浓度对时间拟合有:S=-0.15t+13.82,相关系数R2=0.957 0,得微生物维持常数r1=0.030 0。将最大比生长速率k,初始菌浓度C0,菌体最大生物量Cm,微生物维持常数r1,初始蛋白质含量S0=24.25 mg/mL,代入(10)式并过原点线性拟合,得方程:S=2.774 0t+0.223 0,相关系数R2=0.988 6,由此得底物用于菌体生长得率系数r2=2.774 0。
发酵动力学模型参数值及初始条件见表1。

表1 发酵动力学模型参数值及初始条件Table 1 Parameters and initial conditions of fermentation kinetics model
将表1各参数及初始条件值代入(4)式、(5)式、(8)式分别得到菌体生长动力学模型:
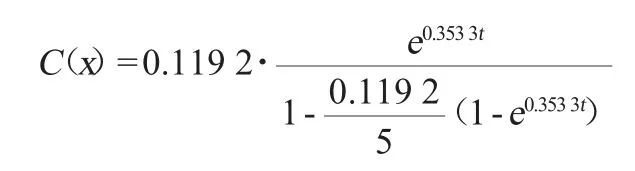
多肽生成动力学模型:
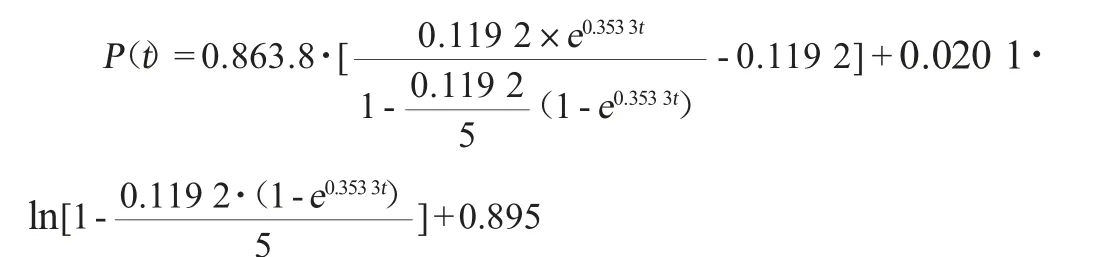
蛋白消耗动力学模型:

2.1.3 模型验证
混菌发酵过程菌体生长、多肽生成及蛋白质消耗实验值与模型值拟合曲线见图2。由图2可知,混合菌种的模型值与实验值拟合较为理想;菌体生长、多肽生成与蛋白消耗的动力学模型Pearson相关系数R2均>0.999;菌体生长和多肽生成动力学模型在0.01水平(双侧)显著相关。表明该模型较好反映了实际发酵过程中的动力学行为。

图2 菌体生长(a)、多肽产量(b)及蛋白质消耗(c)实验值与模型值拟合曲线Fig.2 Fitting curves of experimental values and model values for bacteria growth (a),polypeptide yield (b) and protein consumption (c)
2.2 发酵过程中还原糖含量变化
还原糖作为乳酸菌生长的碳源,与乳酸菌混菌发酵生产多肽的动力学模型也有所关联。混合乳酸菌在豆清液体系中还原糖变化见图3。由图3可知,在延滞期,还原糖的消耗速度较低,此时体系中菌体生物量低,对碳源的总体利用量小;随着菌体的增多和代谢的增强,在生长期还原糖消耗加快;18 h后菌体繁殖速度下降,还原糖消耗基本不变。

图3 发酵过程中还原糖含量的变化Fig.3 Changes of reducing sugar contents during fermentation process
2.3 发酵过程中pH值变化
豆清液中蛋白质的水解除蛋白酶和微生物的代谢作用外,酸水解也起到了重要作用。乳酸、苹果酸、柠檬酸、酒石酸等随着乳酸菌发酵代谢产生,在一定时间范围内,随着发酵时间延长,体系中酸度增大,pH降低[19-20]。发酵过程中pH值变化见图4。由图4可知,在混菌发酵体系中pH值在前16 h由初始值6.25持续下降,原因在于乳酸菌在发酵过程中将糖类物质转化为乳酸等有机酸,在这期间发酵液的pH值与总酸含量变化呈负相关;而在12 h后pH值一定程度下降后趋于稳定,这与混菌发酵进入稳定期有关。碳水化合物、脂肪可在微生物作用下形成有机酸[21]。在发酵过程中,糖类物质可以在微生物的作用下产生酸类物质,在发酵的稳定期阶段,豆清液的低pH值(3.7左右)抑制了菌体生长,随着碳源糖类物质的消耗,酸类物质的产生受限,最终pH值稳定在3.5左右。
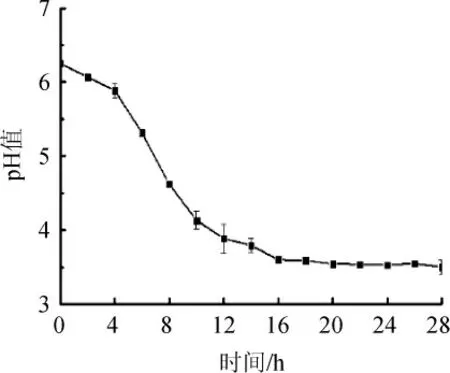
图4 发酵过程中pH值的变化Fig.4 Changes of pH value during fermentation process
2.4 发酵过程中蛋白酶活性变化
乳酸菌中的蛋白水解由不同的包膜蛋白酶(cellenvelope proteinase,CEP)引发[22],CEP分布在菌株间的差异很大,大多数乳酸菌仅含有1种细胞包膜蛋白酶[23]。中性蛋白酶最适pH值为6.0~7.5,酸性蛋白酶最适pH值为2.5~6.0。发酵过程中蛋白酶活性变化见图5。

图5 发酵过程中蛋白酶活性的变化Fig.5 Changes of protease activities during fermentation process
由图5可知,在发酵体系中,酸性蛋白酶表现出比中性蛋白酶更强的活性,酸性蛋白酶在4~8 h时酸性蛋白酶活性最高,为3.6 U/mL左右,中性蛋白酶在4 h表现出最大活性2.48 U/mL,对比发酵过程中的pH值变化,此时是适宜于中性蛋白酶条件的pH值,随着体系中酸性增大,酸碱度不适宜于中性蛋白酶。随着发酵pH降低,在8 h后两种蛋白酶活性均降低,酸性蛋白酶活性下降的原因可能在于酶与底物过渡态的结合能值降低,相较酸性蛋白酶,中性蛋白酶对酸性条件更为敏感,因此酶活有更明显的下降趋势。
2.5 发酵过程中豆清液钙螯合活力的变化
多肽-钙螯合物因其特有的组装模式和吸收机制,具有促钙吸收、抗氧化、抑菌、免疫调节等功能,是当前研究的热点[24]。发酵过程中钙螯合活力的变化见图6。由图6可知,发酵体系中的钙螯合活力总体趋势为先下降再升高后降低的趋势,这可能是由于在发酵初期,体系中多肽含量较低,而本研究意在研究多肽与钙螯合,故不作为参考,这种现象可能是蛋白质的空间结构导致;钙螯合率在14 h达到峰值33.35%,20 h后趋于稳定,这是因为随着豆清液水解过程的进行,蛋白质的不断减少和肽的增加导致水解位点的减少和水解产物中充当金属的协调结合位点的亲水基团(如-OH、-COOH和-NH2基团)的暴露,这可以解释钙结合能力的提高,而钙螯合活性的下降与短肽链的不断降解以及金属离子有效结合位点减少有关[25]。刘丽莉[26]利用乳酸菌和酵母菌发酵制备胶原多肽鳌合钙,钙鳌合率为47.85%,与本研究结果相近。
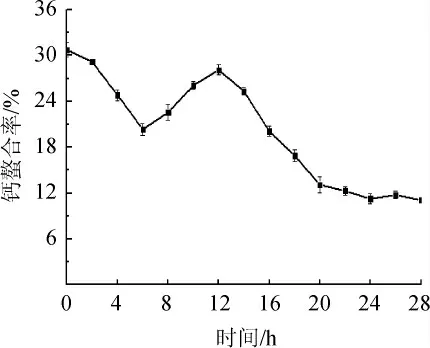
图6 发酵过程中钙螯合率的变化Fig.6 Changes of calcium chelation rate during fermentation process
2.6 相关性分析
乳酸菌混菌发酵过程中各变量相关性见表2。由表2可知,菌体浓度和发酵中的碳源还原糖及氮源蛋白质呈极显著负相关(P<0.01),试验结果与乳酸菌生长特性相符合。同时,代谢产物多肽与菌体浓度呈显著正相关(P<0.05),与蛋白质和还原糖呈显著负相关(P<0.05),多肽含量与钙螯合率呈显著正相关(P<0.05)。
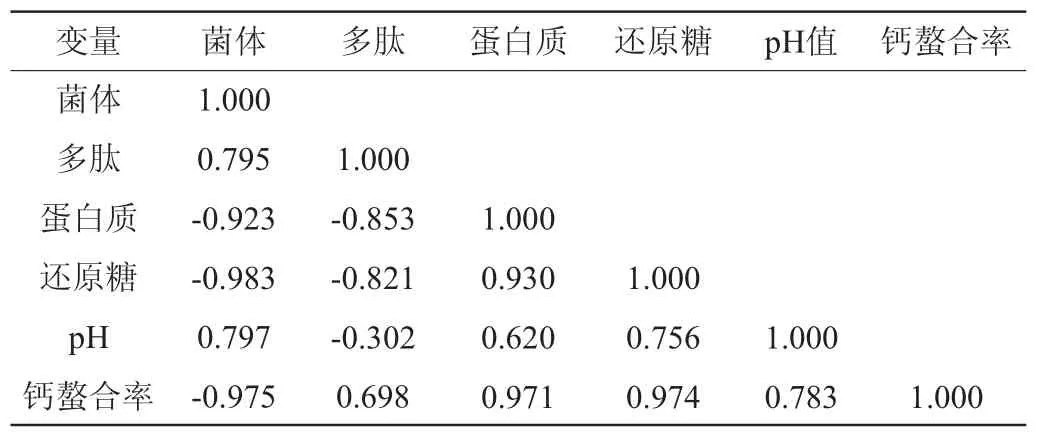
表2 乳酸菌混菌发酵过程中各变量相关性Table 2 Correlation of various variables in the mixed fermentation process of lactic acid bacteria
3 结论
本研究分析乳酸菌混菌发酵特征,建立了描述发酵过程中菌体生长、多肽生成和蛋白质消耗的动力学模型,经模型验证试验情况良好。还原糖含量总体趋势下降;pH值在前16 h由初始值6.25持续下降,之后稳定在3.5左右;酸性蛋白酶在培养体系中表现出比中性蛋白酶更强的活性,在4~8 h时酸性蛋白酶最大活性(3.6 U/mL),中性蛋白酶在4 h表现出最大活性(2.48 U/mL);钙螯合活力总体趋势为先升高后降低,在14 h达到最高值33.35%,20 h后趋于稳定。发酵过程中各变量有一定相关性,所建立的模型可用于指导实际生产。利用乳酸菌发酵豆清液生产豆清多肽,是实现大豆加工副产物高值化利用的一种创新途径,此外发酵过程中的钙螯合活性的变化表明豆清多肽具有制备多肽-钙螯合物的潜力,这可作为今后的研究方向。

