甘蓝黑腐病苗期抗性鉴定方法研究
张鑫鑫 张恩慧 吴云锋 许忠民 蔡美杰 孙庆国

摘 要:為了建立快速、准确的甘蓝黑腐病苗期抗性鉴定方法,以田间对黑腐病抗感差异表现明显的5个供试材料作为鉴别寄主,喷雾接种黑腐病菌株,设置1叶1心、2叶1心、3叶1心、4叶1心、5叶1心等5个接种苗龄,1×105、1×106、1×108、1×1010 CFU·mL-1等4种菌液接种浓度,26 ℃/19 ℃、28 ℃/19 ℃、30 ℃/19 ℃等3种培养温度,接种后0、12、24、36、48 h等5个保湿时间及接种后7、9、12、16 d等4个时间分别调查发病症状,确定影响抗性鉴定方法的关键因子。结果表明,上述处理组合能反映5个寄主材料的抗感特性,且高感与高抗材料的病情指数差值最大的分别为73.61、74.77和72.22。当甘蓝幼苗生长至3叶1心期,喷雾法接种浓度为1×108 CFU·mL-1菌液,接种后90%湿度下保湿36 h,在14 h光照、温度26 ℃/19 ℃培养下诱导病害发生,第12天调查幼苗发病程度,能够鉴定甘蓝材料的抗病性。
关键词:甘蓝;黑腐病;抗病性;苗期;鉴定方法
中图分类号:S635 文献标志码:A 文章编号:1673-2871(2021)06-039-08
Study on the method of identification of resistance to black rot in cabbage at seedling stage
ZHANG Xinxin1, ZHANG Enhui1, WU Yunfeng2, XU Zhongmin1, CAI Meijie1, SUN Qingguo1
(1. State Key Laboratory of Crop Stress Biology for Arid Areas/College of Horticulture, Northwest A&F University, Yangling 712100, Shaanxi, China; 2. College of Plant Protection,Northwest A&F University, Yangling 712100, Shaanxi, China)
Abstract: In order to establish a rapid and accurate method for identification of resistance to black rot in cabbage at the seedling stage, we used 5 materials with significant differences in resistance to black rot in the field as identification hosts, sprayed inoculation with black rot strains, set 5 inoculation seedling ages (one leaf and one heart, two leaves and one heart, three leaves and one heart, four leaves and one heart, five leaves and one heart), 4 kinds of inoculation concentrations (1×105 CFU·mL-1, 1×106 CFU·mL-1, 1×108 CFU·mL-1, 1×1010 CFU·mL-1), 3 culture temperature treatments (26 ℃/19 ℃, 28 ℃/19 ℃, 30 ℃/19 ℃), 5 moisturizing times (0 h, 12 h, 24 h, 36 h, 48 h) and 4 investigation time (7 d, 9 d, 12 d, 16 d) to determine the key factors of the identification method. The results show that the above treatment combination can reflect the anti-susceptibility characteristics of the five host materials, and the difference between the disease indices of the high-sensitivity and high-resistance materials is 73.61, 74.77 and 72.22, respectively. When the seedlings grew to the three leaves and one heart stage, the bacterial suspension with a concentration of 1×108 CFU·mL-1,was inoculated by spraying method, moisturized at 90% humidity for 36 hours after inoculation, and the disease was induced under 14 h light and 26 ℃/19 ℃, the incidence of seedlings was investigated on the 12th day, the disease resistance of cabbage material could be identified.
Key words: Cabbage; Black rot; Resistance; Seedling stage; Identification method
甘蓝黑腐病是由野油菜黄单胞菌(Xanthomonas Campestris pv. campestris,Xcc)引起的一种细菌性病害[1],是亚洲、欧洲、北美洲十字花科蔬菜的主要病害[2-4]。病斑从叶片边缘的褪绿斑点逐渐向叶片的主脉扩张,形成“V”形病斑,颜色从黄色逐渐变为褐色,最后变为黑色[5]。甘蓝黑腐病野油菜黄单胞菌主要通过种子带菌和幼苗移植进行传播,也可以通过昆虫、灌溉用水、农场设备及工人进行农事活动等进行传播[6]。病菌也能在十字花科杂草寄主和土壤中受感染的作物残茬中存活[7-8]。亚热带许多蔬菜生产区典型的温暖潮湿气候有利于疾病的流行[9]。
近年来,甘蓝黑腐病在我国蔬菜主产区普遍发生,对甘蓝生产造成了很大危害,使甘蓝严重减产[10]。尽管市场上有一些用于防治黑腐病的农药,但由于病原菌对杀菌剂的抗药性,黑腐病很难得到控制[11],选育抗病品种是防治甘蓝黑腐病最经济有效的途径之一,因此依据甘蓝黑腐病发生条件、发病规律和作物的感病特性、发病特征,制定一套较为科学的苗期抗病性鉴定方法,对于抗源筛选和抗病品种选育非常重要。有研究表明,甘蓝苗期和成株期抗病性基本一致[12-13],苗期鉴定抗病性速度快,可在较短时间内得到鉴定结果,并且苗期鉴定可在室内进行,条件容易控制[14-16]。因此,笔者在前人研究的基础上,从甘蓝幼苗接种黑腐病菌保湿时间、病原菌接种浓度及温度、甘蓝接种苗龄和调查时间等主因入手进行探究,旨在进一步完善并制定出甘蓝黑腐病苗期抗病性鉴定方法,以期为甘蓝抗病育种提供帮助。
1 材料与方法
1.1 材料与菌株
供试甘蓝材料为甘蓝田间黑腐病自然病圃经多年抗病性自然鉴定表现对黑腐病菌抗感差异显著的5个材料(表1),均由西北农林科技大学甘蓝研究室提供。供试甘蓝黑腐病菌株为致病力较强的甘蓝黑腐病菌株YU[17],该菌株由西北农林科技大学甘蓝研究室提供。
牛肉膏蛋白胨固体培养基:牛肉膏3 g、蛋白胨5 g、酵母粉1 g、葡萄糖10 g、琼脂15 g、蒸馏水1 L、pH 7.2;牛肉膏蛋白胨液体培养基:牛肉膏3 g、蛋白胨5 g、酵母粉1 g、葡萄糖10 g、蒸馏水1 L、pH 7.2。
1.2 方法
1.2.1 幼苗培养 试验于2019年3—10月在西北农林科技大学试验基地日光温室进行,将5个材料的种子先在75%酒精中处理1 min,再用灭菌蒸馏水冲洗2~3次后,于25 ℃培养箱内催芽2 d,选取发芽一致的种子播种于50孔穴盘(540 mm × 270 mm × 50 mm)基质中,所用基质提前进行灭菌处理,育苗盘置于日光温室中正常生长。
1.2.2 病原菌接种方法和抗性类型划分 接种材料准备:供试甘蓝材料幼苗长至一定时期时,将幼苗浇透水并覆盖塑料薄膜保湿24 h(25 ℃/19 ℃)。
黑腐病菌悬浮液制备:将4 ℃保存的菌株YU于牛肉膏蛋白胨固体培养基上活化24 h,挑取活化的菌株于牛肉膏蛋白胨液体培养基中,在28 ℃、190 r·min-1条件下振荡培养18 h,用无菌水调节浓度用于接种。
接种:用小型喷雾器将配制好的菌液均匀喷洒到植株叶片上,每株幼苗平均喷施1 mL左右,以叶片无液滴滴落为宜,以喷施无菌水为空白对照,3次重复,每次重复16株。接种后继续用薄膜保湿,之后除去薄膜将幼苗放置光照14 h、湿度90%下栽培生长。整个试验采用完全随机设计,接种后数日开始调查发病情况(每株幼苗随机选2片真叶进行调查),统计发病级别,计算病情指数,进行抗性类型划分。
病情指数计算和抗性类型划分:病情指数(Disease Index,DI)=Σ(病级叶数×该病级值)/(调查总叶数×最高病级)×100。抗性类型(Resistance Type,RT)划分:依据甘蓝材料的叶片病情级别,分别计算出DI平均值,进而确定其抗性类型。
1.2.3 病原菌接种后最适保湿和发病调查时间确定 用小型喷雾器将浓度为1×108 CFU·mL-1的菌液均匀喷施到3叶1心期的供试甘蓝幼苗上,分别设置塑料薄膜保湿0、12、24、36、48 h等5个处理,每个处理3次重复,每次重复16株幼苗。接种后的幼苗置于28 ℃/19 ℃光照14 h培养箱内培养;接种后分别于7、9、12、16 d调查发病症状,比较5个材料的田间自然抗病性与苗期接种黑腐病的抗病性,筛选病原菌接种后的最适保湿条件和发病调查时间。
1.2.4 病原菌接种最适浓度和温度确定 利用血球计数板分别配置1×105、1×106、1×108、1×1010 CFU·mL-1等4種浓度的黑腐病病原菌悬浮液,用小型喷雾器于3叶1心期的甘蓝幼苗进行喷雾接种,采用1.2.3确定的最适保湿时间和发病调查时间,将接种后除去薄膜的甘蓝幼苗置于光照培养箱内培养(光14 h/暗10 h),温度分别设置26 ℃/19 ℃、28 ℃/19 ℃、30 ℃/19 ℃等3个处理,湿度90%下培养;每个处理3次重复,每次重复16株。比较5个材料的田间自然抗病性与苗期接种黑腐病的抗病性,筛选病原菌接种后的最适浓度和温度。
1.2.5 病原菌接种最适苗龄的确定 采用1.2.3和1.2.4确定的保湿时间、发病调查时间、接种浓度和温度,设置1叶1心、2叶1心、3叶1心、4叶1心、5叶1心等5个接种苗龄处理。接种后幼苗于光照培养箱培养,湿度90%,每个处理3次重复,每次重复16株。比较5个材料的田间自然抗病性与苗期接种黑腐病的抗病性,筛选病原菌接种的最适苗龄。
1.2.6 甘蓝不同种质资源材料的抗病性鉴定 采用本试验中建立的甘蓝黑腐病苗期抗性鉴定方法,对国内外引进的44份甘蓝种质资源进行苗期抗病性鉴定,以高抗材料QK2502和感病材料QG50作为对照,根据鉴定结果选择有代表性的10份材料进行重复鉴定与验证。
1.3 数据处理
采用Excel 2007和SPSS 17.0对数据进行统计分析,采用Duncans多重比较法分析差异显著性。
2 结果与分析
2.1 甘蓝苗期感染黑腐病分级标准确定
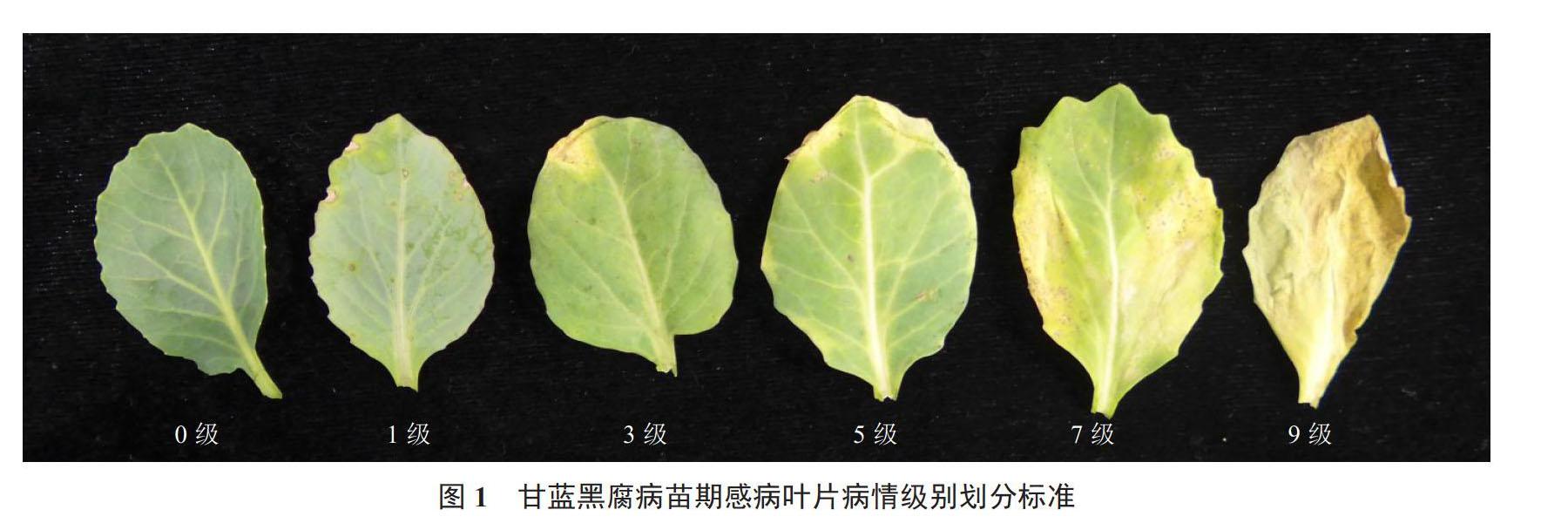
甘蓝苗期接种黑腐病菌的症状表现为病斑从叶片水孔处的褪绿斑点逐渐扩展,颜色由黄色逐渐变为褐色,后期变为黑色。根据症状特征分析,在国家甘蓝攻关组“八五”确定甘蓝苗期黑腐病病情分级标准[18]的基础上进一步修改完善;建立如下分级标准:0级,接种叶片无任何症状;1级,接种叶片水孔处有黑色枯死斑点,无扩展;3级,接种叶片病斑从水孔向外扩展,占叶面积1/16以下;5级,接种叶片病斑从水孔向外扩展,占叶面积1/16~1/4;7级,接种叶片病斑从水孔向外扩展,占叶面积1/4~1/2;9级,接种叶片病斑从水孔向外擴展,占叶面积1/2以上,见图1。
2.2 甘蓝黑腐病苗期接种鉴定最适保湿时间和发病调查时间的筛选
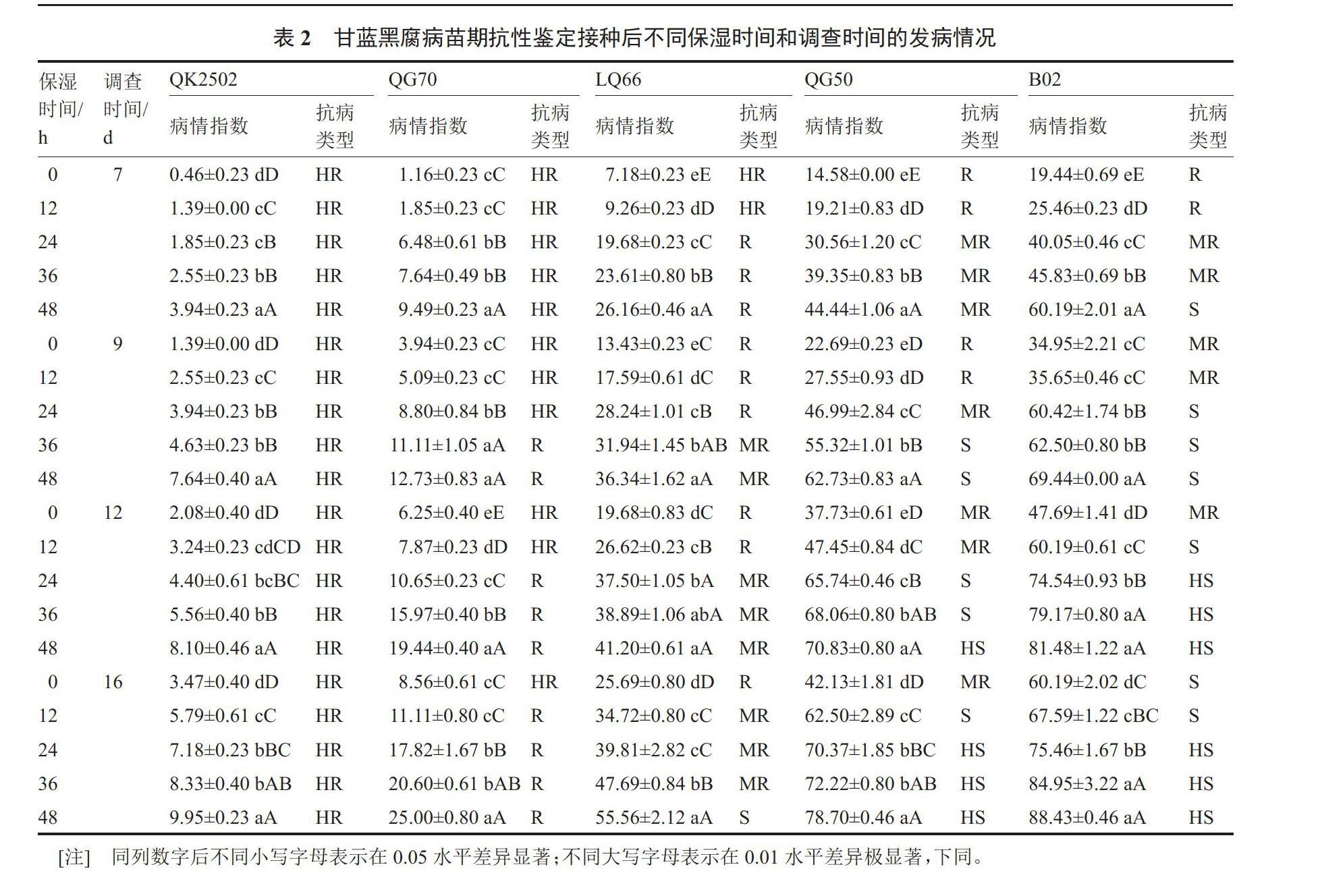
由表2可知,接种病菌后不同保湿和发病调查时间处理对5个材料病情指数的影响存在显著差异。鉴定表现出随着保湿时间的增加,5个材料的病情指数均呈现不同程度的增加趋势,且在不同保湿时间内均随着调查时间的延长,其幼苗的发病程度则相应的加重。从5个材料田间自然抗、感黑腐病的真实性与苗期接种鉴定抗性的一致性分析,仅有保湿24 h和36 h处理下,接种后12 d调查,5个材料苗期接种鉴定的抗、感病症状与其田间自然抗感性呈现一致,分别表现为QK2502(HR)高抗、QG70(R)抗病、LQ66(MR)中抗、QG50(S)感病、B02(HS)高感。在每个保湿时间下7 d和0、12 h保湿时间下9 d调查时,5个材料均发病较轻,QG70(R)病情指数均 ≤ 9.49,表现为高抗;在36 h、48 h保湿时间下9 d调查时,B02(HS)病情指数分别为62.50和69.44,表现为感病;在0、12 h保湿时间下12、16 d调查时,材料B02(HS)病情指数 ≤ 67.59,呈现偏小现象,表现为中抗或感病;在48 h保湿时间下12 d调查或24 h、36 h和48 h保湿时间下16 d调查时,感病QG50表现为高感;这些条件下的结果均不能真实地鉴定出5个材料的抗病性。即在筛选确定保湿24 h或36 h处理下第12天调查为适合苗期接种鉴定条件中,相比较5个材料中高感与高抗材料的病情指数差值,保湿24 h时差值为70.14、保湿36 h时差值为73.61。由此得出,苗期接种鉴定抗病性36 h和12 d时为最适保湿和发病调查时间。图2为5个材料在接种后保湿36 h、12 d时的发病症状。
2.3 甘蓝黑腐病苗期接种鉴定最适接种浓度和温度的筛选
由表3可知,甘蓝苗期黑腐病菌接种后不同接种浓度而相同温度处理时,5个材料的病情指数均呈现出随接种浓度的增大而增大的趋势;在接种浓度相同而温度处理不同时,5个材料病情指数均呈现出随处理温度增高而增大的趋势。从5个材料田间自然抗感黑腐病的真实性与苗期接种鉴定抗性的一致性分析,仅在接种浓度为1×108 CFU·mL-1、温度为26 ℃/19 ℃和28 ℃/19 ℃时,5个材料苗期接种鉴定的抗、感病症状与其田间自然抗感性呈现一致,分别表现为QK2502(HR)高抗、QG70(R)抗病、LQ66(MR)中抗、QG50(S)感病、B02(HS)高感。而其他接种浓度和温度处理下均存在不一致性差别,其中温度为26 ℃/19 ℃时,接种浓度为1×105 CFU·mL-1和1×106 CFU·mL-1处理下,5个材料均发病较轻,QG70(R)表现为高抗,LQ66(MR)表现为抗病,QG50(S)表现为中抗或抗病,B02(HS)表现为中抗或感病;接种浓度为1×1010 CFU·mL-1处理下,QG50(S)发病较重,病情指数为71.53,表现为高感。在温度为28 ℃/19 ℃时,接种浓度为1×105 CFU·mL-1和1×106 CFU·mL-1处理下,植株发病程度较轻,QG70(R)表现为高抗,LQ66(MR)表现为抗病,QG50(S)表现为中抗,B02(HS)表现为中抗或感病;接种浓度为1×1010 CFU·mL-1处理下,QK2502(HR)和QG50(S)发病较重,分别表现为抗病(R)和高感(HS)。在温度为30 ℃/19 ℃时,接种浓度为1×105 CFU·mL-1和1×106 CFU·mL-1处理下,B02(HS)发病较轻,表现为感病;接种浓度为1×108 CFU·mL-1和1×1010 CFU·mL-1处理下,QG50(S)发病较重,病情指数≥71.99,表现为高感,这些处理下的结果均不能真实地鉴定出5个材料的抗病性。由筛选确定温度为26 ℃/19 ℃或28 ℃/19 ℃、接种浓度为1×108 CFU·mL-1处理为适合苗期接种鉴定条件中,相比较5个材料中高感与高抗材料的病情指数差值,接种温度为26 ℃/19 ℃时差值为74.77、接种温度为28 ℃/19 ℃时差值为73.84。由此得出,苗期接种鉴定抗病性1×108 CFU·mL-1和26 ℃/19 ℃为最适接种浓度和温度。图3为5个材料在温度为26 ℃/19 ℃下培养至12 d时的发病症状。
2.4 甘蓝黑腐病苗期接种鉴定最适接种苗龄的筛选
由表4可知,对甘蓝不同苗龄的幼苗接种黑腐病菌,QK2502不同苗龄间病情指数存在极显著差异,其他4个材料不同苗龄间病情指数差异水平不同。鉴定表现出5个材料的病情指数均呈现随苗龄增大而减小的趋势,即幼苗发病程度重。对照5个材料田间自然抗感黑腐病的真实性与苗龄接种鉴定抗性的一致性分析,接种选在幼苗3叶1心期或4叶1心期,5个材料苗期接种鉴定抗感病的症状与其田间自然抗感性呈现一致性,分别表现为QK2502(HR)高抗、QG70(R)抗病、LQ66(MR)中抗、QG50(S)感病、B02(HS)高感;而其他接种苗龄均存在不一致性差别,接种在1叶1心期或2叶1心期时,QG50(S)发病均较重,表现为高感;而接种在5叶1心期时,幼苗发病较轻,QG70(R)表现为高抗,LQ66(MR)表现为抗病。结果表明,这些苗龄下的鉴定结果均不能真实地判别出5个材料的抗病性。在由筛选得出适宜接种的苗龄即为3叶1心期或4叶1心期中,相比较5个材料中高感与高抗材料间病情指数差值,其3叶1心期接种时差值为72.22、4叶1心期接种时差值为71.99。由此得出,甘蓝黑腐病苗期抗性鉴定接种的最适苗龄是3叶1心期。图4为5个不同抗性甘蓝材料在3叶1心期接种12 d时的发病症状。
2.5 甘蓝种质资源苗期黑腐病抗性鉴定与筛选
由表5可以看出,采用筛选确立的甘蓝黑腐病苗期抗性鉴定方法对44份甘蓝种质资源材料进行黑腐病抗性鉴定,结果表现出供试甘蓝种质资源材料间病情指数存在极大差别,各材料间抗感性分化非常明显。对黑腐病抗性分类的结果为:高抗材料10份,抗病材料11份,中抗材料9份,感病材料8份,高感材料6份,分别占鉴定资源材料的22.73%、25%、20.45%、18.18%和13.64%;苗期接种鉴定所得结果与供试44份种质资源材料历年在田间黑腐病圃的自然鉴定抗感性结果基本一致。与此同时,从这44份资源材料的每个抗性级别中随机选出2份材料进行重复鉴定,2次鉴定结果完全吻合,并且2次鉴定的供试抗、感对照品种也均表现出典型的抗、感特征,由此得出,研究建立的甘蓝黑腐病苗期抗性鑒定方法可行,其鉴定资源材料的抗病性结果准确、真实。
3 讨论与结论
建立甘蓝苗期抗病性鉴定方法既要符合田间发病期病原菌的适宜发病环境,也要考虑甘蓝植株自身生长状况与抗病性关系;并要接种鉴定选用致病力较强的病原菌和选择甘蓝幼苗的旺盛生长期,才能真实地表现出甘蓝资源的抗感性能。黑腐病是甘蓝作物的主要病害,病原菌主要通过水孔和伤口侵入甘蓝体内;甘蓝感染病原菌自身也会产生应激反应,抵抗病原菌危害并逐渐在侵入周围表现感病症状。对于甘蓝黑腐病苗期抗性鉴定接种方式,前人采用剪叶法[19]、针刺法[20-21]等,这是人为造成伤口有利于病原菌入侵,但某种程度会降低甘蓝的抗御能力,伤口接种易导致植株感病加重。笔者在本研究中采用喷雾接种,模拟了田间黑腐病菌自然侵染途径[22],使甘蓝植株处于自然生长状态,体内防御体系健全,能使甘蓝资源对黑腐病的抗感反应表现出真实性。
甘蓝黑腐病发病的重要条件是具有适宜的高温和高湿环境,这样才可能充分保证黑腐病菌的强致病力和保证病菌在叶面上的黏着性,同时也能保证甘蓝叶面水孔的开放性,便于病原菌入侵;干旱或缺湿易导致甘蓝叶面蜡粉增多,水孔关闭,病原菌不易侵染叶片。本研究得出,进行甘蓝黑腐病抗性苗期接种鉴定,接种病原菌后保湿36 h、12 d时调查幼苗感病程度才能客观地判别甘蓝资源的抗病性。如果保湿时间或幼苗感病症状调查时间过长或过短均会导致病害加重或减轻,从而影响甘蓝资源抗病性真实性的鉴定;这与前人[23-25]研究的结果有所不同。
病原菌接种浓度直接决定着植物感染病害的发病程度,温度是影响植物和微生物生活力的主要因子,二者共同决定着病原菌的致病力和植物受病菌的伤害程度。病原菌侵染寄主并不是浓度越高致病力就越强,对于不同作物它有一个致病力最强的浓度适宜范围。本研究得出甘蓝幼苗接种黑腐病菌抗性鉴定适宜浓度为1×108 CFU·mL-1,接种温度为26 ℃/19 ℃时就能明显地区别出抗感资源的抗性差异。这个结论也表明在适宜接种病原菌浓度下,26 ℃/19 ℃接种温度正是野油菜黄单胞菌(Xcc)最适生长温度,同时此温度对甘蓝生长也相对有利;如果温度 ≥ 28 ℃,甘蓝生长减缓,抗逆性减弱,相应的就加快了植株的发病进程,此时会导致感病加重。笔者这种认识与Staub T[26]在研究十字花科作物黑腐病抗性鉴定方法时认为过高接种浓度和接种温度会导致鉴定材料抗病性降低的观点相同。田间甘蓝黑腐病多发生在每年8—9月,此时温度25~30 ℃,降水较多,这与笔者的研究结果相吻合。
病害抗性鉴定选择的接种苗龄是影响甘蓝抗病性鉴定真实表达的重要因素之一。笔者认为甘蓝不同苗龄接种黑腐病菌,导致幼苗发病程度的轻重差异不同;苗龄越小发病越重,苗龄越大发病越轻;而能真实地代表甘蓝资源本身抗病特性的接种苗龄是幼苗生长中期,即3叶1心期或4叶1心期。这也再次表明笔者认为建立甘蓝苗期抗病性接种鉴定方法除应选用当地强致病力的病原菌外,还需选在甘蓝幼苗生长的最旺盛期接种。甘蓝一般分为2/5和3/8叶环,第1叶环为苗期,生长5片或8片真叶代表苗期结束。也正因为3叶1心期或4叶1心期是2/5和3/8叶环幼苗生长中期,此时甘蓝幼苗根系发育健全,体内代谢旺盛,生长势最强;而选择此时接种病原菌鉴定抗病性也最具代表性。
综上所述,当幼苗生长至3叶1心期时,选用当地强致病力的黑腐病菌株YU,配制浓度为1×108 CFU·mL-1的病菌悬浮液,采用喷雾法接种,接种后90%湿度下保湿36 h,在光14 h/暗10 h、温度26 ℃/19 ℃培养条件下诱发病害发生,于12 d时调查幼苗发病程度,依据甘蓝资源材料的病情指数就能够准确、可靠地鉴定其抗病类型。
参考文献
[1] JENSEN B D,MASSOMO S M S,SWAI I S,et al.Field evaluation forresistance to the black rot pathogen Xanthomonas campestris pv.campestris in cabbage (Brassica oleracea)[J].European Journal of Plant Pathology,2005,113(3):297-308.
[2] JENSEN B D,VICENTE V,MANANDHAR K M,et al.Occurrence and diversity of Xanthomonas campestris pv.campestris in vegetable brassica fields in Nepal[J].Plant Disease,2010,94(3):298-305.
[3] SINGH D,RATHUR P S,VICENTE J G.Characterization,geneticdiversity,and distribution of Xanthomonas campestris pv. campestris races causing black rot disease in cruciferous crops in India[J].Plant Pathology,2016,65(9):1411-1418.
[4] LANGE H W,TANCOS M A,CARLSON M O,et al.Diversity of Xanthomonas campestris isolates from symptomatic crucifers in New York State[J].Phytopathology,2016,106(2):113-122.
[5] BURLAKOTI R R,CHEN J R,HSU C F,et al.Molecular characterization,comparison of screeningmethods,and evaluation of cross-pathogenicity of black rot (Xanthomonas campestris pv.campestris) strains from cabbage,choy sum,leafy mustard and pakchoi from Taiwan[J].Plant Pathology,2018,67(7):1589-1600.
[6] SCHAAD N W,DIANESE J C.Cruciferous weeds assources of inoculum of Xanthomonas campestris in black rot of crucifers[J].Phytopathology,1981,71(11):1215-1220.
[7] COOK A A,WALKER J C,LARSON R H.Studies on the disease cycle of black rot of crucifers[J].Phytopathology,1952,42(5):162-167.
[8] VICENTE J G,HOLUB E B.Xanthomonas campestris pv.campestris(cause of black rot of crucifers) in the genomic era is still a worldwide threat to Brassica crops[J].Molecular Plant Pathology,2013,14(1):2-18.
[9] WILLIAMS P H.Black rot:a continuing threat to world crucifers[J].Plant Disease,1980,64(3):736-742.
[10] LIU K,GARRETT C,FADAMIRO H,et al.Antagonism of black rot in cabbage by mixtures of plant growth-promoting rhizobacteria(PGPR)[J].Biocontrol,2016,61(5):605-613.
[11] AFRIN K S,RAHIM M A,RUBEL M H,et al.Development of race-specific molecular marker for Xanthomonas campestris pv.campestris race 3,the causal agent of black rot of crucifers[J].Canadian Journal of Plant Science,2018,98(5):1119-1125.
[12] 蔡岳松,童南奎,曲竹蓉,等.甘藍品种(系)对芜菁花叶病毒和甘蓝黑腐病的抗性鉴定[J].西南农业大学学报,1990,12(1):23-25.
[13] 李永镐,徐丽波.甘蓝黑腐病苗期抗病性鉴定方法的研究[J].东北农学院学报,1990,21(2):125-129.
[14] 解永梅,张薇,赵永强,等.山东省白菜黑腐病苗期抗病性鉴定方法[J].植物保护学报,2007,34(6):661- 667.
[15] 刘伟,李慧敏,王亚娣.不同十字花科植物对十字花科黑腐病病原菌抗病性的研究[J].通化师范学院学报,2011.32(4):44-45.
[16] 姚星伟,牛国保,单晓政,等.花椰菜苗期黑腐病抗病性鉴定[J].黑龙江农业科学,2018(8):39-42.
[17] 张鑫鑫,张恩慧,吴云锋,等.我国部分省域甘蓝主要产区黑腐病菌鉴定及致病力分析[J].植物病理学报,2020,50(5):592-601.
[18] 李树德.中国主要蔬菜抗病育种进展[M].北京:科学出版社,1995:603-616.
[19] 龚静,朱玉英,吴晓光.甘蓝黑腐病抗性材料筛选及接种方法的研究[J].上海农业科技,2001(4):87-92.
[20] 黄德芬,李成琼,司军,等.甘蓝黑腐病生理小种划分及其抗病性鉴定研究进展[J].中国蔬菜,2011(18):6-10.
[21] 黄德芬,李成琼,司军,等.甘蓝抗黑腐病离体鉴定方法的研究[J].西南大学学报(自然科学版),2011,33(8):5-9.
[22] BANDYOPADHYAY S,CHATTOPADHYAY S B.Incidence of black rot of cabbage and cauliflower under different conditions of infection[J].Indian Journal Agricultural Science,1985,55(5):350-354.
[23] 甘彩霞,何云启,崔磊,等.萝卜黑腐病苗期抗病性鉴定方法的研究[J].湖北农业科学,2010,49(12):3057-3060.
[24] 芦燕,张鲁刚.陕西省大白菜黑腐病苗期人工接种抗性鉴定方法研究[J].西北农业学报,2008,17(4):219-222.
[25] 翟文慧,张涛涛,胡俊,等.大白菜黑腐病鉴定的湿度试验及其苗期与成株期抗病性的相关分析[J].中国蔬菜,2010(10):59-63.
[26] STAUB T,WILLIAMS P H.Factors influencing black rotlesion development in resistant and susceptible cabbage[J].Phytopathology,1972,62(7):722-728.

