sncRNAs调控植入前胚胎母源因子降解机制的研究进展
邵静,许保增
(中国农业科学院特产研究所,吉林 长春 130112)
精子和卵子结合形成的受精卵拉开了早期胚胎发育的序幕,可是只有当胚胎真正继承了双亲的遗传物质,生命才算正式开始,这一刻被称为合子基因组激活(zygotic genome activation,ZGA)。ZGA是胚胎着床前的关键时期,也是决定胚胎能否继续发育的重要阶段,甚至影响到原肠胚的形成和早期胚胎分化[1]。受精卵发育的第一步就是将两个终末分化的配子重新编程为全能胚胎[2]。但是在受精早期,雌、雄原核融合的合子核基因组处于转录静止状态,无法合成蛋白质,胚胎的早期发育完全由卵母细胞中储存的母源因子(mRNA和蛋白质)控制。母源因子是维持受精后第一次卵裂的必要物质,可以驱动早期胚胎快速地进行有丝分裂[3]。但随着母源因子被逐渐消耗和降解,胚胎需要依靠自身物质来继续发育,胚胎发育由母源转录本调控转变为由合子核基因组调控,这一过程就是母源-合子转换(maternal-to-zygotic Transition,MZT)[4]。ZGA和母源因子的清除协调作用,共同完成了MZT,使胚胎获得能够分化成完整个体的全能性。由于MZT在早期胚胎发育中存在关键作用,有关母源因子清除和ZGA发生机制的研究一直备受干细胞生物学、表观遗传学和发育生物学等领域研究者的关注。虽然ZGA在后生动物中普遍存在,但不同物种中ZGA的发生时间存在差异。小鼠胚胎基因组激活发生在2-细胞胚胎晚期[5];大型家畜的早期胚胎发育通常更依赖母源因子,例如猪和牛的ZGA发生在4-细胞到16-细胞之间[6,7];人类胚胎基因组的转录激活一般在4-细胞和8-细胞时期[8-10]。
小分子非编码RNA(small non-coding RNA,sncRNA)是一类长度仅为20-30 nt的非编码RNA,过去曾被认为是“垃圾DNA”的非功能性转录产物,主要包括微小RNA(microRNA,miRNA)、与PIWI蛋白相互作用的RNA(Piwi-interacting RNA,piRNA)和小干扰RNA(small interference RNA,siRNA)[11]。但深入研究发现,这些sncRNA可以在RNA干扰(RNAi)中发挥作用,通过调节基因的表达参与多种生命活动,例如生长发育、细胞凋亡和各种疾病发生[12,13]。也有研究认为sncRNAs能够定向调节靶mRNA的表达,在早期胚胎中激活或产生清除母源因子的信号通路,参与母源转录本的降解,使胚胎能够顺利完成母源因子的清除和合子基因组的激活,从而将卵母细胞对早期胚胎的发育控制权转向合子基因组[14]。本文总结了近年来sncRNA参与母源因子清除的主要研究进展,综述sncRNA调节MZT的研究现状。
1 母源因子降解对合子基因组激活的作用
1.1 母源因子的定义
精子和卵子结合所形成的受精卵是个体发育的基础,但事实上受精卵是由雌雄原核融合的合子核以及卵细胞的细胞质组成。在卵裂初期,合子基因组没有表达,细胞质中储存的RNA和蛋白质控制着早期胚胎的有丝分裂,这些物质被称为母源因子,负责表达母源因子的基因则为母源基因。胚胎早期发育完全依赖于母源因子。Motley是斑马鱼胚胎中的母源因子,控制染色体的分离和细胞质的分裂,Motley突变后胚胎中的染色体排列异常,细胞质分裂不均匀[15]。合子阻滞基因1(Zygote arrest 1,Zar1)是最早被发现的调控早期胚胎发育的母源基因,Zar1基因缺失会导致雌鼠不育,受精卵缺失Zar1基因则会在1-细胞阶段停止发育[16]。但随着胚胎发育越来越复杂,胚胎需要激活自身的基因组才能成长为新个体,母源因子逐渐消耗并被清除。
1.2 母源因子降解是合子基因组激活的前提
在母源因子主导胚胎基因组转变的过程中,绝大多数母源因子都会降解,母源因子及时降解是保障合子基因组完成激活和胚胎继续发育的前提。一部分母源mRNA在ZGA之前甚至在受精之前就被母源物质清除,属于母源性降解(Maternal decay,M-decay);还有一些母源mRNA需要在部分合子基因表达之后被胚胎产物降解,称为合子性降解(Zygotic decay,Z-decay)[17]。果蝇有1/3的合子核基因可能会促使母源mRNA降解[18]。小鼠中绝大多数母源mRNA都在2-细胞期后降解,BTG4基因只在卵母细胞和受精卵中表达,敲除BTG4的小鼠卵母细胞虽然具备受精能力但只能发育到2-细胞,并且本该降解掉的母源mRNA仍然存在[19]。敲除小鼠卵母细胞中调控DNA甲基化的Stella基因后有一半的胚胎由于ZGA缺陷而不能发育到4-细胞[20]。人类胚胎普遍在8-细胞发生ZGA,如果母源mRNA没有及时清除,胚胎发育会受到阻碍,胚胎基因组也不会表达[21]。在正常斑马鱼胚胎中,YTHDF2会识别母源mRNA的m6A甲基化修饰并使mRNA降解,敲除YTHDF2后母源mRNA的半衰期延长,原肠胚形成时间推迟,注射外源YTHDF2则会使表型恢复正常[22]。山羊胚胎也有类似的现象,ZGA过程中YTHDF2呈高水平表达,转录组测序显示母源mRNA的含量在ZGA之前都呈现下降的趋势,敲除YTHDF2后脱帽酶DCP1A的表达量下调,母源mRNA不能完全降解,很多胚胎没有发育成囊胚[23]。综上,母源因子在早期胚胎发育中起到决定作用,在MZT阶段,母源因子能否正常降解调控着合子基因组的激活时间以及胚胎的发育速度。
2 miRNA
2.1 miRNA的作用机制
miRNA是较早被发现的非编码RNA,从此掀起了传统中心法则之外的非编码RNA功能机制的研究热潮。miRNA广泛存在于动物的各个组织中,哺乳动物约半数的基因表达都会受到miRNA的调节。miRNA与靶基因并不是一一对应的,一个miRNA可以有多个靶基因,一个基因也可以受到很多miRNA的调节,因此形成了复杂的基因调节网络[24]。与其他RNA一样,miRNA也是由细胞核内的DNA转录而来。如图1所示,miRNA基因在聚合酶II的作用下转录成初级miRNA(pri-miRNA)[25]。DGCR8识别pri-miRNA并与Drosha酶形成复合物将pri-miRNA分解为只有70~80 nt的前体miRNA(pre-miRNA)[26]。pre-miRNA经转运蛋白Exportin 5运输到细胞核外,被细胞质中的RNA内切酶III家族的Dicer酶切割成20 nt左右的双链miRNA,在AGO2蛋白的共同作用下将双链打开,暴露出其中的引导链,引导链与RNA诱导沉默复合体(RNA-induced silencing complex,RISC)结合,引导成熟的miRNA与调节靶基因稳定性的3'UTR结合,抑制靶基因的翻译[27]。
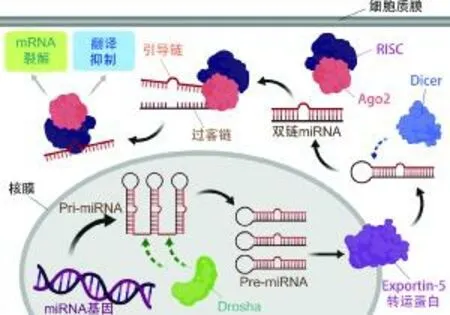
图1 miRNA的生物形成及作用机制[28]Fig.1 The biogenesis and action mechanism of miRNA[28]
2.2 miRNA与ZGA期间降解母源因子
miRNA是胚胎发育从母源因子调控转变成合子基因组调控的主要参与者。这些小分子内源性非编码RNA在卵巢组织、颗粒细胞、卵母细胞、卵泡液和胚胎中表达,有些miRNA还可以经囊泡排到胞外,与细胞内的miRNA共同参与生物体生存和发育的调节[29]。现有研究发现,降低果蝇AGO1基因表达会使胚胎发育停滞,还会导致神经系统功能紊乱[30];AGO2蛋白参与RNA诱导沉默复合体的形成,缺失该蛋白后,小鼠胚胎不能正常发育成原肠胚[31];DGCR8是miRNA加工过程中的重要蛋白,敲除DGCR8基因后小鼠胚胎只能短暂发育到6.5 d[32];无独有偶,小鼠早期胚胎缺失Dicer基因后往往在原肠胚前后停止发育[33],这些结果都表明早期胚胎的发育一定要有miRNA的存在。
miRNA主要参与母源因子的合子性降解通路。miR-430在斑马鱼早期胚胎中广泛表达,属于第一批被合子基因表达的miRNA。斑马鱼的很多母源mRNA都受到miR-430的调节,而miR-430的多数靶基因也都属于母源mRNA,早期胚胎缺失miR-430会导致上百个母源mRNA的表达不能被充分抑制,缺乏Dicer的斑马鱼胚胎在形成原肠胚的过程中会出现阻碍,但通过注射miR-430可以弥补这种阻碍继续发育,说明miR-430主要在ZGA阶段起作用[34]。Nanog、Pou5f1和SoxB1是来自卵母细胞的高度表达的母源转录因子,通过激活miR-430的表达清除母源因子并调节ZGA,缺失这种基因的斑马鱼胚胎则不能发育成原肠胚,包括miR-430在内的半数合子基因也无法激活[35,36]。miR-309簇编码的8个miRNA(miR-3、miR-4、miR-5、miR-6-1、miR-6-2、miR-6-3、miR-286和miR-309),在果蝇胚胎的合子基因组开始转录时也会被表达出来,敲除miR-309簇后母源mRNA显著上调,证明这些miRNA可以在清除果蝇胚胎母源因子中发挥作用[37]。RNA结合蛋白Smaug(SMG)属于母源性降解通路,可以与果蝇胚胎中的母源转录本结合,在脱腺苷酸化酶复合体的作用下降解母源因子[38],也能够促进miR-309簇的表达,将SMG突变后miR-309等8个miRNA的表达量明显降低,而母源因子的含量却没有明显下降[39]。与miR-430类似,miR-427是由非洲爪蟾胚胎基因组表达的miRNA,在受精7 h后就可以检测到很高的丰度,但在原肠胚形成后会迅速减少,在成年的非洲爪蟾中不会再表达[40]。非洲爪蟾合子基因组激活前依赖母源性细胞周期蛋白A1和B1进行快速地卵裂,但miR-427靶向表达母源性细胞周期蛋白的转录本的3'UTR,使母源性细胞周期蛋白逐渐衰减,促使合子基因表达,为胚胎提供新的细胞周期蛋白,并且非洲爪蟾的很多母源性mRNA都存在miR-427的潜在靶位点,这表明miR-427可能是降低母源mRNA表达的重要参与者[41]。线虫中有miR-35-42和miR-51-56可以诱导母源mRNA脱腺苷酸化来降解母源因子[42]。
小鼠的合子基因在2-细胞晚期开始表达的同时,miR-290-295簇也在第一时间被编码形成,并且在4-细胞时期转录速度加快,在这之前胚胎中都只有少量的miR-290-295[43]。分析小鼠不同时期胚胎的基因表达谱,与miRNA作用机制相关的AGO2基因的表达量在不同的胚胎时期有很大的波动,2-细胞胚胎表达量下降了5倍,但在4-细胞和8-细胞期又恢复到高水平,到桑葚胚时期迅速下降[44]。在牛的早期胚胎中,miR-125、miR-127和miR-145的表达量在4-细胞和8-细胞时期升高[45],miR-130a和miR-21的表达量在8-细胞时期增加[46]。鸡的miR-302家族是小鼠的miR-290家族、非洲爪蟾的miR-427家族以及斑马鱼的miR-430家族的直系同源物,在卵裂中后期(EGK.VIII期)表达量大幅度增加,并在胚盘期(EGK.X期,相当于哺乳动物的囊胚期)大量表达[47,48],这种动态的表达模式也可能是miRNA能够调节MZT的一种体现。
多能性因子OCT4、Nanog、SOX2和KLF4有调节合子基因组激活的作用,OCT4是人类ZGA必要的转录因子,其结合位点富集在ZGA时期的染色质开放区域[49]。将miR-294与OCT4、SOX2和KLF4外源基因共同导入小鼠胚胎成纤维细胞,可以让细胞的重编程效率比没有转染miR-294的细胞高10倍[50]。在没有诱导多能性的外源转录因子的情况下转染miR-302仍然能使人或小鼠的成纤维细胞重编程为多能细胞[51]。NOBOX是在牛早期胚胎发育中起作用的母源基因,miR-196a能够靶向NOBOX的3'UTR区域在MZT期间清除这种母源因子,可以检测到NOBOX表达量在8-细胞期迅速降低,miR-196a的表达量增加的时期和胚胎基因组激活的时间是一致的[52]。SEBOX是一种母体效应基因,一直到小鼠的ZGA之前都有很高的表达量,该基因被敲除后不会影响卵母细胞的发育,但原核期胚胎缺失SEBOX则会使母源因子不能完全降解以及调控ZGA的基因异常表达,从而导致2-细胞胚胎发育受阻[53]。研究发现敲除miR-125家族会增加SEBOX的表达量,并导致在MZT期间调控ZGA基因的表达量上升[54]。胚胎也可以通过摄取子宫内膜的miRNA激活相关基因的表达来调节着床时间,例如子宫内膜的miR-30d可以间接触发与人类胚胎粘附相关的基因的表达[55]。
现阶段关于miRNA对ZGA的研究大多集中在胚胎不同发育阶段的表达谱分析,miRNA在卵母细胞和不同时期的胚胎中差异表达也是miRNA能够在早期胚胎发育过程中起调节作用的依据之一。miRNA主要通过抑制母体效应基因的翻译,降低母源转录本的稳定性,加速母源因子的降解等途径清除母源因子。目前,miRNA对MZT和ZGA的作用只在昆虫和斑马鱼等脊椎动物中得到了明确的验证,在哺乳动物中的实际作用效果还需要进一步探究。miRNA只是小分子非编码RNA的一个分支,并不能完全代表sncRNAs在ZGA过程中的功能机制。
3 siRNA
3.1 siRNA的作用机制
siRNA也是RNA干扰的主要途径之一,在基因表达的过程中发挥调节作用。与miRNA类似,内源性siRNA(endo-siRNA)的形成也需要在Dicer酶的作用下将机体内部产生的具有同源性的双链RNA(dsRNA)切割成长度为21~25 bp的双链小RNA片段[56]。成熟的endo-siRNA的双链结构是siRNA发挥RNA干扰功能的前提条件。如图2所示,endo-siRNA中的随从链被分离降解,引导链与Argonaute家族的AGO2蛋白结合构成RISC,与mRNA结合诱导靶基因降解[57]。相比于miRNA,endo-siRNA对于靶基因具有更高的特异性识别能力。endo-siRNA可以靶向mRNA的任何区域而不局限在非编码区,miRNA只需要种子序列的7个碱基与靶位点结合便可以抑制mRNA的翻译,而siRNA的序列则需要与靶基因完全匹配才能使用RISC中的核酸内切酶切断结合位点处的mRNA,被切断的mRNA迅速被细胞中的酶降解,不能再进行下一步的翻译表达[58]。生物体中的endo-siRNA大多分布在体细胞和生殖细胞的假基因、内含子和转座子区域[59]。siRNA现已成为分子和细胞实验不可或缺的工具。研究人员利用siRNA的这一作用机理,通过简单的转染技术将外源的siRNA导入实验对象中,实现基因的敲除,以此进行疾病防治、新药开发以及基因诊断等不同领域的研究。虽然siRNA在生物体中的很多调节机制都不明确,但由于siRNA与靶标转录本结合的特异性高于miRNA,对mRNA的降解能力也更强,所以目前siRNA作为基因敲除工具在生物医学领域有比miRNA更广泛的应用。
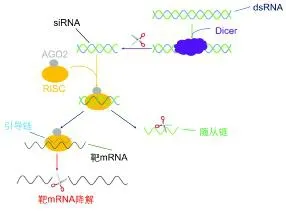
图2 siRNA的作用机制[60]Fig.2 The action mechanism of siRNA[60]
3.2 siRNA与母源因子的降解
endo-siRNA在卵母细胞中高度表达,已有报道显示siRNA能够调节早期胚胎的发育过程。卵母细胞储存的大部分母源因子一方面可以调控卵母细胞顺利进入减数第二次分裂中期,使其拥有受精能力,另一方面又可以在早期胚胎中表达,支持胚胎前期的卵裂,所以母源因子的缺失和突变都可能造成雌性动物的不孕或流产[19,61]。将小鼠卵母细胞中的Dicer基因敲除后,纺锤体的形成受阻,同源染色体也不能正常分离,卵母细胞的发育将停滞在第一次减数分裂,导致小鼠不能受精[62];存在于卵母细胞中的miRNA和endo-siRNA需要在Dicer酶的参与下才能形成。Suh等[63]敲除小鼠卵母细胞中的DGCR8基因后,细胞内mRNA的表达水平没有明显变化,卵母细胞仍然可以发育成熟,并能与精子结合产生正常的受精卵。由于siRNA的形成过程中不需要DGCR8蛋白的调节,DGCR8基因的缺失只能抑制卵母细胞中miRNA的生成,说明endo-siRNA是卵母细胞发育成熟以及动物生育不可缺少的调节因子。Stein等[64]进行卵母细胞转录组测序时发现miRNA的活性在卵母细胞发育的过程中始终受到抑制,这也说明miRNA在卵母细胞生长过程中几乎不发挥作用。
抑制相关miRNA的表达也可能是siRNA调节ZGA的一种方式。Zhao等[65]在斑马鱼早期胚胎中注射不同的siRNA后,胚胎的大脑和尾巴都会发生不同程度的损伤,并且会导致胚胎中能够降解母源因子的miR-430的表达量降低,将siRNA与miR-430共同导入胚胎中则不会再出现这些缺陷。产生这种现象的原因可能是siRNA与miRNA的合成与作用路径中存在对Dicer酶等共同组分的竞争关系。Argonaute蛋白家族的AGO1-4的4个成员都可以参与miRNA形成RISC的过程,缺失任一成员虽然都会抑制miRNA的活性,却也可以通过增加其他蛋白来弥补,但是siRNA的作用通路只有AGO2的参与。将小鼠胚胎中的AGO2敲除后胚胎只能发育到2-细胞期,本该降解的母源因子也依旧存在,与之对应,敲除AGO3和AGO4蛋白后胚胎依然可以成长到囊胚期,这些现象表明siRNA也可能促进母源因子的消除[66]。对小鼠不同时期的胚胎进行RNA和小RNA测序,在卵母细胞和4-细胞胚胎中差异表达的母源基因里有1/4都受到endo-siRNA的靶向调控[67]。Han等[68]对秀丽线虫的卵母细胞和胚胎中的小RNA进行高通量测序,发现endo-siRNA的长度大多是22 nt和26 nt,其中26 nt的endo-siRNA在胚胎中上调,而在第四阶段的幼虫期开始下降,在此期间26 nt的endo-siRNA所靶向的母源转录本骤减,推测这类endo-siRNA可以清除合子发育过程中的母源因子。之前也有研究表明参与MZT的lncRNA可以在Dicer酶的作用下转化为endosiRNA[69]。
目前明确的siRNA的功能还只是在调节卵母细胞发育成熟这一层面,即使有很多现象能够反映endosiRNA可以通过母源降解性通路清除母源mRNA调节早期胚胎的ZGA,但由于研究对象和研究方法的单一,当前并不能确定siRNA在ZGA中的具体作用效果和机制。但endo-siRNA在哺乳动物生殖细胞中广泛分布的这一特点仍然为探索它在早期胚胎发育中所扮演的角色提供了很多可能性。
4 piRNA
4.1 piRNA的作用机制
与miRNA和endo-siRNA不同的是,内源性piRNA的形成机制更加复杂,它的形成过程中不需要Dicer酶的参与。PiRNA是一类长度为25~35 nt的单链非编码小RNA,因为需要与PIWI亚家族的成员蛋白结合才能发挥作用而被命名为PIWI蛋白相互作用RNA(Piwi-interacting RNA,piRNA)[70,71]。piRNA最早是在哺乳动物生殖细胞中被发现的,目前也被认为主要存在于动物的生殖细胞中,所以现阶段关于piRNA的研究内容也都围绕生殖生理方面。编码piRNA的基因呈现不连续的簇状分布所以被称为piRNA簇,可以单向或双向转录生成pre-piRNA[72]。如图3所示,果蝇生殖细胞中成熟的piRNA的形成需要经过两种途径的协同作用,分别是初级加工途径和被称为“乒乓循环”的次级加工途径[73]。pre-piRNA被转运到细胞质后与AGO3结合,经Zuc核酸内切酶切割后变成piRNA中间体,然后与PIWI蛋白家族中的Aub结合,被核酸酶剪切成最终的长度后进入乒乓循环;PIWI-piRNA复合体识别并切割与piRNA互补的mRNA,使之变成新的piRNA,新piRNA与AGO3蛋白结合后继续切割与之互补的mRNA,如此循环往复,piRNA的含量增加,含有与piRNA互补序列的mRNA的含量减少,直到被完全破坏[74]。
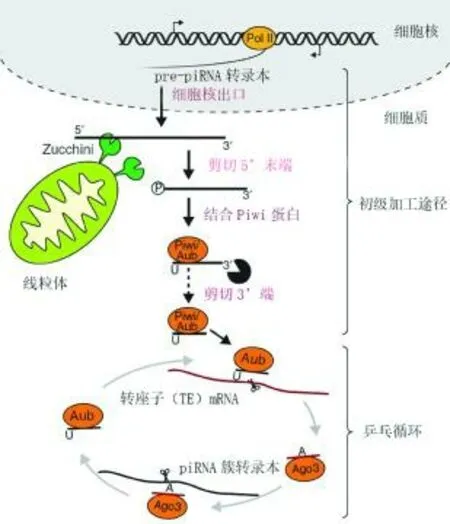
图3 果蝇piRNA的发生途径[75]Fig.3 The piRNA pathway in the [75]
4.2 piRNA对母源mRNA清除的影响
目前关于piRNA的探究普遍集中在雄性配子的发育与男性不育的治疗方面,对它在早期胚胎中的影响尚不清楚,但有一些现象反映piRNA也能参与母源因子的清除。Ohnishi等[76]利用高通量测序分析小鼠减数第二次分裂中期的卵母细胞和不同阶段的植入前胚胎的RNA表达水平,推测piRNA可能会沉默一些妨碍早期胚胎重编程的逆转录转座子。Wei等[77]通过下一代测序技术发现斑马鱼的256-细胞期胚胎有高水平的piRNA,这种表达模式可能与母源因子的降解相关。Kawaoka等[78]分析了家蚕卵母细胞和胚胎的基因表达谱,发现受精卵中的piRNA发生了激烈的乒乓循环,推测piRNA可以通过沉默特定转座子的方式调节早期胚胎发育。埃及伊蚊胚胎ZGA发生前无tapiR1的表达,敲除该piRNA,则早期胚胎发育停滞,tapiR1的缺失会造成母源因子上调并破坏合子基因组转录[79]。Rouget等[80]发现果蝇早期胚胎中的piRNA可以与Smaug、CCR4等脱腺苷酸化酶复合体结合到母源基因Nanos的3'UTR区域促使其降解,通过这种方式来参与早期胚胎母源因子的降解。Barckmann等[81]在果蝇早期胚胎中发现了数百个可以与Aub蛋白结合的母源mRNA,在MZT期间这些mRNA都与PIWI-piRNA结合并被切割和降解;将胚胎中参与降解母源转录本的CCR4基因突变后piRNA的表达量随之上升,推测piRNA也可以通过降解母源因子来弥补CCR4缺失的不足。
5 展望
高通量测序和基因敲除技术的广泛应用逐渐揭开了sncRNAs的神秘面纱。不断有研究发现sncRNAs可以参与早期胚胎MZT过程中的母源因子清除,激发合子基因组的表达,但具体的作用机制还需要进一步探究。从sncRNAs水平上研究早期胚胎MZT的机制,将有助于获得早期胚胎发育机制的重要分子标记,为增加哺乳动物的繁殖潜力和提高后代存活率提供理论依据。

