油茶内生拮抗细菌的筛选、鉴定及防效
尚笑男,刘君昂,冯福山,周国英*
(1.中南林业科技大学,长沙 410004;2.人工林病虫害防控国家林业局重点实验室/森林有害生物防控湖南省重点实验室/经济林培育与保护教育部重点实验室,长沙 410004)
油茶Camelliaoleifera属于山茶科山茶属植物,与橄榄油、椰子、油棕榈并称为世界四大木本食用油料树种[1],在我国秦岭、淮河以南地区有大面积栽培种植产区[2]。其种子能够榨油,营养丰富,是一种优质的食用油原料,具有降血压、降血糖以及软化血管等多方面的作用[3]。除此之外,茶饼不但能作为农药,还能制成肥料,对病虫害起到一定的防治作用[4]。然而,随着油茶病害的发生和危害逐渐增强,油茶产业化发展受到了一定程度的制约[5],关于油茶病害的报道已达50多种[6-13],包括油茶炭疽病Collectotrichum gloeosporioides、油茶根腐病Fusariumproliferatum、油茶软腐病Agaricodochiumcamelliae、油茶叶枯病PestalotiopsesMicrospora等,其中油茶炭疽病最为普遍发生。因此,深入研究油茶病害的防治措施,对提高油茶的产量有着重要的意义。
目前,对于油茶病害的防治仍然以化学防治手段为主,容易引起一系列的“3R”问题,包括抗性、残留和再猖獗。与此同时,还会造成人畜伤害、环境污染、油茶产量降低等多方面的问题。因此,油茶病害的生物防治变得尤为重要。微生物菌剂具有高效、低毒低残留、对环境友好等优点,所以利用微生物防治油茶病害是实现油茶病害绿色可持续控制的有效手段。近年来,分离筛选出有益微生物制备微生物菌剂防治油茶病害的研究受到广泛关注,从油茶内分离出来的拮抗细菌以芽胞杆菌属Bacillus居多,如解淀粉芽胞杆菌Bacillusamyloliquefaciens、枯草芽胞杆菌Bacillussubtilis等[14,15],芽胞杆菌防治植物病害的机制主要是诱导植物产生抗病性[16],而且其可以形成芽胞,抵抗多种不良环境[17]。
我国微生物菌剂研究起步虽然相对较晚,但在微生物菌剂的研究和应用上依旧取得了一定的成果。但总体而言,我国对微生物菌剂的研究方面,主要集中在高效菌种的选育,在微生物菌剂的研制、开发和推广应用上依然不够完善。
本研究为油茶炭疽病的生物防治筛选生防菌,从湖南常德、湖北麻城、江西九江、河南信阳以及广东增城等地采集油茶健康叶片并进行拮抗菌的分离,选出拮抗菌株 HBMC−B05,结合菌落形态观察、部分生理生化特性观察以及16S rDNA基因和gyrA基因序列综合分析进行菌种鉴定,明确该菌为贝莱斯芽胞杆菌Bacillusvelezensis,这也是首次从油茶健康叶片中分离出贝莱斯芽胞杆菌HBMC−B05,然后测定贝莱斯芽胞杆菌对油茶病菌的抑制作用,最后对内生拮抗菌HBMC−B05和枯草芽胞杆菌Y13复配形成的复合菌剂BY10进行田间防效试验,以此为防治油茶病害生防菌剂的制备提供一定的理论基础和数据,也为田间油茶绿色防控提供技术支撑。
1 材料与方法
1.1 植物材料
来自湖南常德、湖北麻城、江西九江、河南信阳以及广东增城等地的普通油茶品种的健康叶片。
1.2 供试病原菌
果生炭疽菌C.fructicola、暹罗炭疽菌Colletotrichumsiamense、胶孢炭疽菌Colletotrichum gloeosporioides、山茶炭疽菌Colletotrichumcamelliae以及油茶根腐病菌F.proliferatum、油茶软腐病菌A.camelliae、油茶叶枯病菌P.microspora、彩绒革盖菌Coriolusversicolor以及枯草芽胞杆菌Y13均中南林业科技大学南方人工林病虫害防控国家林业局重点实验室森林微生物菌种保藏中心提供。
1.3 供试培养基
NA(Nutrient Agar)培养基:蛋白胨10 g,牛肉膏5 g,NaCl 1.5 g,琼脂20 g,蒸馏水1000 mL,pH 7.0~7.2,用于油茶内生拮抗菌的分离纯化。
种子培养基:胰蛋白胨8 g,酵母粉4 g,葡萄糖4 g,NaCl 6 g,KCl 0.06 g,MgC12·6H2O 0.5 g,蒸馏水1000 mL,pH 7.2~7.4,用于内生拮抗菌种子液的培养。
LB(Luria-Bertani)培养基:胰蛋白胨10 g,酵母浸粉5 g,NaCl 5 g,蒸馏水1000 mL,pH 7.2~7.4,用于内生拮抗菌发酵培养。
PDA(Potato-dextrose agar)培养基:葡萄糖20 g,马铃薯200 g,琼脂18 g,蒸馏水1000 mL,pH自然,用于植物病原真菌的培养。
1.4 油茶叶片内生细菌的分离和纯化
采用组织块分离法[18]进行分离纯化。将叶片冲洗干净后,在紫外工作台上切取4 mm2的叶片组织块,然后置于75%乙醇中浸泡1 min,0.1%升汞中消毒30 s,75%乙醇中浸泡30 s,并在无菌水中漂洗4次后,将其与10 mL无菌水和已灭菌的石英砂一起研磨成匀浆,静置30 min。将匀浆10倍系列稀释并涂抹于NA培养基上,28 ℃恒温培养箱中培养24 h,观察菌落进行纯化。试验共分离5个批次,以组织消毒后用无菌水冲洗的第4次冲洗液为CK,涂板3 d后若CK中无菌落,研磨液中长出的菌落则可能是内生菌,进行纯化培养。
1.5 拮抗菌株的初筛
采用平板对峙法[19]进行初筛,在PDA培养基的正中心位置处接入油茶炭疽病菌胶孢炭疽菌C.gloeosporioides的新鲜菌饼(直径d=6 mm),以病原真菌为中心,以“△”型分布的3个顶点位置处接入上述分离的细菌,每个处理设置3组平行重复试验,其中对照组为只接入病原真菌菌饼的平板,将所有试验的培养皿置于28 ℃下恒温培养。当对照组病原菌的菌落直径长到培养皿直径的3/4时,利用十字交叉法测量病原真菌菌落的直径大小,运用不规则图形面积计算法测量处理组面积,然后据此计算生长抑制率。抑菌率(%)=(对照组菌落面积-处理组菌落面积)/对照组菌落面积×100。
1.6 拮抗菌株的复筛
对初筛过程中抑制率≥50%的菌株采用发酵法[20]进行复筛。首先将初筛过程中选定的拮抗菌分别接入种子培养基中,28 ℃、180 r/min振荡培养18 h,制成拮抗菌种子液;然后按10%的比例将种子液接入到LB液体培养基中,28 ℃、180 r/min振荡培养2 d后,取适量菌液于离心管中,4 ℃、10000 r/min离心20 min,用0.22 μm的微孔滤器过滤上清液,得到无菌发酵液。取无菌发酵液100 μL涂布于PDA 培养基表面,接入胶孢炭疽菌的新鲜菌饼(直径d=6 mm)。以只接病原真菌的平板作为对照,抑菌率的计算方法同1.5。
1.7 目标菌株菌落形态及生理生化特征鉴定
将菌株HBMC−B05接种到NA平板上,28 ℃条件下恒温培养48 h后进行革兰氏染色试验,观察菌落形态及染色情况。菌种鉴定试验包括运动性测试、明胶液化、糖类水解以及盐类和pH耐受性测定等。根据《伯杰氏细菌鉴定手册》[21]与《常见细菌系统鉴定手册》[22],对筛选出来的拮抗菌株进行初步鉴定。
1.8 目标菌株分子鉴定
用TIANamp Bacteria DNA Kit提取目标菌株的DNA,参照杨胜清等[23]利用16S rDNA基因的通用引物对HBMC−B05的基因组进行PCR扩增,并且参照喻国辉等[24]以促旋酶(gyrase)A亚单位基因(gyrA)[25]的引物对HBMC−B05的基因组进行PCR扩增(两组基因片段的PCR反应反应程序及条件见表1)。PCR产物委托湖南擎科生物技术有限公司进行测序。根据基因测序结果,在NCBI官方网页上通过Nucleotide Blast程序从GenBank数据库中调出同源性高的相关菌株的基因序列,利用MEGA X软件进行序列多重比对后,采用N−J法构建系统发育进化树,来确定菌株HBMC−B05的分类地位。
表1 选择的基因引物和PCR程序Table 1 Sequence of the primers and PCR program used in this study
1.9 HBMC-B05发酵液的抑菌活性测定
采用平板对峙法,测定HBMC−B05对8种供试病原真菌的抑制作用,在PDA培养基平板的中心位置分别接入上述生长旺盛的8种供试病原真菌菌饼(直径d=6 mm),以病原真菌为中心,以等边“△”型的3个顶点位置处分别接种20 μL HBMC−B05的发酵液,以不接种HBMC−B05发酵液为对照组,每个处理设3组平行重复试验,置于28 ℃恒温培养箱中培养,抑菌率的计算方法同1.5。
1.10 复合菌剂的田间防效
挑取贝莱斯芽胞杆菌HBMC−B05和枯草芽胞杆菌Y13的单菌落,置于20 mL各自最优培养基中,28 ℃、160 r/min振荡培养18 h,获得种子液,取5%种子液置于50 mL发酵培养基中,28 ℃、160 r/min振荡培养18 h获取发酵液,将HBMC−B05和Y13发酵液按照体积比1:1混合,加入润湿剂、分散剂、崩解剂、粘结剂复配成BY10水分散粒剂。选取海南省澄迈县国营澄迈林场一年生油茶幼苗为研究对象,选取面积为2 m2(长2 m×宽1 m)标准地,共15个,标准地之间设置保护行。将复合菌剂稀释为100、300、500倍的稀释液,稀释方法分别为1 g BY10 水分散粒剂中加入100、300、500 mL水。9月15日初次喷药,每隔10 d以喷洒和灌根的方式进行药物施用,共施用4次,由于油茶苗大小存在差异,每次药液的喷洒量以整株油茶叶片全部润湿为宜。以施用清水为CK,施用1000倍多菌灵稀释液为对照。于10月25日在每个标准地随机选取5株油茶,进行叶片病情指数及发病率的调查,油茶叶部病害分级标准表见表2,病情指数=(∑各级病叶数×相对级数值)/(调查总叶片数×最高级数值)×100,防治效果(%)=(对照区病情指数-处理区病情指数)/对照区病情指数×100。
表2 油茶叶部病害发病分级标准Table 2 Disease classification standard for C.oleifera
2 结果与分析
2.1 内生菌的分离与筛选
分离出具有抑菌效果的内生细菌11株,经抑菌活性的初筛、复筛后,获得5株对胶孢炭疽菌具有较好拮抗效果的菌株(表 3)。其中抑菌率最大的是HBMC−B05,其初筛抑菌率达到 70.80%,复筛抑菌率达到49.60%,考虑其可应用性,将其选作进一步研究的对象。
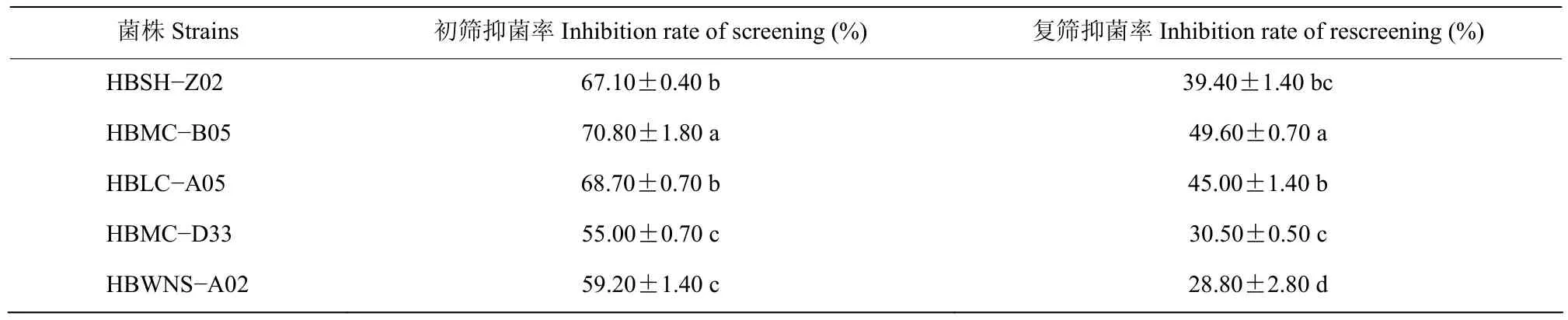
表3 拮抗菌对胶孢炭疽菌的拮抗活性Table 3 Antifungal activity of strains against C.gloeosporioides
2.2 HBMC-B05菌落形态及生理生化特征鉴定
在NA培养基上28 ℃培养28 h后,HBMC−B05的菌落为乳白色,不透明,边缘不整齐,表面不光滑,中间有凸起,而且后期表面有褶皱,质地黏稠(图1A)。经革兰氏染色后观察后发现该菌株为革兰氏阳性,菌体呈杆状,长2.80~6.20 μm,宽约0.80 μm,其芽胞呈圆柱状(图1B−a),长 1.00~2.40 μm,宽约 0.60 μm(图 1B−b)。
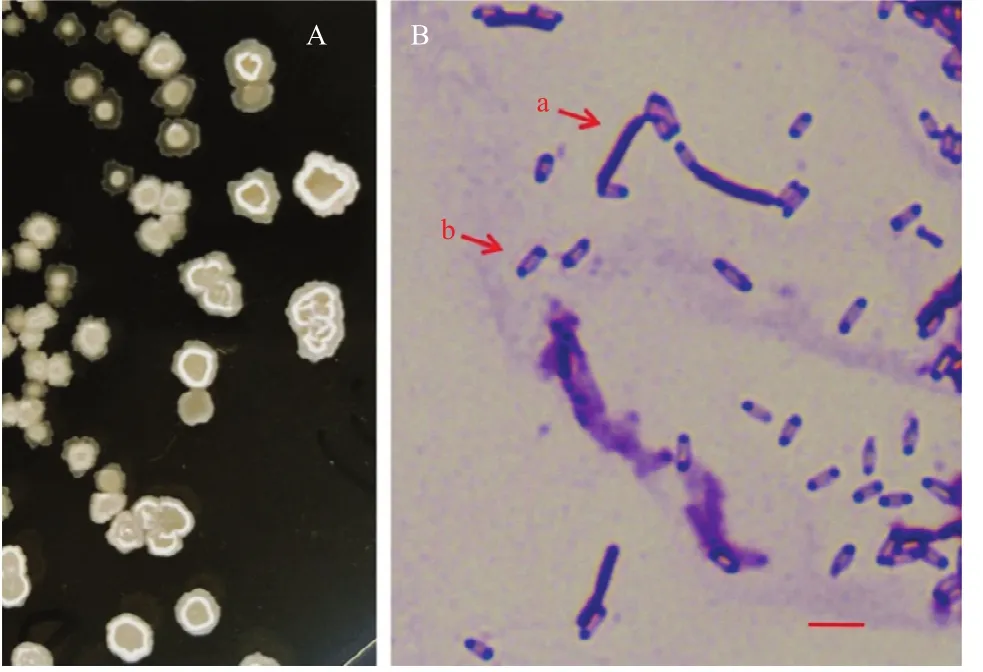
图1 菌株HBMC-B05的单菌落形态(A)及其在生物显微镜下的形态(B)Fig.1 The colony morphology of strain HBMC-B05 (A) and under an Biomicroscope (B)
该菌株的部分生理生化特性如表4所示,可液化明胶、水解淀粉、硝酸盐还原,可利用柠檬酸盐、葡萄糖、D−海藻糖、D−甘露糖、蔗糖、D−甘露醇和D−山梨醇,且V−P试验呈阳性,即可分解葡萄糖,同时可在高盐、酸性、碱性条件下生长,但无法产生H2S,根据该菌株的形态特征和生理生化特性,可以初步鉴定该菌株隶属于芽胞杆菌属Bacillus。
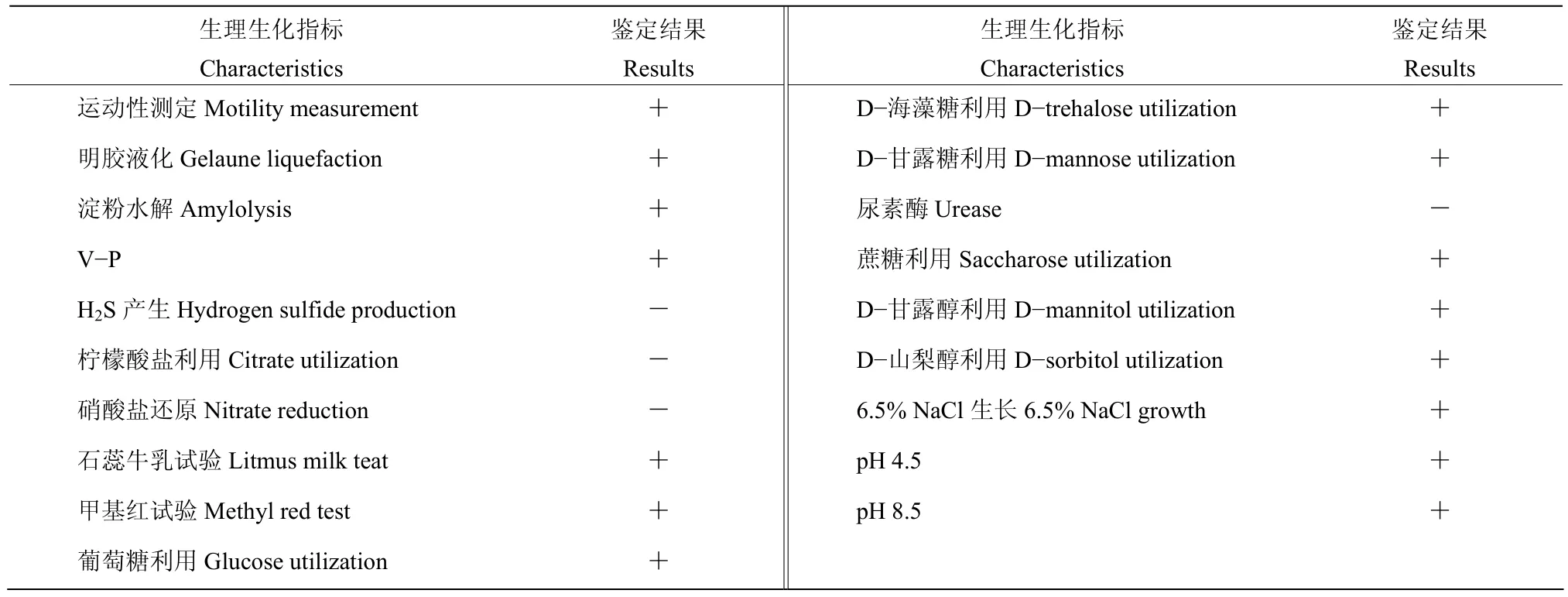
表4 菌株HBMC-B05部分生理生化特征Table 4 The physiological and biochemical characteristics of strain HBMC-B05
2.3 HBMC-B05的分子鉴定
将扩增的16S rDNA基因片段测序后得到全长1423 bp的序列,提交到GenBank,登录号为MW888339,并将该菌株HBMC−B05的16S rDNA基因序列进行比对,结果显示与该菌株的16S rDNA同源性较高的菌株,均属于芽胞杆菌属。根据16S rDNA基因进行系统发育分析结果显示HBMC−B05与贝莱斯芽胞杆菌B.velezensis(KY962350)和(MH244327)聚在一支,如图2所示,分支支持率为97.00%。为了进一步更加准确的鉴定,将扩增的gyrA基因片段测序后得到全长 912 bp的序列,提交到 GenBank,登录号为MW980086,与Rooney等[23]公布的741~939 bp长度范围结果相符。并将该菌株HBMC−B05的gyrA基因序列进行Nucleotide Blast分析,结果显示与该菌株的gyrA基因同源性较高的菌株,均属于芽胞杆菌属。根据gyrA基因进行系统发育分析结果显示HBMC−B05与贝莱斯芽胞杆菌(CP021495),贝莱斯芽胞杆菌(MK805131.1)和贝莱斯芽胞杆菌(CP032506)聚在一支,如图3所示,且分支支持率为100%。因此,再结合上述形态特征与生理生化特性,可以鉴定菌株HBMC−B05为贝莱斯芽胞杆菌。
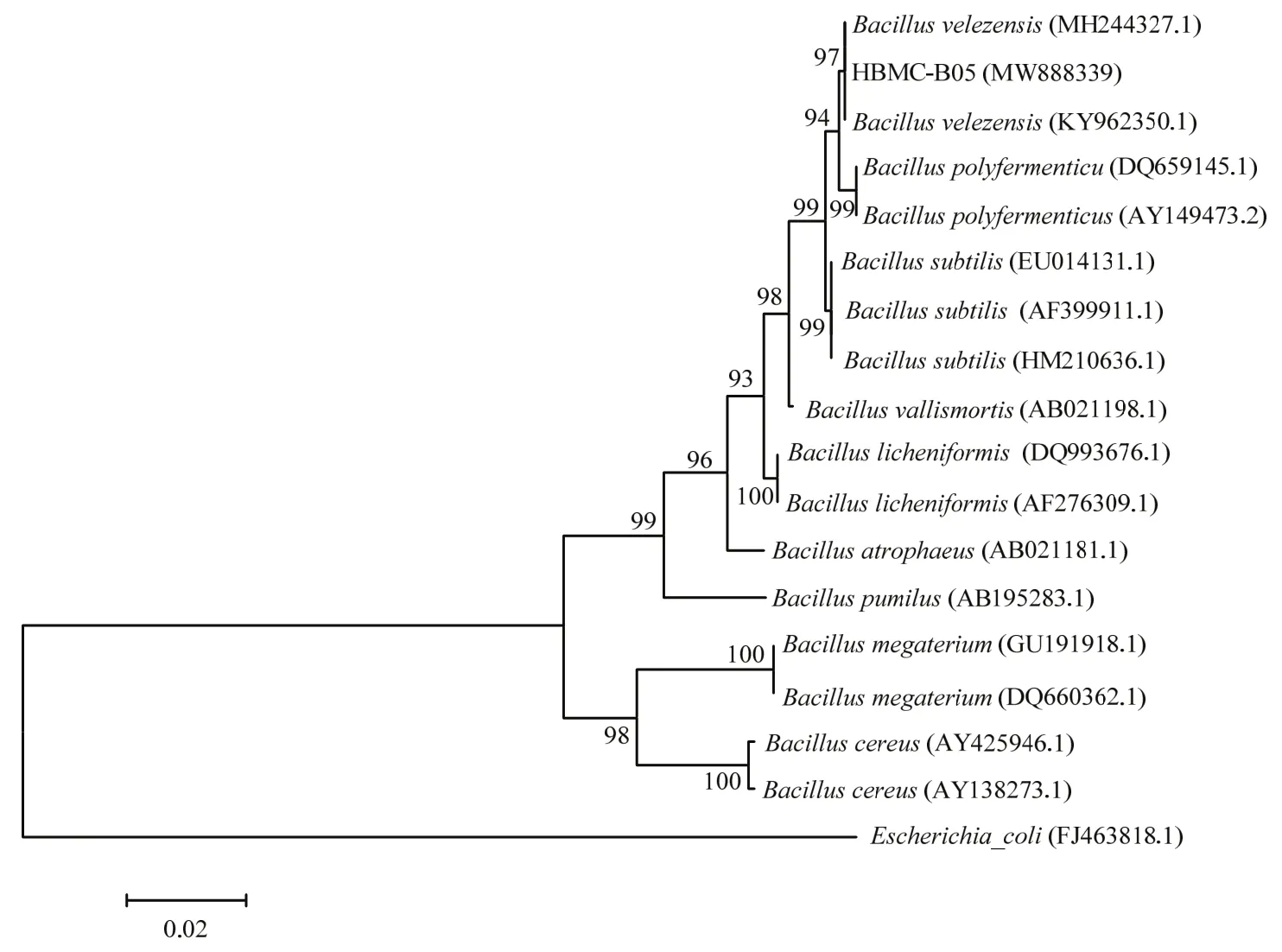
图2 基于16S rDNA基因序列构建菌株HBMC-B05的系统发育树Fig.2 Phylogenetic tree of strain HBMC-B05 based on the sequence of 16S rDNA
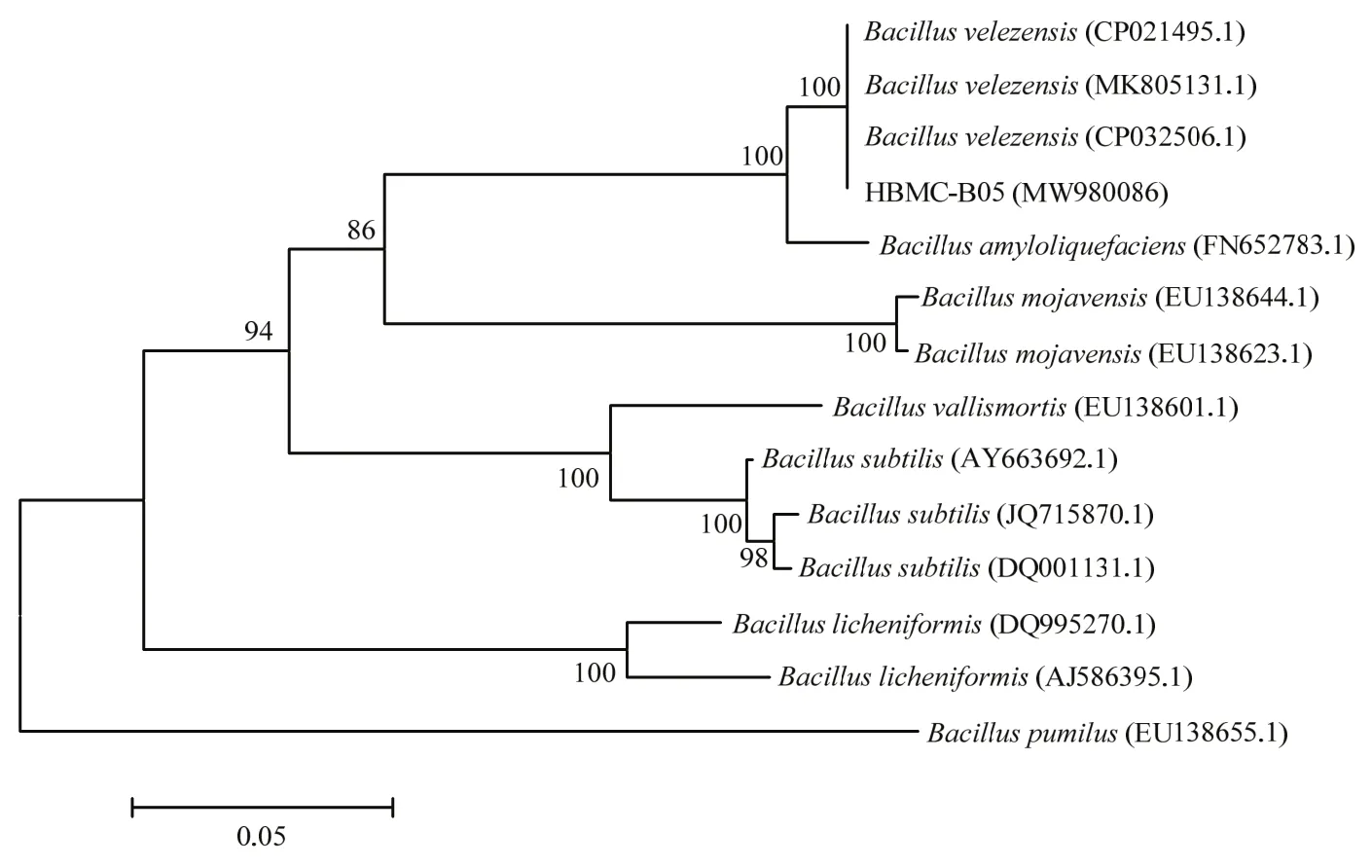
图3 基于gyrA基因序列构建菌株HBMC-B05及其他相关菌株的邻接法系统发育树Fig.3 Phylogenetic tree of strain HBMC-B05 based on the sequence of gyrA gene
2.4 HBMC-B05对病原真菌的抑制作用
平板对峙培养法测定结果表明,菌株 HBMC−B05 发酵液对 8 种供试植物病原真菌生长均有一定抑制作用,但抑菌作用存在差异(图4、5),其中抑菌效果最好的是果生炭疽菌,抑菌率可达到81.31%,对另外3种油茶炭疽病病原菌抑菌率可达到70.00%以上,对其他致病菌也具有良好的抑菌效果。
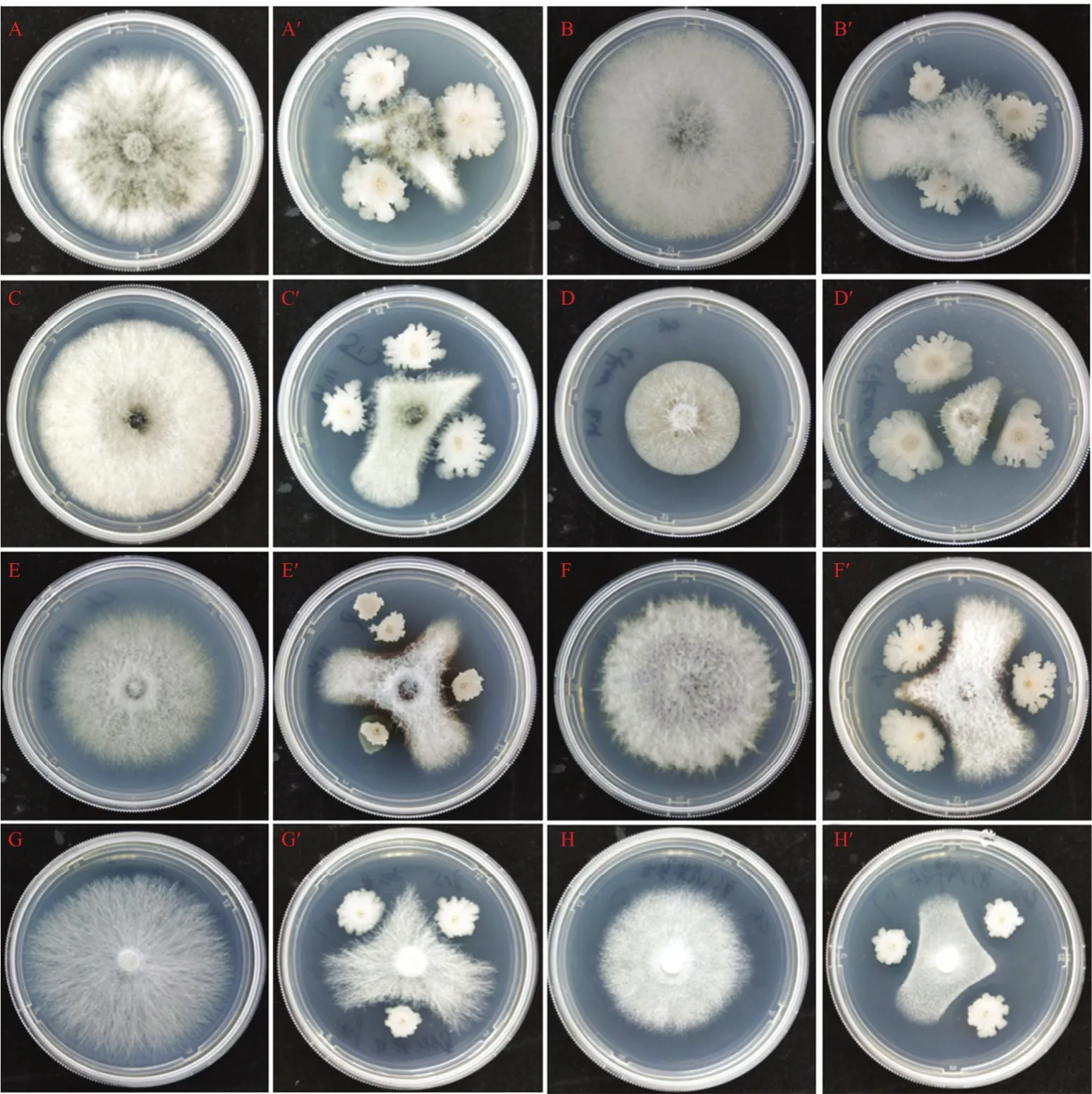
图4 HBMC-B05发酵液对多种植物病原真菌的抑制效果图Fig.4 Impression drawing of fermentative liquid of HBMC-B05 against different fungal phytopathogens
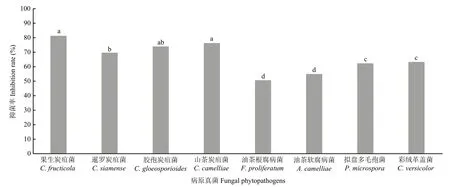
图5 HBMC-B05发酵液对多种植物病原真菌的抑制率Fig.5 Inhibition rate of fermentative liquid of HBMC-B05 against different fungi pathogens
2.5 复合菌剂BY10的田间防效
田间试验结果表明,在施药40 d后,CK组的病情指数为7.58,而BY10复合菌所制成的微生物复合菌剂和多菌灵处理下的油茶病情指数明显降低,同时复合菌剂的防治效果随着稀释倍数的增加而下降,其中BY10复合菌剂稀释至100倍后施用的防效较好,达到了59.05%,说明田间进行该复合菌剂的施用能够起到很好的预防和控制油茶病害发生的作用
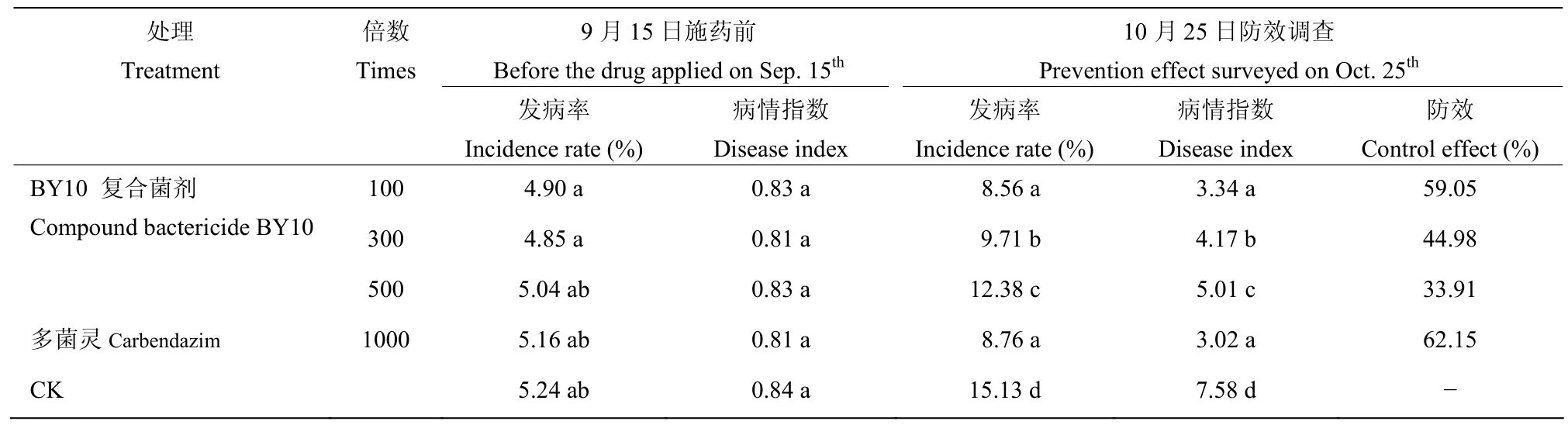
表5 复合菌BY10水分散粒剂对油茶病害的防治效果Table 5 Control effect of WDG of compound bacteria BY10 on disease of C.oleifera
3 讨论
近年来,油茶病害的成灾已经成为了油茶产业化发展的瓶颈,化学防治带来的一系列问题,使得可以诱导油茶产生抗病性的植物内生菌的研发使用受到广泛的关注。本试验从不同地区的健康油茶叶片中分离出具有较强抑菌效果的内生细菌5株,其中抑菌活性最好的是从湖北省麻城市沙河村油茶示范实验基地的健康植株叶片上分离出来的HBMC−B05。
HBMC−B05经过菌落形态和部分生理生化观测以及16S rDNA基因和gyrA基因序列综合分析被鉴定为贝莱斯芽胞杆菌B.velezensis,其分布广,适应力强,对环境要求简单,繁殖迅速。前人研究表明,贝莱斯芽胞杆菌具有一定的生防作用和良好的应用前景,贝莱斯芽胞杆菌SZAD1及其发酵液粗提物能显著抑制大丽轮枝菌菌丝的生长和孢子的萌发,对棉花黄萎病有很好的生物防治效果[26];贝莱斯芽胞杆菌NSZ−YBGJ001对草莓白粉病防效较好,叶部的防效超过85%,果实的防效超过70%[27];贝莱斯芽胞杆菌FZB42通过菌体接触对松材线虫亦有明显抑杀效果[28],但关于贝莱斯芽胞杆菌对油茶病害的生防研究还鲜有报道。同时贝莱斯芽胞杆菌还对白菜黑斑病致病菌芸薹链格孢Alternariabrassicae[29]、番茄灰霉病致病菌灰葡萄孢BotrytiscinereaPers.[30]等多种植物病害均有一定的抑制活性,说明贝莱斯芽胞杆菌具有广谱的抑菌活性,可以用作微生物菌剂的制备。
单一生防菌株抗菌谱窄、作用机理单一、竞争性弱,且对环境依赖性强,而复合微生物制剂因同时存在两种或两种以上有益菌,可有效扩宽抗菌谱并且提高生防菌的生态竞争性及防治效果[31]。生防菌有多种复配方式,国内研究者根据不同作用目的、不同环境要求、不同作用方式及不同类型生防菌相结合的方式对生防菌进行复配研究。例如可以拓宽抑菌谱的细菌组合,葛红莲[32]从辣椒、番茄和黄瓜根际土壤中筛选出5株对辣椒青枯病和黄瓜疫病有较好拮抗效果的细菌,将这5株菌进行复配制成复合菌剂AR98,其对黄瓜疫病和辣椒青枯病的防效均大于单一菌株的防效,且对辣椒种子的萌发和植株生长有一定的促进作用。因此,面对能够引起油茶炭疽病的多种致病菌问题,在生物防治的过程中更应该考虑到拮抗菌的复配问题
内生细菌普遍存在于植物体内, 与寄主植物在长期进化过程中建立了和谐联合关系, 是植物微生态系统中巨大而宝贵的资源库,而其对病害起到生防作用的关键在于其在植物体内的定殖效率[33],因此可以继续探讨相关影响因素,确保贝莱斯芽胞杆菌可以充分发挥其抑菌作用。本试验筛选出来的贝莱斯芽胞杆菌HBMC−B05对油茶多种病害有不同程度的抑制作用,为开发微生物农药提供新的拮抗菌生物资源,为油茶病害的生物防治扩充菌种资源,也为后期复合型菌剂的研发提供依据,但该菌株中起抑菌活性的物质及抑菌机理尚未明确,还需进一步的深入研究。

