腹腔镜与开腹手术治疗新辅助放化疗后中低位直肠癌疗效的Meta分析
杨少帅,马嘉阳,康大鹏,李文星
(1.山西医科大学,山西 太原,030001;2.山西医科大学第二医院普通外科)
结直肠癌是最常见的消化道肿瘤之一,据估算,2018年在中国新发病人数与死亡人数分别排在第3位(52万例)与第5位(24万例)[1]。目前治疗结直肠癌的方式仍以手术为主,传统治疗方式为开腹手术。随着手术器械的发展,腹腔镜技术具有创伤小、康复快等特点,在结直肠肿瘤根治术中的应用越来越广泛[2]。新辅助放化疗联合直肠癌根治术是局部晚期结直肠癌的标准治疗方法,全直肠系膜切除是标准术式[3]。多年的临床实践、大量针对结直肠癌的研究表明,与开腹手术相比,腹腔镜手术可达到类似甚至更好的肿瘤学效果[4-6]。患者术后康复较快,并发症较少,远期生存结果也可与开腹手术相媲美[7-9]。但中低位直肠癌患者,由于解剖位置特殊,术中不易触及或暴露肿瘤,尤其新辅助放化疗后或骨盆狭窄的肥胖患者,腹腔镜根治性切除的难度明显增加。目前关于中低位直肠癌经新辅助放化疗后行腹腔镜治疗是否值得推广仍存在争议。因此,本研究通过Meta分析系统评价腹腔镜治疗对新辅助放化疗后中低位直肠癌的临床疗效与安全性,旨在为腹腔镜手术治疗此类患者的临床应用提供参考。
1 资料与方法
1.1 检索策略 以中文检索词“直肠癌”“直肠肿瘤”“新辅助放化疗”“腹腔镜手术”,英文检索词“rectal cancer”“laparoscopy”“neoadjuvant chemoradiotherapy”及其自由词检索中国知网、万方及维普数据库、中国生物医学文献数据库、PubMed、Embase、Cochrane图书馆有关对比中低位直肠癌新辅助放化疗后行腹腔镜与开腹手术的中英文文献,检索时限为2010年1月至2020年10月。同时追溯已纳入文献的参考文献,补充可能的疏漏。
1.2 纳入与排除标准 纳入标准:(1)对比中低位直肠癌新辅助放化疗后行腹腔镜与开腹手术的中、英文文献;(2)文献纳入的患者需符合中低位直肠癌的诊断(肿瘤位置距肛缘10 cm以下);(3)至少含有一项需要分析的结局指标;(4)原始数据中的连续性变量应提供均数、标准差或中位数及数值范围[10]。排除标准:(1)非比较腹腔镜手术与开腹手术;(2)原始数据不完整或实验设计存在明显缺陷;(3)病例报告、综述、评论、会议论文及重复文献等。
1.3 文献筛选与数据提取 阅读文献的标题、摘要及全文,根据上述纳入与排除标准筛选出可纳入的文献,并提取文献中的数据。提取的资料及结局指标包括:第一作者、发表年限、地区、病例数、研究设计、手术时间、术中失血量、术中淋巴结切除数量、术后首次排气时间、术后第一次进食时间、保肛率、术后总并发症发生率、3年无病生存率、3年总体生存率等。文献中用中位数(四分位数)表示的指标数据,采用Hozo等提出的用中位数与四分位数预测其平均数与标准差的公式进行数据换算[10]。
1.4 文献质量评价 纳入的文献若为随机对照试验(randomized controlled trial,RCT),使用改良Jadad量表对文献进行质量评价,该量表是结合Cochrane评审量表及Jadad量表改良后制定而成,满分7分,文献分值≥4分时,则考虑此文献属于高质量文献[11-12]。若为非随机对照试验(non-randomized controlled trial,NRC),则按纽卡斯尔-渥太华量表对文献进行质量评价,总分≥6分时,考虑此文献质量较好[13]。以上步骤由2名研究者分别进行筛选汇总后,交换核对各自的筛查及评价结果。若遇分歧先进行讨论后,再请教上级专家仲裁。
1.5 统计学处理 应用RevMan 5.4软件对提取的相关结局指标进行Meta分析,采用I2检验与Q检验分析结局指标间的异质性,若I2≤50%或P≥0.1,则认为异质性较小,采用固定效应模型分析;若I2>50%或P<0.1,则认为异质性较大,采用随机效应模型分析;对二分类变量资料、连续变量资料分别利用比值比(odds ratio,OR)、加权均数差(weighted mean difference,WMD)合并计算统计量,各效应量均以95%可信区间(confidence interval,CI)表示,P<0.05时差异有统计学意义,分析结果以森林图表达,必要时进行敏感性分析检验结果的可靠性。
2 结 果
2.1 文献检索结果、基本特征及质量评价 通过计算机共检索到564篇文献,检索出的文献经过筛选后最终纳入8篇[14-21]。文献的筛选流程及结果见图1,其中2篇文献为RCT,6篇为NRC。本研究共纳入1 017例患者,其中腹腔镜组496例,开腹组521例,文献基本特征见表1,文献质量评分见表2、表3。
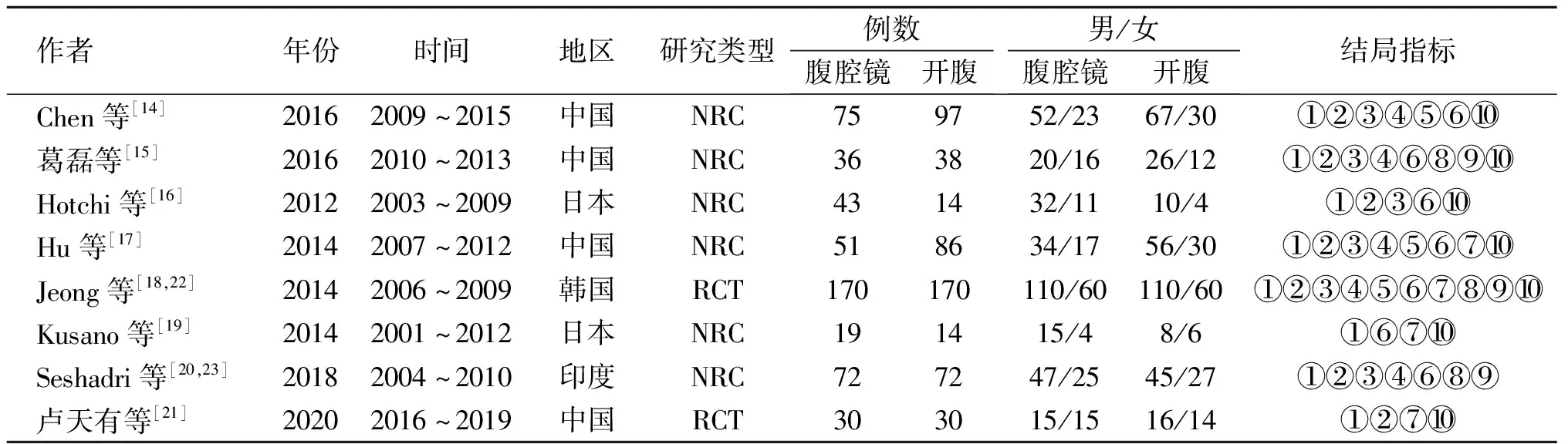
表1 纳入文献的基本特征
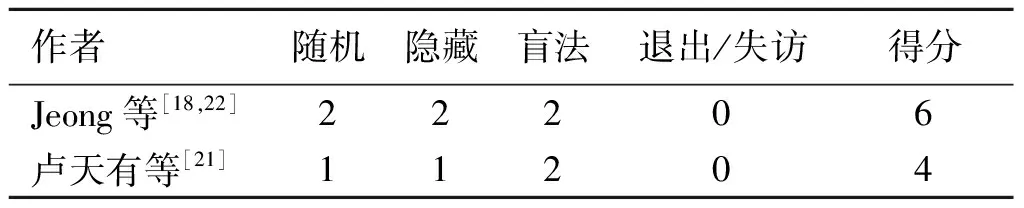
表2 改良Jadad量表质量评分(RCT)
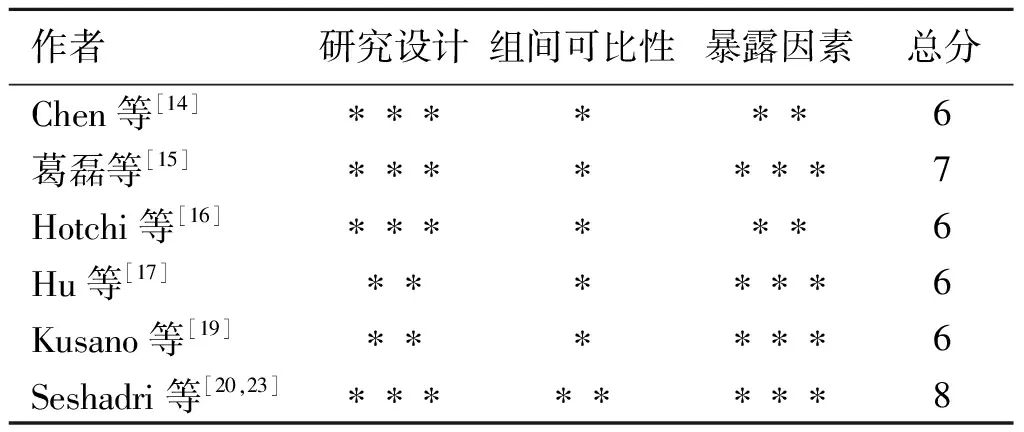
表3 纽卡斯尔-渥太华量表质量评分(NRCT)
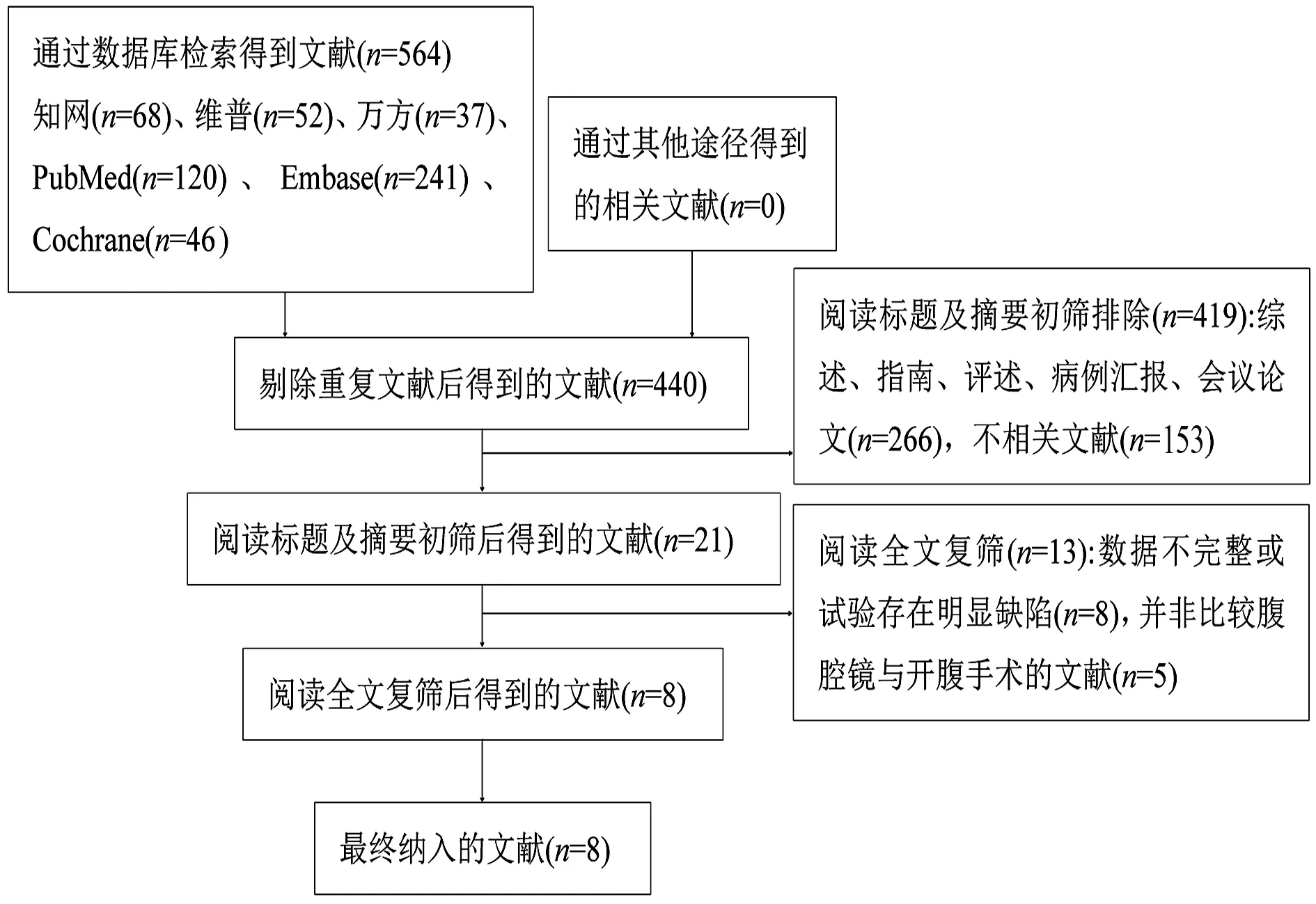
图1 文献筛选流程图
2.2 纳入研究的Meta分析结果
2.2.1 手术时间 纳入的8篇文献均比较了两组手术时间。数据异质性较高(I2>50%且P<0.1),采用随机效应模型进行分析,WMD=9.53,95%CI=-12.21~31.27,P=0.39,结果提示,两组手术时间差异无统计学意义,见图2。
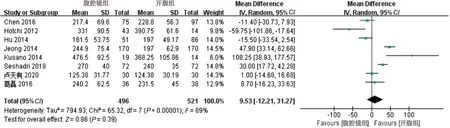
图2 两组手术时间的Meta分析
2.2.2 术中出血量 7篇文献比较了两组术中出血量。数据异质性较高(I2>50%且P<0.1),采用随机效应模型进行分析,WMD=-74.78,95%CI=-101.12~-48.44,P<0.00001,结果提示,腹腔镜组较开腹组术中出血量减少,见图3。
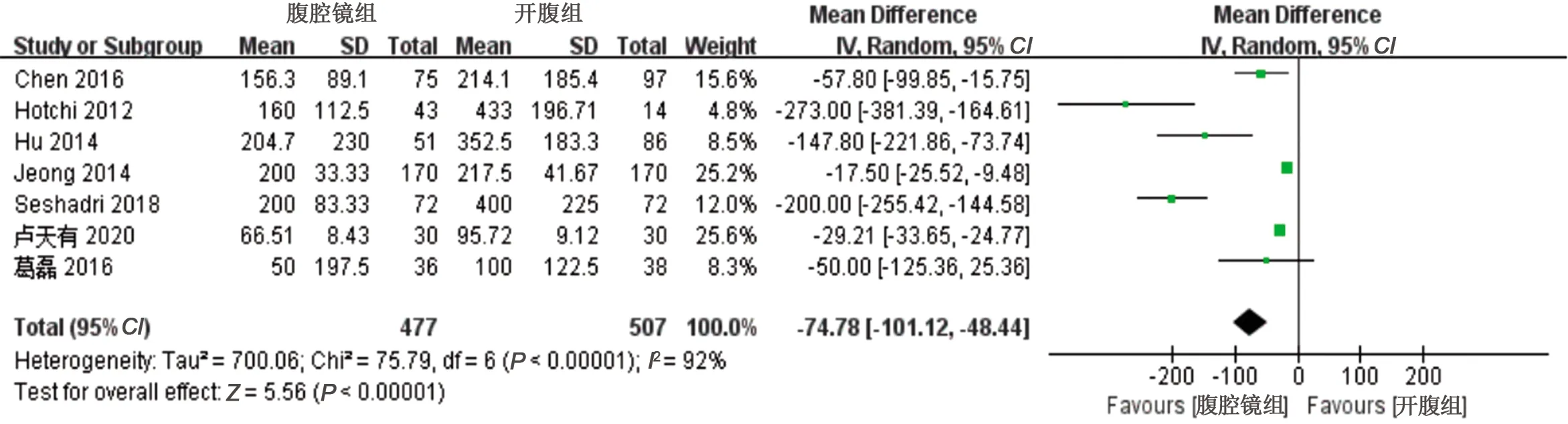
图3 两组术中出血量的Meta分析
2.2.3 术中淋巴结切除数量 6篇文献比较了两组术中淋巴结切除数量。数据异质性较高(I2>50%且P<0.1),采用随机效应模型进行分析,WMD=-0.30,95%CI=-1.29~0.70,P=0.56,结果提示,两组术中淋巴结切除数量差异无统计学意义,见图4。
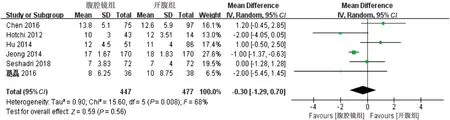
图4 两组术中淋巴结切除数量的Meta分析
2.2.4 术后首次排气时间 5篇文献比较了两组术后首次排气时间。数据异质性较高(I2>50%且P<0.1),采用随机效应模型进行分析,WMD=-0.76,95%CI=-1.01~-0.52,P<0.00001,结果提示,腹腔镜组较开腹组术后首次排气时间更早,见图5。
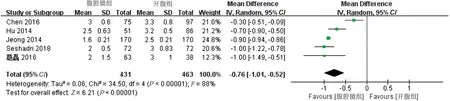
图5 两组术后首次排气时间的Meta分析
2.2.5 术后首次进食时间 3篇文献比较了两组术后首次进食时间。数据异质性较高(I2>50%且P<0.1),采用随机效应模型进行分析,WMD=-0.70,95%CI=-0.91~-0.49,P<0.00001,结果提示,腹腔镜组较开腹组术后首次进食时间更早,见图6。

图6 两组术后首次进食时间的Meta分析
2.2.6 术后住院时间 7篇文献比较了两组术后住院时间。数据异质性较高(I2>50%且P<0.1),采用随机效应模型进行分析,WMD=-2.71,95%CI=-4.54~-0.88,P=0.004,结果提示,腹腔镜组较开腹组术后住院时间更短,见图7。
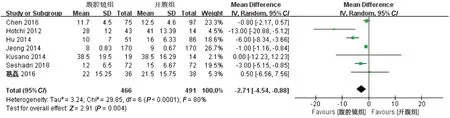
图7 两组术后住院时间的Meta分析
2.2.7 保肛率 4篇文献比较了两组保肛率。数据异质性较小(I2<50%且P>0.1),采用固定效应模型进行分析,OR=2.01,95%CI=1.33~3.03,P=0.001,结果提示,腹腔镜组较开腹组保肛率更高,见图8。
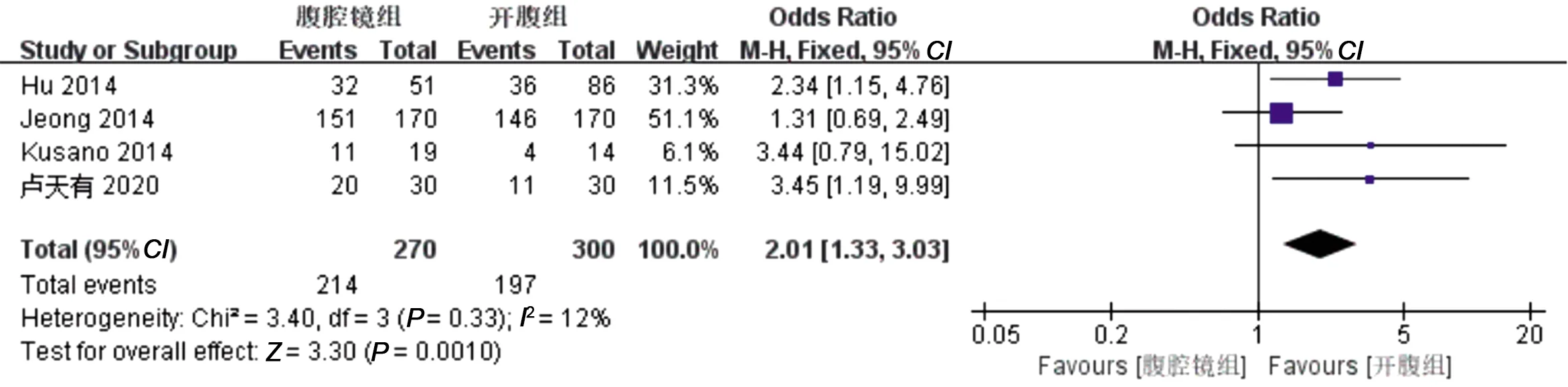
图8 两组保肛率的Meta分析
2.2.8 术后总并发症发生率 7篇文献对比了两组术后总并发症。两组数据异质性较小(I2<50%且P>0.1),采用固定效应模型进行检验,OR=0.59,95%CI=0.43~0.82,P=0.001,结果提示,腹腔镜组较开腹组术后总并发症少,见图9。
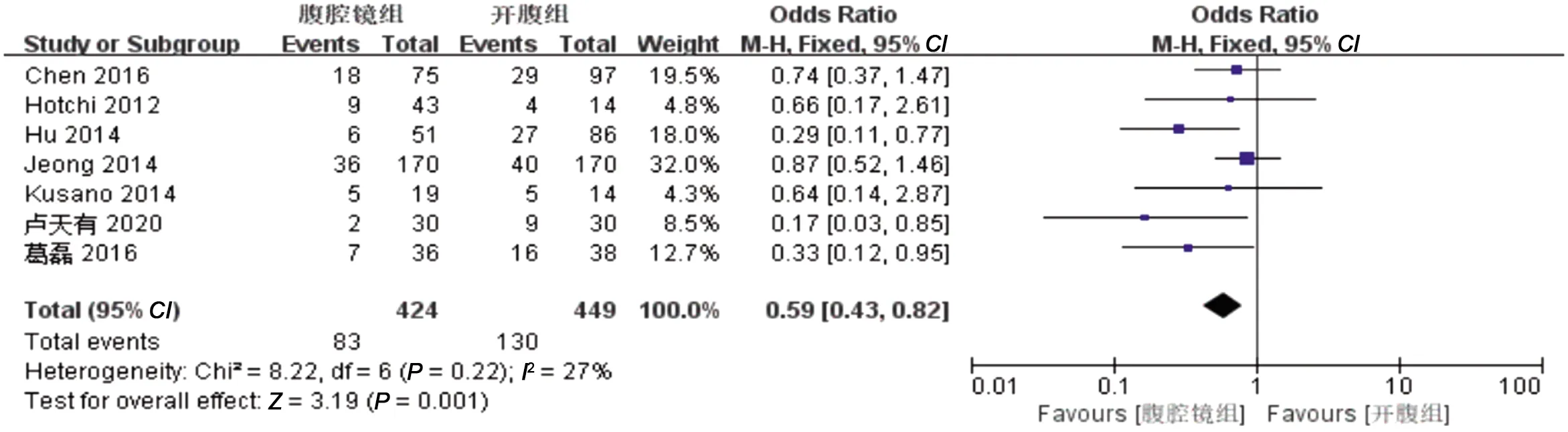
图9 两组术后总并发症发生率的Meta分析
2.2.9 3年无病生存率 3篇文献对比了两组术后3年无病生存率。两组数据无异质性(I2=0且P>0.1),采用固定效应模型进行检验,OR=1.54,95%CI=1.07~2.23,P=0.02,结果提示,腹腔镜组较开腹组术后3年无病生存率更高,见图10。
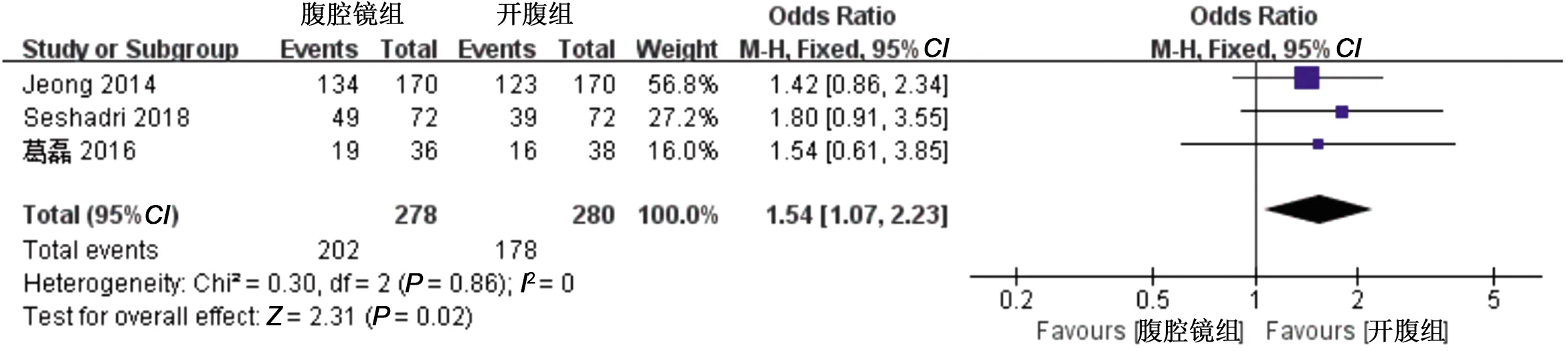
图10 两组3年无病生存率的Meta分析
2.2.10 3年总体生存率 3篇文献对比了两组3年总体生存率。两组数据异质性较小(I2<50%且P>0.1),采用固定效应模型进行检验,OR=1.23,95%CI=0.77~1.97,P=0.38,结果提示,腹腔镜组较开腹组术后3年总体生存率差异无统计学意义,见图11。
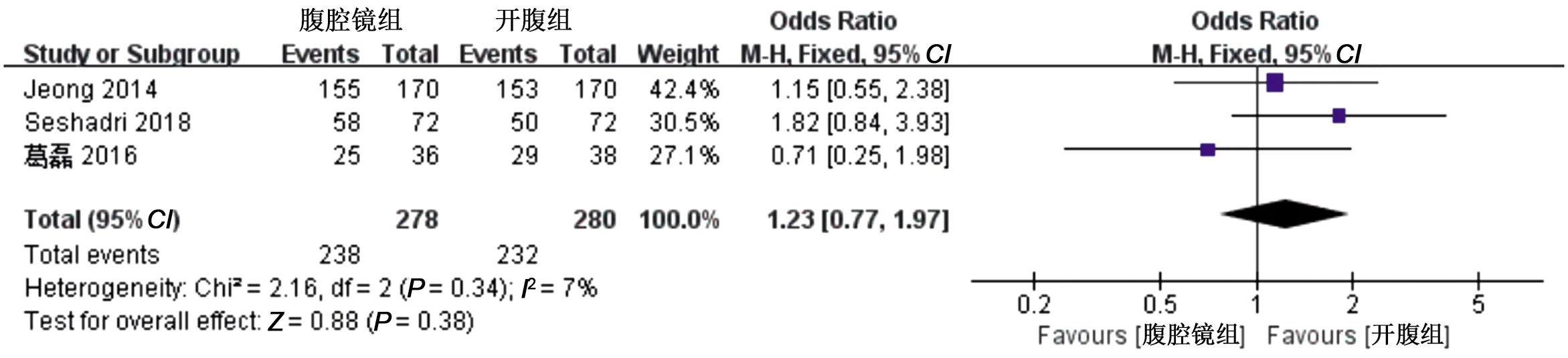
图11 两组3年总体生存率的Meta分析
2.3 敏感性分析 纳入的结局指标中,有6项异质性较高(I2>50%且P<0.1)﹐逐一剔除指标中的各项研究进行敏感性分析,其中手术时间、术中出血量、术中淋巴结切除数量、术后住院时间的研究数据结果稳定。术后首次排气时间[15]及术后首次进食时间[18]在分别剔除1项研究后,数据异质性检验结果变小(I2<50%且P>0.1),采用固定效应模型进行分析后,均未影响最终结果。
3 讨 论
作为最常见的消化道肿瘤之一,由于早期缺乏特异性症状,70%的直肠癌患者就诊时已处于局部晚期,单一治疗后预后较差[24]。由于人口老龄化及西方化生活方式的增加,癌症负担预计在接下来的几年仍会增加。中国癌症的发病趋势是结直肠癌、前列腺癌、女性乳腺癌的负担迅速增加,因此直肠癌的治疗会变得越来越重要[25]。新辅助放化疗联合根治术是进展期直肠癌的标准治疗方式。与术后放化疗相比,可明显降低局部复发风险,而且急性毒性反应更少[26]。新辅助放化疗可明显缩小瘤体,降低肿瘤分期,部分肿瘤甚至达到完全缓解,提高根治性切除率及保肛率[27]。据报道,局部晚期直肠癌行新辅助放化疗后保肛率提高,局部复发率降低[28]。虽然肿瘤体积缩小,使骨盆有更大的操作空间,但新辅助放疗会引起过多的组织水肿,导致手术平面丢失,从而带来更大的手术挑战,尤其狭窄的男性骨盆[29]。因此对腹腔镜直肠癌手术技术要求更高,腹腔镜手术是否优于开腹手术尚无明确定论。
本次Meta分析纳入了8项研究,以评估腹腔镜手术对于行新辅助放化疗后的中低位直肠癌患者的疗效及安全性,结果显示,两种术式的手术时间差异无统计学意义(P>0.05),腹腔镜手术难度高,手术时间很大程度上取决于术者的经验与技能,随着腹腔镜手术的广泛开展,术者经验的增加,腹腔镜手术时间会逐渐缩短[30]。纳入的数据显示,腔镜手术时间并未明显长于开腹手术,因为新辅助放化疗对于开腹手术时间的缩短也是有利的。腹腔镜手术的术中出血量更少(P<0.00001)、保肛率更高,可能因腹腔镜能高清放大,镜下解剖层次更清晰,并且拥有良好的照明系统,利于准确解剖与止血,也利于实现更低位的吻合。术中淋巴结切除数量差异无统计学意义(P>0.05),作为影响直肠癌预后的主要独立因素[31],辅助放化疗降低了淋巴结的获取数量,而且淋巴结更容易找到与切除[32],表明两种术式均能达到根治性切除的目的。
腹腔镜组术后首次排气时间(P<0.00001)、术后首次进食时间(P<0.00001)及术后住院时间(P=0.004)短于开腹组,因腹腔镜手术创伤小,术中对组织脏器的牵拉少,利于术后早期恢复肠蠕动,可促使患者更早开始进食,早期加强营养,提高免疫功能,从而缩短住院时间,而且术后疼痛轻利于早期恢复及早期下床活动。腹腔镜组术后总并发症发生率低于开腹组(P=0.001),腹腔镜下清晰的手术视野有助于术者更好地分辨病变组织周围的自主神经丛、输尿管、血管等精细结构,确保术中避开上述组织,利于降低术后并发症发生率[33]。对于术后远期效果,腹腔镜组3年无病生存率较高(P=0.02),但两组术后3年总体生存率差异无统计学意义(P>0.05),提示两种术式的长期疗效相似。
本Meta分析的局限性:(1)纳入的8篇文献中仅2篇是RCT,其余6篇为NRC,有的文献样本数量少,影响了本研究的质量。(2)纳入的文献不够全面。本研究仅纳入了中文与英文已发表的文献,未纳入机器人辅助腹腔镜手术的相关文献,可能造成选择偏倚。(3)对长期疗效进行描述的文献较少,如无病生存率、总生存率及生存质量等,因此需要更多高质量的大样本、多中心包含长期随访的RCT进行验证。(4)本研究纳入的文献存在一定的时间跨度,新辅助放化疗的方式、腹腔镜手术的发展及术者经验、技能对手术结果会产生一定影响,由此产生的偏倚是不可避免的。
综上所述,腹腔镜手术治疗新辅助放化疗后的中低位直肠癌技术上是安全、有效的,两种术式在远期疗效方面结果相似,而且腹腔镜手术具有术中出血量少、肠功能恢复快、术后总并发症少的优势,但考虑到纳入文献的局限性,未来仍需高质量、大样本的多中心RCT进行验证。

