松材线虫和拟松材线虫双重RPA检测研究
方圆 吴迅 林宇 王海燕 吴慧平 鞠玉亮
(1. 安徽农业大学植物保护学院/植物病虫害生物学与绿色防控安徽普通高校重点实验室,合肥 230036;2. 天津海关动植物与食品检测中心,天津 300461)
松材线虫(Bursaphelenchus xylophilus)是一种迁移性内寄生植物线虫,引起的松树萎蔫病,被称为松树的“癌症”[1]。松树萎蔫病是松林最严重的病害,已对东亚松林资源和松林生态系统造成毁灭性破坏,造成巨大经济损失[2-4]。我国于1982年首次在南京紫金山黑松上发现松材线虫[5],截至2018年,松材线虫已扩散至我国18个省的588个县级行政区域,累计致死松树达数十亿株,造成经济损失超数十亿元(国家林业和草原局2019年第4号公告)。伞滑刃属包含100多个描述种,其中,松材线虫与拟松材线虫(B. mucronatus)的亲缘关系最近[6]。拟松材线虫与松材线虫占据相同的生态位,两者在形态、生活习性、传播媒介、寄主等方面有许多相似的生物学特性[7]。传统观点认为拟松材线虫不致病或致病力较弱,但近年来大量研究表明拟松材线虫不同种群致病性存在明显分化,增加了松材线虫的检测和防控难度[8-9]。
松材线虫防控关键环节主要包括3个方面,即病害检疫与疫情监测、疫木除治和媒介昆虫防治,其中,病害检疫的核心内容是松材线虫的检测鉴定[10]。传统检测方法主要依据松材线虫的形态学特征,而松材线虫与拟松材线虫的形态特征极为相似,唯一不同点仅在于拟松材线虫雌虫尾端的尾尖突。然而,不同地理群体松材线虫雌虫尾尖突有较大变化,仅根据形态特征来判断,往往是不可靠的,可能导致错误诊断[11]。近二十年来,以聚合酶链式反应(PCR)为基础的分子检测技术在植物线虫分子诊断方面应用广泛[12-13]。常规PCR、PCR-RFLP、PCR-SCAR、双重PCR、实时荧光定量PCR等技术已大量应用于松材线虫和拟松材线虫的快速、同步或定量检测鉴定[14-18]。以PCR为基础的分子技术为松材线虫的检疫鉴定提供成熟可靠的技术,同时也存在对仪器设备、实验条件和实验人员专业背景要求高的特点。
近年来,恒温扩增技术在植物线虫检测方面受到越来越多的关注,其中,应用较多的主要为环介导恒温扩增技术(loop-mediated isothermal amplification,LAMP)和重组酶聚合酶扩增技术(recombinase polymerase amplification,RPA)。LAMP可在60-65℃条件下依靠3对引物完成对核酸的特异性扩增,已广泛应用于松材线虫、根结线虫、短体线虫、水稻干尖线虫等的分子检测[12,19-22]。RPA在30-42℃恒温条件下,利用1对长约30-35 bp的RPA引物在重组酶、单链结合蛋白(SSB)和链置换DNA聚合酶3种酶的作用下完成对核酸的指数扩增。RPA技术已用于松材线虫、根结线虫、菊花滑刃线虫的可视化快速检测[23-27]。Cha等[24]首次将RPA技术应用于植物线虫快速检测,并结合SYBR green I紫外显色法在30 min内实现对感病松木内松材线虫的可视化快速检测。
目前,尚未见双重RPA技术在植物线虫检测鉴定方面的应用,本研究以松材线虫和拟松材线虫核糖体DNA(rDNA)内转录间隔区ITS(internal transcribed space)为检测靶标,设计RPA引物,优化RPA检测体系,建立可同步检测松材线虫和拟松材线虫的双重RPA检测体系,为两种线虫的检疫鉴定提供技术支持。
1 材料与方法
1.1 材料
本试验供试15个线虫种群见表1,其中,松材线虫种群5个,拟松材线虫种群4个,豆伞滑刃线虫(B. doui)种群1个,食菌伞滑刃线虫(B. fungivous)种群1个,莱奴尔夫滑刃线虫(B. rainulfi)种群1个,菊花滑刃线虫(Aphelenchoides ritzemabosi)种群1个,水稻干尖线虫(A. besseyi)种群2个。所有线虫种群都已进行形态学和分子鉴定,并由安徽农业大学植物线虫实验室保存。
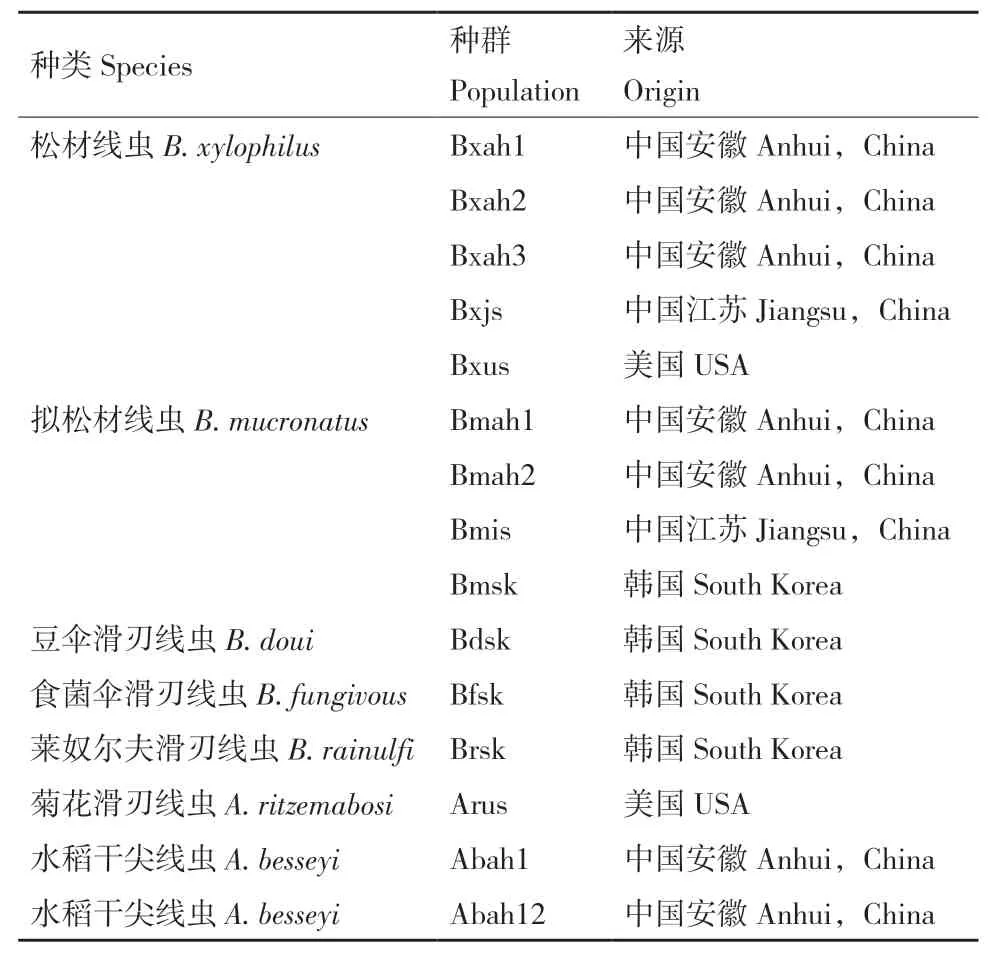
表1 供试线虫种群Table 1 Population information of nematodes
1.2 方法
1.2.1 单条线虫DNA提取 单条线虫DNA提取参考容万韬等[28]的方法,体式显微镜下挑取单条线虫,置于含8 μL ddH2O的载玻片中,用解剖针将线虫切断,加入2 μL裂解液,于56℃温育1 h,95℃处理10 min,离心取上清于-20℃保存备用。
1.2.2 双重RPA引物设计 RPA引物设计原则要求引物长30-35 bp,3'端富含GC,5'端含有嘧啶,扩增片段小于500 bp。依据www.twistdx.co.uk提供的RPA引物设计建议,对松材线虫和拟松材线虫ITS区差异序列进行分析,并对赵立荣等[14]所开发PCR引物进行改造,设计双重RPA引物Bx-rpa-F、Bm-rpa-F和Bxm-rpa-R(表2)。其中引物对Bx-rpa-F/Bxm-rpa-R用于检测松材线虫,Bm-rpa-F/Bxmrpa-R用于鉴定拟松材线虫,两者共用下游引物Bxm-rpa-R。RPA引物由生工生物工程(上海)股份有限公司合成。
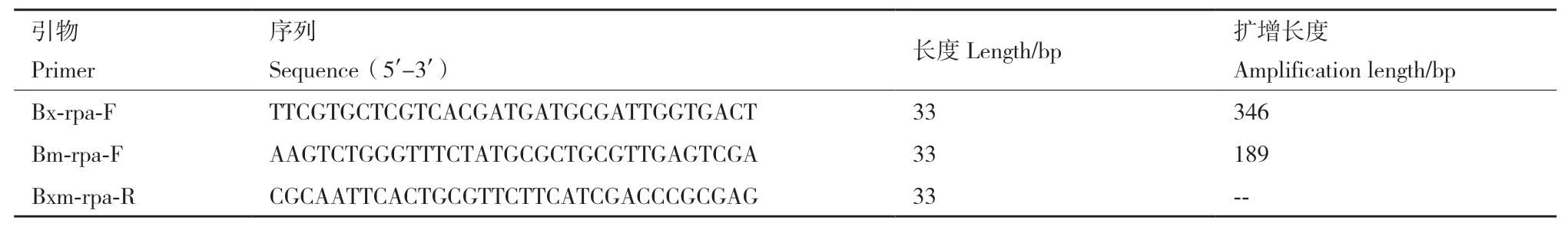
表2 用于双重RPA的引物及其序列Table 2 Primers and their sequences for duplex-RPA
1.2.3 双重RPA扩增 RPA扩增反应参照TwistAmp Basic Kit(TwistDx Limited,Cambridge,UK)操作说明进行,RPA扩增体系为50 μL。将2.4 μL PRA引物(10 μmol/L),2 μL模板DNA,29.5 μL TwistAmp rehydration buffer,11.2 μL ddH2O于反应管中充分混匀。加入2.5 μL MgAc(280 nmol/L)启动RPA反应,于37℃水浴30 min。反应结束后,用SanPrep PCR纯化试剂盒(Sangon Biotech,China)纯化RPA产物,并在2%琼脂糖凝胶上电泳检测。
1.2.4 双重RPA反应条件优化 为确定双重RPA的最佳反应条件,对反应体系中RPA引物浓度配比进行优化。在50 μL反应体系中,松材线虫和拟松材线虫DNA提取液按1∶1配比作为模板,设置不同引物浓度配比进行RPA反应,即10 μmol/L引物Bx-rpa-F、Bm-rpa-F、Bxm-rpa-R分别按2.4∶0∶2.4、2.1∶0.3∶2.4、1.8∶0.6∶2.4、1.5∶0.9∶2.4、1.2∶1.2∶2.4、0.9∶1.5∶2.4、0.6∶1.8∶2.4、0.3∶2.1∶2.4、0∶2.4∶2.4 μL的量添加。
1.2.5 常规PCR检测 常规PCR反应体系为25 μL,具体为1 μL模板DNA,10 μmol/L正反向引物各0.5 μL,12.5 μL×TaqPCR MasterMix,ddH2O补足至25 μL。PCR反应程序:94℃预变性3 min;94℃变性30 s,58℃退火30 s,72℃延伸30 s,35个循环;72℃延伸10 min。扩增产物在2%琼脂糖凝胶上电泳检测。1.2.6 双重RPA特异性和灵敏度分析 选取表1所列15个线虫种群,提取单条线虫DNA,检测Bxrpa-F、Bm-rpa-F、Bxm-rpa-R用于松材线虫与拟松材线虫双重RPA检测的特异性。同时,以ddH2O为阴性对照,试验重复3次。分别制备松材线虫和拟松材线虫大量线虫DNA提取液和单条线虫DNA提取液进行双重RPA灵敏度检测。单条线虫DNA稀释至20 μL,分别取2 μL(即初始浓度为1/10条线虫DNA),按10倍梯度稀释法分别稀释101、102、103、104、105倍。取2 μL稀释液分别进行RPA扩增,检测Bx-rpa-F/Bm-rpa-F/Bxm-rpa-R对松材线虫和拟松材线虫的检测灵敏度。此外,取相同稀释液进行PCR扩增反应,比较RPA与PCR的检测灵敏度。
1.2.7 双重RPA鉴定松木样品中松材线虫与拟松材线虫 为测试双重RPA的实用性,分离采集自安徽省松材线虫疫区的9份松木样品中的线虫进行双重RPA检测(表3)。松木样品中线虫DNA的提取参考Kikuchi等[12]的方法,DNA提取液用ddH2O稀释至100 ng/μL,在-20℃保存备用。此外,通过镜检的方法确认并鉴定松木样品中松材线虫与拟松材线虫。
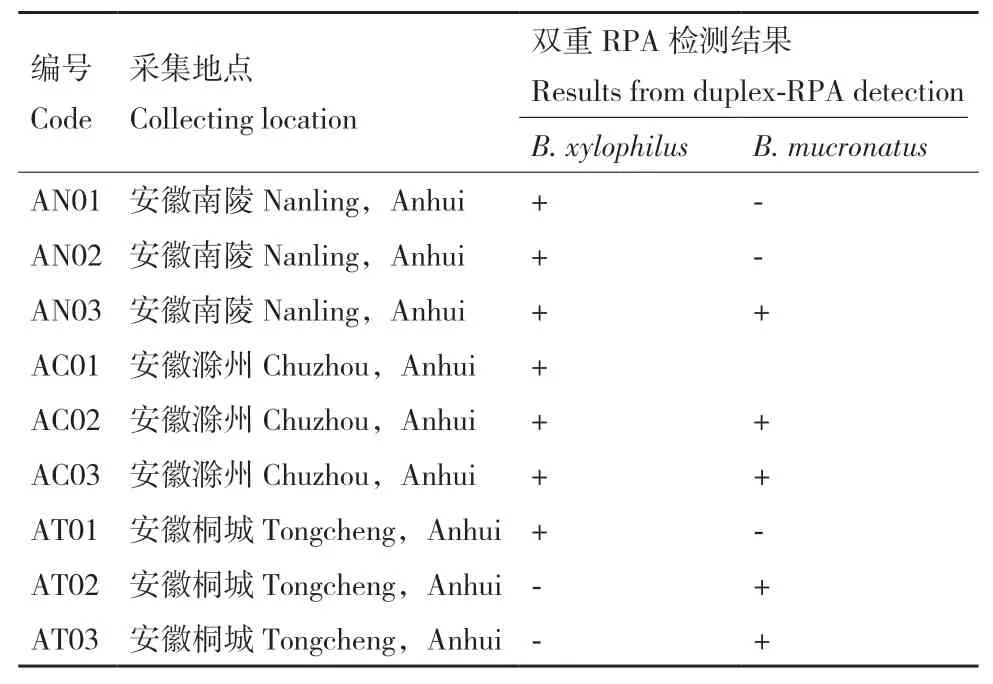
表3 松木样本中松材线虫与拟松材线虫的双重RPA检测Table 3 Duplex-RPA detection for B. xylophilus and B. mucronatus
2 结果
2.1 RPA检测方法的建立
在本研究中,通过对松材线虫和拟松材线虫的ITS序列进行差异分析,分别设计松材线虫和拟松材线虫特异性上游引物Bx-rpa-F和Bm-rpa-F,以及两者共同下游引物Bxm-rpa-R。通过减少引物数量的方式提高引物扩增效率,避免非特异性扩增片段的产生。以Bx-rpa-F、Bm-rpa-F和Bxm-rpa-R为引物进行RPA反应,对松材线虫DNA的扩增产物为364 bp,对拟松材线虫DNA的扩增产物为189 bp,对松材线虫和拟松材线虫DNA等量混合物的扩增产物为364 bp、189 bp,阴性对照未检测到扩增条带,表明Bx-rpa-F、Bm-rpa-F和Bxm-rpa-R可用于松材线虫和拟松材线虫的双重RPA检测(图1)。
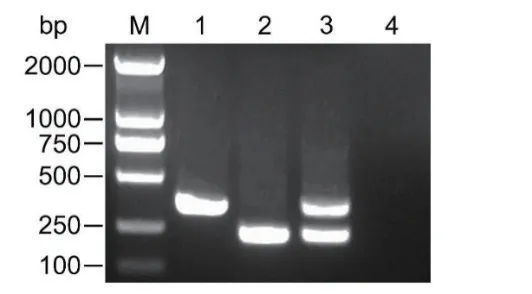
图1 松材线虫和拟松材线虫双重RPA检测Fig. 1 Duplex-RPA assay for detecting B. xylophilus and B. mucronatus
2.2 RPA引物最佳浓度配比
松材线虫和拟松材线虫等量混合物作为模板,设 置Bx-rpa-F、Bm-rpa-F和Bxm-rpa-R不 同 引 物浓度配比进行双重RPA扩增。结果(图2)发现,RPA引物Bx-rpa-F和Bxm-rpa-R仅能从混合DNA样本中检测到松材线虫,而Bm-rpa-F和Bxm-rpa-R仅能从混合DNA样本中检测到拟松材线虫。Bx-rpa-F、Bm-rpa-F和Bxm-rpa-R三条引物组合可同时检测到松材线虫和拟松材线虫,但不同引物配比间的扩增效果差异明显,当三者添加量为1.5∶0.9∶2.4 μL 时,双重RPA扩增效果最佳。
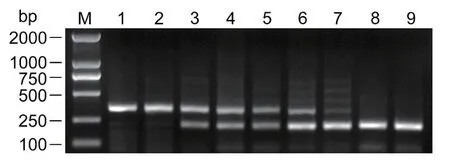
图2 不同引物配比下的扩增产物Fig.2 Amplified products with different primer ratios
2.3 双重RPA特异性检测
利用本研究建立的双重RPA检测体系,分别对15个不同线虫种群的DNA进行PCR扩增。结果如图3所示,5个松材线虫种群均扩增出364 bp的特异性条带,4个拟松材线虫种群均扩增到189 bp条带,而其它6个线虫种群及阴性对照均无扩增,表明以Bx-rpa-F、Bm-rpa-F和Bxm-rpa-R为基础的双重RPA检测具有较好的特异性。
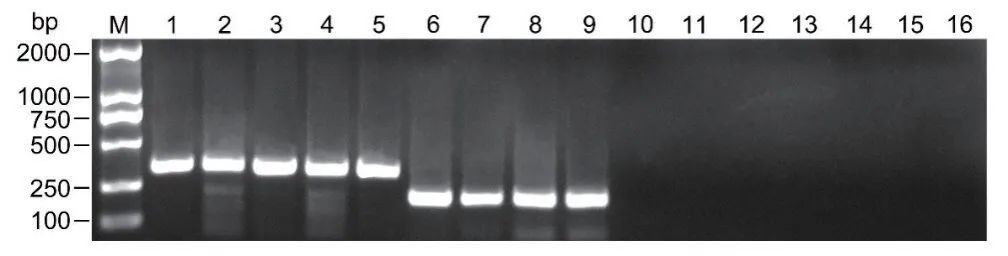
图3 双重RPA特异性检测Fig.3 Specificity test of duplex-RPA
2.4 双重RPA灵敏度检测
以Bx-rpa-F、Bm-rpa-F和Bxm-rpa-R(添 加 量1.5∶0.9∶2.4 μL)为引物组合,分别以松材线虫和拟松材线虫大量线虫DNA提取液和单条线虫DNA提取液为模板进行双重RPA灵敏度检测。将松材线虫和拟松材线虫初始浓度为1/10条线虫的DNA模板,按10倍梯度稀释后进行双重RPA检测。当松材线虫模板稀释10倍时,能检测到RPA扩增条带,而PCR在模板稀释100倍时仍能检测到目的条带,表明双重RPA检测对松材线虫的检测灵敏度为10 pg/μL,相当于1/100条线虫(图4-A);当拟松材线虫模板稀释10倍时,未检测到扩增条带,而PCR在模板稀释100倍时仍有特异性扩增,表明双重RPA对拟松材线虫的检测灵敏度为100 pg/μL,相当于1/10条线虫(图4-B)。同时,松材线虫与拟松材线虫稀释液等比例混合作为模板时,双重RPA检测灵敏度与两种线虫单独作为模板时一致(图4-C)。此外,通过与常规PCR检测灵敏度比较发现,常规PCR对松材线虫和拟松材线虫的检测灵敏度为1/1 000条线虫,高于RPA检测灵敏度。
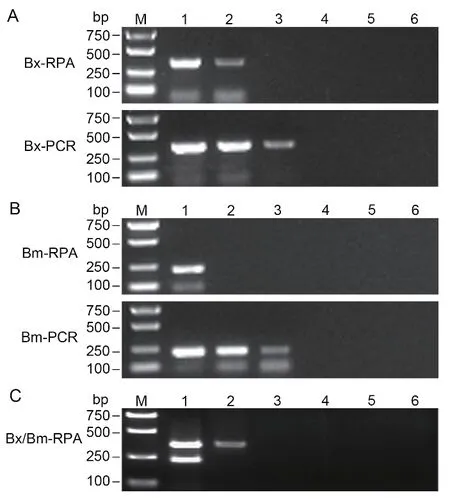
图4 双重RPA灵敏度检测Fig. 4 Sensitivity test of duplex-RPA
2.5 松木样本中松材线虫和拟松材线虫的双重RPA检测
采集安徽省松材线虫疫区的9份松木样品,利用本研究建立的双重RPA检测体系对其中的松材线虫和拟松材线虫进行检测鉴定。结果如图5所示,采集自南陵地区的3份松木中2份携带松材线虫、1份同时携带松材线虫和拟松材线虫;滁州地区1份松木携带松材线虫、2份松木同时携带松材线虫和拟松材线虫;桐城地区的3份样品仅携带松材线虫或拟松材线虫。双重RPA检测结果与镜检结果一致,表明双重RPA可用于松木样本中松材线虫和拟松材线虫的同步检测。
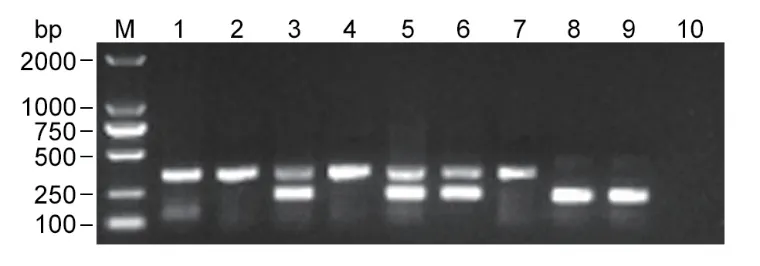
图5 松木样品中松材线虫和拟松材线虫双重RPA检测Fig.5 Duplex-RPA assay for detecting B. xylophilus and B. mucronatus from wood samples
3 讨论
近年来,松树萎蔫病发生呈现新趋势:向西、向北快速扩散态势,最西端达四川省凉山州,最北端已在辽宁北部多个县区,发生区域突破了传统理论提出的松材线虫年均气温10℃以上的适生界线;发现云杉花墨天牛等新的传播媒介;危害对象由过去的马尾松、黑松扩大到红松、落叶松等松树种类[29-31]。此外,松树萎蔫病已逼近三峡库区、秦巴山、庐山、黄山等生态区或国家重点风景名胜区,严重威胁其生态安全,防控任务十分紧迫。在自然条件下,拟松材线虫往往与松材线虫同时发生,且两者形态和生物学习性近似,为松材线虫的检疫鉴定增加难度。
Cha等[24]针对松材线虫5S rDNA序列设计引物,建立松材线虫RPA恒温扩增体系,该体系可在10 min内完成对核酸的指数扩增,检测灵敏度为1.6 pg松材线虫基因组DNA,检测效率较常规PCR和LAMP技术极大提高,但仍无法满足对松材线虫和拟松材线虫同步检测的需求。本研究以松材线虫和拟松材线虫ITS序列为靶标,设计双重RPA引物,可在37℃恒温条件下30 min内完成对靶标核酸的特异性扩增,可实现松材线虫和拟松材线虫的同步快速检测。
在特异性方面,本研究参考赵立荣等[14]的引物设计策略,开发松材线虫特异性上游引物Bxrpa-F、拟松材线虫特异性上游引物Bm-rpa-F和两者同用下游引物Bxm-rpa-R,在一个双重RPA反应中添加3条引物,降低非特异性扩增和引物二聚体的几率。同时,通过3条引物的最佳浓度配比优化,确定双重RPA反应中Bx-rpa-F/Bm-rpa-F/Bxm-rpa-R的添加比例为5∶3∶8时,双重RPA扩增效果最佳。在灵敏度方面,双重RPA对松材线虫和拟松材线虫的检测灵敏度分别为1/100、1/10条线虫,低于常规PCR的1/1 000条线虫,且低于已报道的LAMP 2.5×10-5条松材线虫的检测灵敏度[12]。双重RPA检测灵敏度虽低于常规PCR技术,但其足以检测单条松材线虫和拟松材线虫,满足对两种线虫快速检测的需求。在实用性方面,双重RPA从松木样品线虫DNA提取液中同步检测到松材线虫和拟松材线虫,且摆脱PCR仪的限制,拓宽应用场景。
4 结论
本研究建立的双重RPA检测方法操作简便、检测效率高、特异性强、灵敏度高、对仪器设备要求低,能够实现对松材线虫和拟松材线虫的同步检测,此方法可满足检疫部门或基层部门对松材线虫和拟松材线虫检疫鉴定的需求。

