远志提取物对PTP1B活性的抑制作用研究
梅月菊,蒲雅洁,2,陈彤垚,许晓双,3,张晓瑞,4,张福生*,秦雪梅,马存根
(1. 山西大学 中医药现代研究中心,山西 太原 030006;2. 山西健硕食品药品研究院有限公司,山西 太原 030001;3. 江苏理工学院,江苏 镇江 213000;4. 中央民族大学,北京 100081;5. 山西中医药大学,山西 太原 030024)
0 引言
糖尿病(Diabetes Mellitus,DM)是由于胰岛素缺乏或胰岛素抵抗,或两者兼而有之的慢性代谢性疾病,以2 型糖尿病为主,占糖尿病患者总人数的95%,且80%的2 型糖尿病患者同时伴有肥胖症[1]。世界卫生组织(WHO)的报告显示,2017 年全球有4.25 亿新的糖尿病病例,预计到2045 年全球患病率将继续上升至6.29 亿[2]。胰岛素抵抗引起的脂质代谢紊乱是2 型糖尿病发病的重要原因,而脂类代谢紊乱又是肥胖的诱因[3]。2 型糖尿病是一种无法根治的终身性疾病,目前临床治疗糖尿病的药物存在着较严重的副作用,如长期服用降糖药二甲双胍、α 葡萄糖苷抑制剂易会使糖尿病患者产生腹胀、恶心、呕吐等严重的胃肠道副反应,甚至会对患者的肾脏和肝脏造成严重损伤[4]。因此,依据DM 发病的作用机制,从中药中寻找安全高效的抑制剂已成为当前研究的热点。
蛋白酪氨酸磷酸酶1B(Protein tyrosine phosphatase 1B,PTP1B)是一种典型的非跨膜性蛋白酪氨酸磷酸酶,与肥胖症、糖尿病、癌症和心血管疾病等在内的多种疾病有关[5]。PTP1B 因其对胰岛素信号级联反应的负调节活性而被证实是治疗2 型糖尿病的生物学靶标[6]。研究表明,敲除2 型糖尿病大鼠中的PTP1B 基因后,大鼠体内的胰岛素敏感性明显增高,糖尿病症状也有所改善;敲除健康小鼠的PTP1B 基因后,小鼠体内的胰岛素敏感性明显增高,且在高糖脂饮食诱导下也不发展为2 型糖尿病和肥胖症[7-9]。因此,开发PTP1B 的抑制剂对于治疗2 型糖尿病及肥胖症具有良好的应用前景。
目前对于PTP1B 抑制剂的研究主要集中于化学合成抑制剂,包括氧化苯砷、钒酸盐、过钒酸盐等[10],而这些化学合成抑制剂会对患者身体造成不同程度的伤害。中药用于治疗糖尿病历史悠久,具有疗效稳定,不良反应少等优点[11],因此从天然植物中筛选PTP1B 抑制剂是目前研究的热点[12]。目前有很多新的来源于药用植物的PTP1B 抑制剂不断被发现,冯守爱等[13]运用硅胶和凝胶色谱等从红背山麻杆根(Alchornea trewioidesvar.trewioides)中分离得到4 个对PTP1B 活性具有较强抑制作用的化合物;赵海清等[14]利用阿勒泰黄芪(Astragalus altaicus)提取物对PTP1B 活性的抑制作用进行研究,推测其提取物中的皂苷类成分是抑制PTP1B 活性的主要物质。
远志(Polygala tenuifolia)主要化学成分为皂苷类、口山酮类和糖酯类成分等[15]。研究表明,远志具有一定的神经保护、改善学习记忆等药理作用;马洪伟等[16]发现远志对糖尿病周围神经病变大鼠的骨神经具有保护作用;黄小波等[17]发现远志能显著缩短大鼠到达站台的时间,能够改善糖尿病大鼠的认知障碍。本实验利用系统溶剂萃取法得到了7种远志提取物,通过复制人源PTP1B 抑制剂体外活性筛选模型,对各种远志提取物进行PTP1B 活性抑制筛选研究,期望从远志中找到潜在的PTP1B 抑制剂,用于今后2 型糖尿病及肥胖症的创新药物研发。
1 仪器与试剂
1.1 仪器
Thermo fisher U3000 超高液相色谱系统(Thermo Fisher Scientific,美国);Thermo ScientificTMQ Exactive Hybrid Quadrupole-Orbitrap 高分辨质谱仪(Thermo Fisher Scientific,美国);超纯水系统(Milli-Q,Millipore 公司,德国);低温摇床(艾卡仪器设备有限公司,德国);磁力搅拌(艾卡仪器设备有限公司,德国);超声波细胞破碎机(SCIENTZ JY92-IIN,宁波新芝生物科技股份有限公司,中国);超净工作台(LED-3,苏州净化设备有限公司,中国);强碱性阴离子交换树脂柱(Q-Sepharose Fast Flow,通用电气医疗公司,美国);强酸性阳离子交换树脂柱(S-Sepharose Fast Flow,通用电气医疗公司,美国);多功能酶标仪(infinite M200,Tecan公司,瑞士);96 微孔板(武汉博士德生物工程有限公司,中国);高速台式冷冻离心机(TGL-16,湘仪离心机仪器有限公司,中国)。
1.2 试剂
表达人源PTP1B 的大肠杆菌菌株,由吉林大学付学奇教授惠赠;BCA 试剂盒(上海碧云天生物技术有限公司);对硝基苯磷酸二钠盐(pNPP);异丙基-β-D-硫代半乳糖苷(IPTG);三羟甲基氨基甲烷(Tris);钒酸钠(Na3VO4);氨苄西林(Amp);氯霉素(Cam);3-吗啉丙磺酸(MOPS);2-(N-吗啡啉)乙磺酸(Mes);酵母、琼脂、蛋白胨(北京索莱宝科技有限公司);氯化钠(天津市化学试剂三厂);超纯水(Milli-Q 制备);乙腈(色谱纯,Fisher 公司);甲酸(色谱纯,Fisher 公司);其他试剂均为国产分析纯。
1.3 药材
本实验所用远志来自山西省农科院经济作物所实验大田的栽培远志,经山西大学中医药现代研究中心秦雪梅鉴定为远志科植物远志,留样保存于山西大学中医药现代研究中心。
2 方法
2.1 远志提取物的制备
根据文献[18]称取一定量的远志药材,剪短至1 cm~2 cm,加入10 倍的95%乙醇浸泡10 h ~12 h,加热回流2 h,重复浸泡2 h~3 h、回流提取3 次后合并提取液,过滤,浓缩,即得到醇提物;将过滤后的药渣,加10 倍水浸泡10 h~12 h,加热回流2 h,重复浸泡2 h~3 h、回流提取3 次后合并提取液,过滤,浓缩,得到水提物;将醇提物与水提物等体积混合,依次用1.5 倍体积的石油醚、氯仿、乙酸乙酯、正丁醇,萃取3 次,合并萃取液,浓缩至浸膏,60 ℃真空干燥,粉碎,分别得到石油醚提取物、氯仿提取物、乙酸乙酯提取物、正丁醇提取物、萃取水提取物。
2.2 PTP1B 的制备、纯化
Mes 缓 冲 液 的 配 制:称 取Mes(20 mmol/L)3.904 g,溶于900 mL 蒸馏水中,用1 mol/L NaOH调节pH 至6.5 左右,加入蒸馏水,定容至1 000 mL棕色容量瓶中,4 ℃保存。
将表达人源PTP1B 的大肠杆菌在500 mL LB(Luria Bertani)培养基(含500 μL 24 mg/mL Cam和500 μL 100 mg/mL Amp)中培养,经0.25 mL 1 mol/L IPTG 诱导4 h ~5 h,8 000 r/min ,4 ℃,离心10 min,弃上清,收集菌体,分装后8 000 r/min,4 ℃,每次10 min,离心4 次,弃去上清,沉淀保存于-20 ℃。
取1 L 菌体,用50 mL 磷酸盐缓冲液(pH 7.4,136.8 mmol/L NaCl,2.68 mmol/L KCl,10.1 mmol/L Na2HPO4·12H2O,1.8 mmol/L KH2PO4)重悬菌体,冰浴下磁力搅拌30 min,超声破碎,超声功率50%,超声3 s,停止8 s,直至上清液澄清。取少量菌液加入0.1 mol/L 的pNPP,显黄色则视为蛋白活力较好。将上述破碎后菌液与强碱性阴离子交换树脂柱充分结合,用25 mmol/L Tris-HCl(pH 7.5)配制不同浓度的NaCl 洗脱液(0.05 mol/L、0.1 mol/L、0.15 mol/L、0.2 mol/L),进行梯度洗脱,用pNPP 跟踪活性,将收集流分放入冰盒,4 ℃保存。将强碱性阴离子交换树脂柱所得组分用Tris-HCl 分别稀释至0.05 mol/L,加入至强酸性阳离子交换树脂柱,挂柱1 h,用Mes 缓冲液配制不同浓度的NaCl(0.05 mol/L、0.1 mol/L、0.15 mol/L、0.2 mol/L)进行梯度洗脱,采用超滤膜进行浓缩,对PTP1B 浓缩蛋白进行聚丙烯酰胺凝胶电泳检测蛋白的表达量和纯度,PTP1B 浓缩液于-80 ℃保存。使用时先配制成工作液置冰上待加样用。
2.3 远志不同提取物对PTP1B抑制活性的筛选
采用对硝基苯磷酸盐法,特异性检测纯化后的PTP1B 活性[16]。原理是pNPP 在PTP1B 的催化作用下被分解为pNP 和磷酸盐,其中pNP 显黄色,在405 nm 处 有 强 紫 外 吸 收,由pNP[(ε=1.78×104(mol-1·L·cm)-1)]的摩尔浓度来确定在PTP1B 催化下被分解的pNPP 的量,进而判断酶活性的变化以及化合物对酶活性的抑制情况。
阳性药(Na3VO4,钒酸钠)的配制:称取0.1 g Na3VO4溶于蒸馏水,转移至10 mL 的容量瓶,用蒸馏水定容,制成1×104μg/mL 阳性药溶液。
供试药物的配制:称取0.02 g 的远志提取物(干粉)溶于蒸馏水中,转移至10 mL 的容量瓶,用蒸馏水定容,制成2 mg/mL 的供试品溶液。
PTP1B 溶液的配制:称取4.18 g MOPS,2.92 g NaCl 溶于800 mL 的3 次蒸馏水中,用2 mol/L NaOH调节PH 至7.2,转移至1 000 mL 的容量瓶中,用三次蒸馏水定容,现用现配。
设置了阳性药物钒酸钠为供试药物:远志醇提取物、水提取物、石油醚提取物、氯仿提取物、乙酸乙酯提取物、正丁醇提取物、萃取水提取物,共8 个组。在96 孔 板 中 加 入83 μL PTP1B 溶 液,加 入10 μL 供试品溶液,37 ℃孵育30 min,然后加入2 μL 的pNPP,于37 ℃孵育15 min。最后加入5 μL 2 mol/L NaOH 终止反应,通过酶标仪测量405 nm 处的吸收强度,以阳性药矾酸钠作为阳性对照,以不加PTP1B 作为空白对照,计算抑制率。通过Graph-Pad PRISM 5.0 软 件 计 算 得 到IC50值 及IC50值曲线。

图1 PTP1B 纯化产物聚丙烯酰胺凝胶电泳分析(M:标准分子量蛋白Marker,1:纯化后的PTP1B)Fig.1 Purified PTP1B separated by SDS-PAGE(M:Standard molecular weight protein Marker,1:Purified PTP1B)
2.4 UPLC-Q-Orbitrap HRMS分析
2.4.1 色谱条件
将上述得到的7 个远志提取物的供试药物溶液分别过0.22 μm 的微孔滤膜后制成供试品溶液,进行UPLC-UV 分析,其色谱条件为:Acquity UPLC BEH C18色谱柱(100 mm×2.10 mm,2.6 μm),乙腈(A/%,体积分数)-0.1%甲酸溶液(B/%,体积分数)为流动相进行梯度洗脱,采集时间:40 min,洗脱梯度见表1;检测波长:302 nm;柱温:40 ℃;流速:0.3 mL/min;进样量:2 μL。
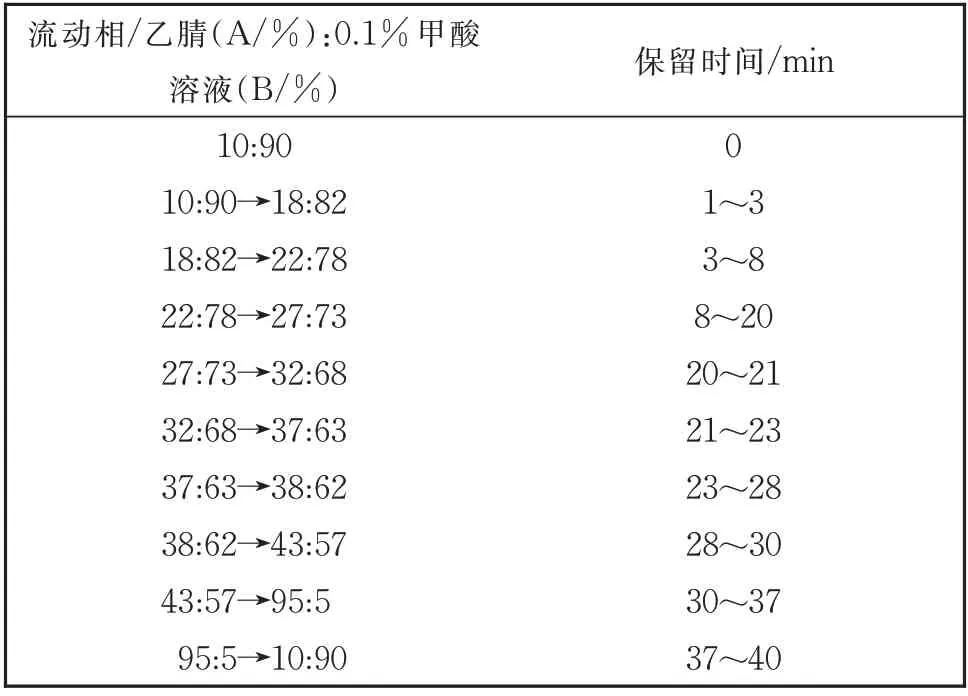
表1 洗脱梯度Table 1 Elution gradient
2.4.2 质谱条件
离子源为电喷雾离子源(ESI):扫描方式为正负离子同时扫描;喷雾电压3.5 kV;鞘气体积流量241.5 mL/s;辅助气体积流量69.0 mL/s;毛细管温度320 ℃探头加温器温度300 ℃;最大喷雾电流100 A;S-Lens分辨率55;扫描范围100 m/z~2000 m/z;质量分辨率70 kHz。
3 实验结果
3.1 PTP1B的分离纯化
将表达人源PTP1B 的大肠杆菌涂布在LB 平板上,待有单菌落长出后,挑取单菌落至LB 液体培养基中扩大培养,经IPTG 对其诱导,将诱导表达的菌体进行超声破碎,采用离子交换层析的方法对破碎菌液进行纯化、分离得到PTP1B,经超滤膜对PTP1B 进行浓缩,对PTP1B 浓缩液进行聚丙烯酰胺凝胶电泳分析,电泳结果显示纯化蛋白呈单一条带,条带大小与预期结果相符(约为26 KDa),并无明显杂带产生,表明人源PTP1B 在大肠杆菌中得到表达且效果较好。
3.2 远志不同提取物对PTP1B活性的抑制作用
将Na3VO4的浓度设置为0.01 μg/mL,0.1 μg/mL,1 μg/mL,5 μg/mL,25 μg/mL,100 μg/mL。采用BCA 法测得PTP1B 浓度为290 μg/mL 对建立的PTP1B 抑制剂筛选模型进行验证,结果如图2 所示。Na3VO4的IC50为(0.1845 ± 0.01)μg/mL,对PTP1B 具有较强的抑制作用,证明该模型可用于PTP1B 抑制剂的筛选。
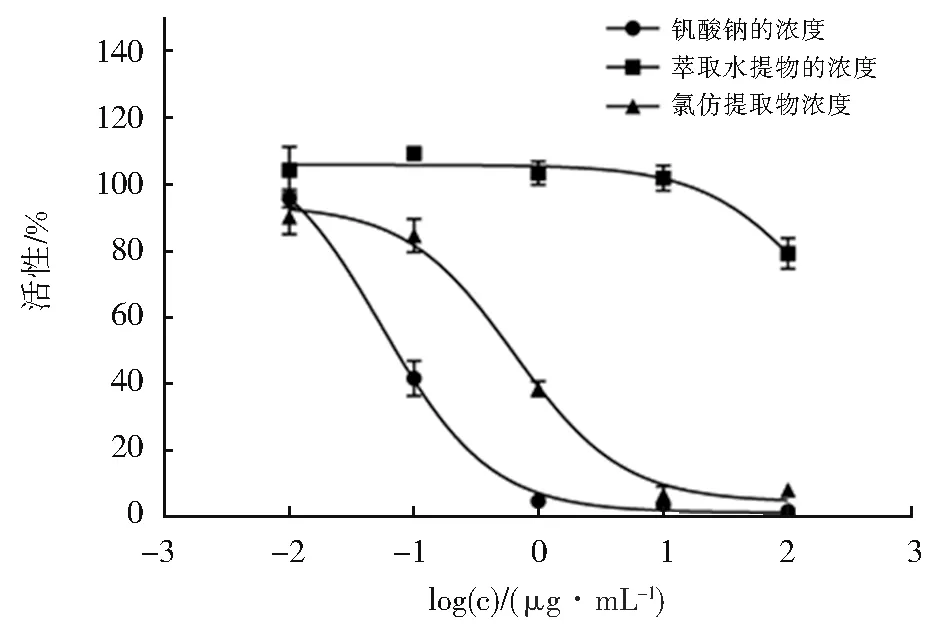
图2 Na3VO4、氯仿提取物与萃取水提取物对PTP1B 的抑制曲线图Fig. 2 Na3VO4,chloroform extract and water extract against PTP1B inhibition curve
图2 表明,远志氯仿提取物的IC50值为(1.213±0.3) μg/mL,低 于(55.96±1.14) μg/mL[17],认为其对于PTP1B 具有强抑制作用,而远志醇提物的IC50值为184.9 μg/mL,远志水提取的IC50值为535.7 μg/mL,远志正丁醇的IC50值为66.77 μg/mL,远志萃取 水 提取物的IC50值为184.6 μg/mL,其 余 提 取 物 的IC50值 均 高 于(55.96±1.14)μg/mL[19],说 明 这 些 提 取 物 对PTP1B 活 性 没 有 抑制作用。
3.3 7 种远志提取物的UPLC-Q-Orbitrap HRMS分析
通过比对远志各提取物的UPLC-UV 色谱图的峰型及保留时间(tR),发现氯仿提取物在保留时间22 min~28 min 内的化学成分种类及含量明显不同于其他提取物(图3),推测此保留时间区域内的化合物是抑制PTP1B 活性的物质。远志氯仿提取物总离子流图(图4A-B)。由于氯仿提取物内脂肪酸类物质含量较高,掩盖了小分子化合物的信号,且口山酮类小分子化合物浓度较低,导致无法产生二级质谱图。
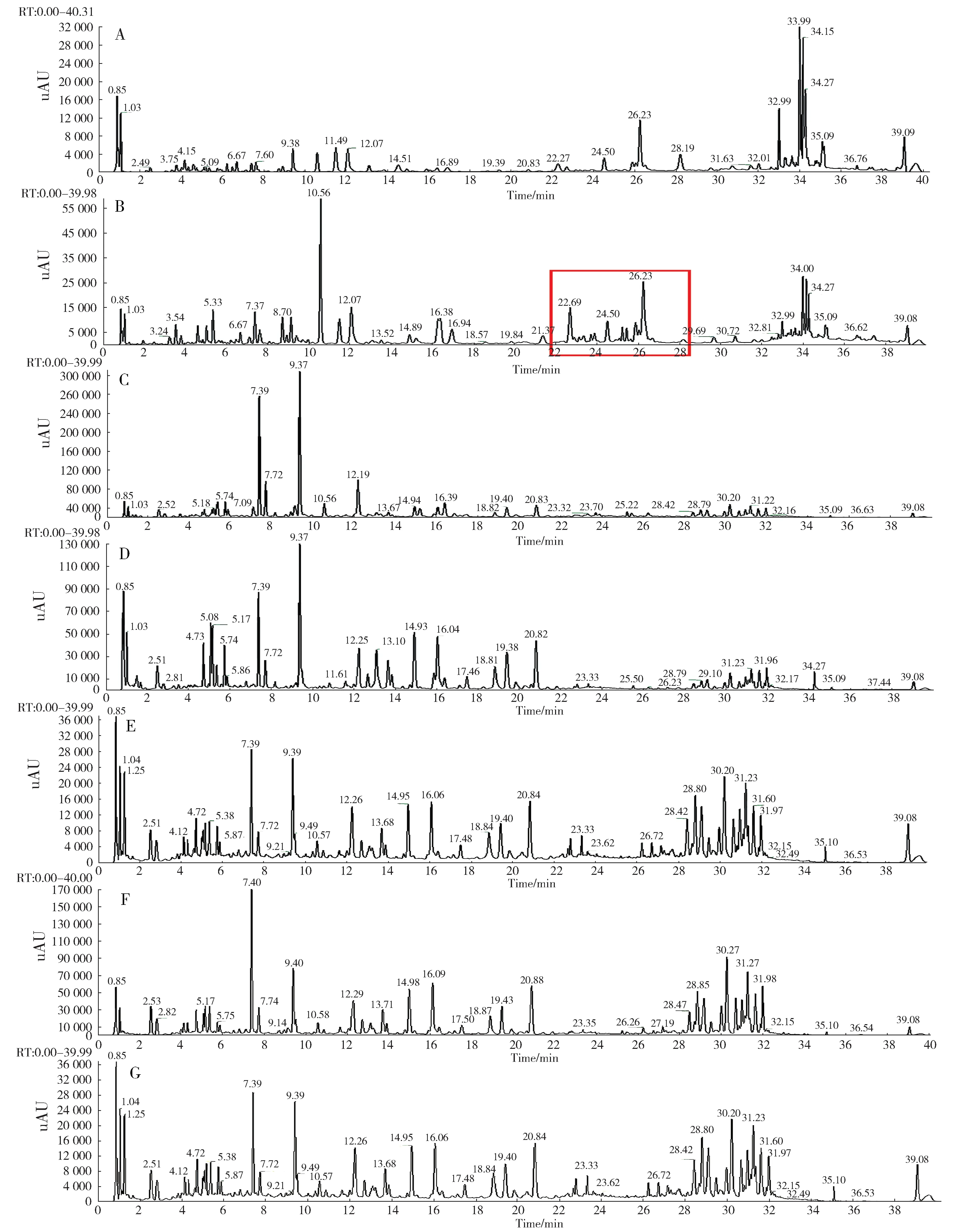
图3 远志提取物UPLC-UV 色谱图(A:石油醚提取物,B:氯仿提取物,C:乙酸乙酯提取物,D:正丁醇提取物,E:萃取水提取物,F:乙醇提取物,G:水提取物;图中红色方框表示氯仿提取物在保留时间为22 min~28 min 的区域)Fig.3 UPLC-UV chromatogram of P. tenuifolia(A:Petroleum ether extract,B:Chloroform extract,C:Ethyl acetate extract,D:n-butanol extract,E:Extraction water site ,F:Ethanol extract,G:Water extract;The red box in the figure shows the area of chloroform extract with retention time of 22 min-28 min)
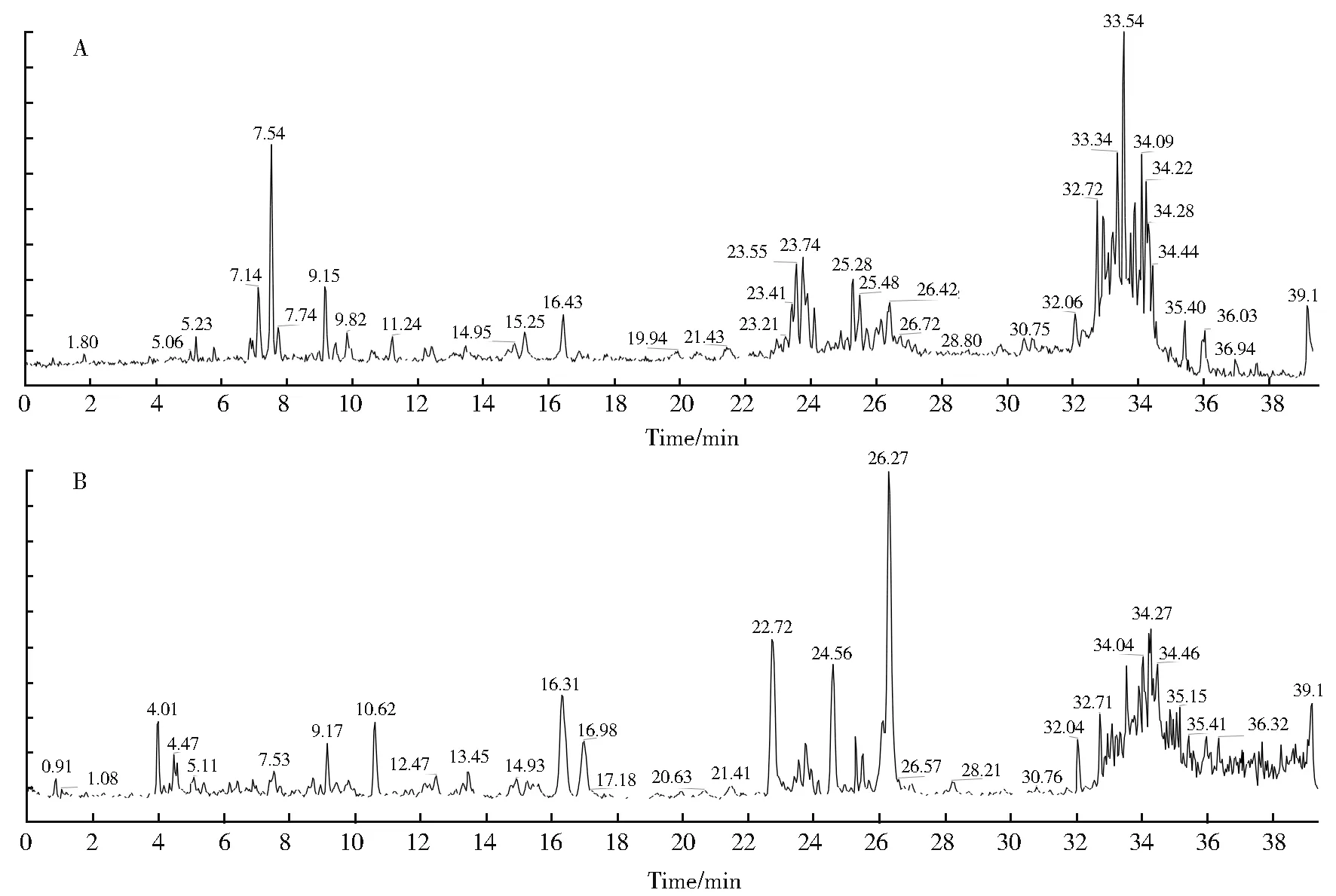
图4 远志氯仿提取物的总离子流色谱图。A:正离子模式;B:负离子模式Fig. 4 Total ion flow chromatogram of chloroform extract of P. tenuifolia.A:Positive ion mode;B:Negative ion mode
4 讨论
PTP1B 抑制剂不仅可以用于治疗2 型糖尿病及其并发症,对于肥胖症也有较好的治疗作用。已有大量化学合成PTP1B 抑制剂的相关文献,但由于PTP1B 抑制剂的活性低或选择性差等特点,导致目前尚未有PTP1B 抑制剂进入临床研究[20]。因此,从天然植物尤其是中草药中寻找天然PTP1B 抑制剂将有助于进一步发现高活性、低毒的抗糖尿病与减肥的有效成分[21]。本文以远志为对象,采用系统溶剂萃取法得到7 种远志提取物。通过人源PTP1B 抑制剂的体外活性筛选模型,发现远志氯仿提取物对PTP1B 具有较强的抑制作用(IC50:(1.213±0.3)μg/mL。经对氯仿提取物进行了UPLC-Q-Orbitrap HRMS 分析,未得到二级质谱图,故基于已有文献[22]对远志氯仿提取物中的活性成分进行了推测。
姜勇等[23]将远志醇提物减压浓缩成浸膏后,依次用石油醚、氯仿和正丁醇萃取,得到远志氯仿提取物,采用硅胶柱层析和Sephadex LH-20 对远志氯仿提取物进行分离纯化,得到低极性甾醇类、脂肪酸、口山酮类等6 种化合物,其中只有1,3,7-trihydroxyxanthone、1,6,7-trihydroxy-2,3-dimethoxyxanthon 等2 个化合物具有二级质谱信息;此外,1,3,7-trihydroxyxanthone 和1,6,7-trihydroxy-2,3-dimethoxyxanthon 的含量均较低,生药量分别为0.35 mg/kg、0.48 mg/kg。为了充分获得远志中的大极性类化学成分,将远志醇提物及药渣水提物进行等体积混合,并依次用石油醚、氯仿、乙酸乙酯、正丁醇依次进行了液液萃取。相对于文献中氯仿提取物[23],本文所制备的远志氯仿提取物中的大极性化学成分更多一些,因而导致了远志氯仿提取物中脂肪酸类成分较多,最终对后续活性物质的结构指认造成了困难。通过生药量折算,本文所制备的远志氯仿提取物中1,3,7-trihydroxyxanthone 化合物的含量约为1.52 ng,1,6,7-trihydroxy-2,3-dimethoxyxanthon 化合物的含量约为2.12 ng,均低于质谱的最低检测限度,这也是无法得到远志氯仿提取物二级质谱图并对化合物进行结构鉴定的主要原因之一。综上,依据文献[23]推测远志氯仿提取物的活性成分应为甾醇类、脂肪酸及口山酮类化合物,并以口山酮类化合物为主。今后应继续对本文中的氯仿提取物进行单体化合物的分离、纯化与结构表征,并对其抗PTP1B 的作用机理进行深入研究。
5 结论
本文对远志提取物进行PTP1B 抑制活性筛选,结果表明远志氯仿提取物具有较强的PTP1B 抑制活性,推测远志氯仿提取物中的口山酮类化合物以及少量的甾醇类、脂肪酸化合物是主要的活性物质。

