石竹和瞿麦组织培养与试管开花技术研究
邹欢欢,程明圣,黄孝风,陈慧晶,肖 丽,张 云,邹 娜
(江西农业大学园林与艺术学院,江西南昌330045)
石竹(Dianthus chinensis)为石竹科石竹属的多年生草本植物。石竹在园林绿化中,常作为1、2年生草本花卉栽培[1],其花朵繁密,花色艳丽,常以丛栽或成片栽植的方式应用于各种园林景观,或作切花使用,起到美化环境及提升景观的观赏性的作用[2]。近年来,随着人们生活水平和对生存环境质量要求的提高,对石竹的需求量也越来越大,但是传统的园艺栽培中,常采用扦插、分株等繁殖方法,存在品种退化和繁殖系数低的问题,难以满足市场巨大的需求量。重瓣瞿麦(Dianthus superbus‘Chongban’)为江西农业大学花卉盆景教学基地筛选培育出的的重瓣新品种,花色艳丽且花期长,但无结实能力[3]。瞿麦花朵繁密,花色艳丽,作为地被植物来栽培易成活,常以丛栽或成片栽植的方式应用于各种园林景观,是园林绿化的重要组成部分。研究表明瞿麦具有抗菌、肾保护、抗肿瘤、神经保护等药理作用[4]。采用分株和播种繁殖方式的繁殖系数较低,难以形成瞿麦的大规模生产,且分株繁殖易造成病毒的积累。组织培养技术可有效的缩短繁殖时间,短期内繁殖大量优质种苗,在提高繁殖速度、缩短育种周期、降低成本上起到了重要作用,尤其在是一些新品种的选育、扩繁和保持优良品种的特性方面更显示出优越性[5,6]。试管开花是指通过组织培养的方法,使植物的开花过程在培养容器中完成。多数研究表明,离体条件下有助于调控植物开花的各个因素,深入研究植物开花的生理机制,以控制花期从而获得大量成花[7]。通过分析以往人们对石竹组织培养的研究,发现石竹试管苗开花研究甚少,而且瞿麦试管开花尚未见报道。为此,本文通过对石竹和瞿麦离体培养技术的研究,探讨石竹和瞿麦无菌苗增殖和壮苗培养的最佳条件,并进一步研究不同因素对石竹和瞿麦试管苗成花的影响。
1 材料与方法
1.1 试验材料
石竹种子和重瓣瞿麦外植体材料来自江西农业大学花卉盆景教学基地。
1.2 试验方法
1.2.1 外植体灭菌消毒
石竹种子消毒灭菌:选取均匀饱满的石竹种子,在自来水下冲洗浸泡30 min,之后在超净工作台上用浓度75 %的酒精浸泡30 s,再用浓度为0.1 %的氯化汞添加1 滴吐温-20 灭菌8 min,无菌水冲洗4~5 次。用吸水纸吸干水分后播种在MS 培养基表面进行种子萌发。
瞿麦茎段消毒灭菌:取无花苞、腋芽未萌发的幼嫩茎段带回实验室,蘸洗洁精仔细刷洗枝条表面,流水下冲洗15 min。将清洗后的茎段转入超净工作台,用75 %酒精消毒30 s,再用含吐温-20 质量体积比为0.1 %的升汞溶液消毒8 min,无菌水冲洗5~6 遍,接种到诱导培养基上。
1.2.2 增殖培养
种子萌发形成的幼苗及由茎段诱导的腋芽分别接种于A2 培养基继代1 次。当无菌长到2 cm 以上时,切取顶端2 cm 左右顶芽接种于附加不同浓度的6-BA 和NAA、的MS 基本培养基上进行增殖培养基的筛选。培养28 d 后统计其增殖系数、平均高度和玻璃化率。
1.2.3 壮苗培养
当增殖培养基上的石竹无菌苗长到2.5 m 以上时,取顶端2 cm 接种到添加不同浓度的多效唑(0 mg/L、20 mg/L、40 mg/L 和80 mg/L)及蔗糖(20 mg/L、40 g/L)组成的各培养基中进行生根壮苗培养基的筛选。培养28 d 后统计各处理无菌苗苗高、茎粗、玻璃化率并记录其长势。
1.2.4 开花培养
选取茎粗壮,叶片均匀,长势较好的苗,取其顶芽,每顶芽下带两片叶子,接种在由不同基本培养基、植物生长调节物质浓度及配比、蔗糖和封口材料组成的开花培养基中进行花芽诱导,60 d 以后统计开花率。开花率=开花外植体数/接种外植体总数。
1.3 培养条件
培养室温度为25±1℃,光照2000 lx,光照时间为16 h/d。瞿麦外植体接种后先暗培养7 d,然后再置正常光照条件下培养。
1.4 数据分析
应用Excel 2003 进行数据处理,用DPS7.05 软件进行方差分析和新复极差测验。
2 结果分析
2.1 不同激素及浓度对石竹和瞿麦增殖的影响
结果表明:不同因素水平对石竹增殖的高度、增殖系数、玻璃化率的影响不同(见表1)。根据调整极差R’ 判断不同因素水平对石竹苗高影响的重要性依此为:基本培养基>封口材料>激素种类>空白列>6-BA 浓度; 石竹增殖系数影响的重要性依次为:基本培养基>封口材料>激素种类>BA 浓度>空白列;不同因素水平对石竹增殖过程中玻璃化的影响依次为:6-BA 浓度>激素种类>空白列>基本培养基=封口材料。其中,基本培养MS 对苗高和增殖系数的影响优于1/2MS,塑料盖优于封口膜,0.1 mg/L的NAA 优于等浓度的IBA,6-BA 浓度以0.5 mg/L为佳,即处理3。6-BA 浓度增大易导致石竹增殖过程中玻璃化苗的发生,激素种类对玻璃化也有一定的影响,相比较于IBA,NAA 更易导致石竹增殖培养过程中的玻璃化。而基本培养基和封口材料对石竹玻璃化影响不大。

表1 不同因素对石竹增殖影响的直观分析表Table 1 Visual analysis table of the influence ofdifferent factors on the growth of Dianthus chinensis
方差分析结果表明(表2),基本培养基对石竹苗高的影响达到显著水平,其它3 个因素6-BA 浓度、激素种类、封口材料对其增殖的影响均不显著;就增殖系数而言,基本培养基和封口材料对其增殖的影响均达到极显著水平,其它两因素6-BA 浓度、激素种类对其增殖影响水平不显著;就玻璃化率而言,各因素水平对石竹增殖的影响均不显著。从表3可以看出,8 个不同处理中,苗高和增殖系数最好的都是处理3,其次是处理1、处理6 和处理7,并且与处理8 间的差异达到极显著水平,而不同处理间玻璃化率没有显著差异。因此,以增殖系数为主要参考指标,在综合评价苗高、玻璃化率的基础上,本实验认为石竹最佳的增殖配方为MS + 6-BA 0.5 mg/L+ NAA 0.1 mg/L,用塑料盖封口,即处理3。增殖培养28 d,平均苗高可达到4.2 cm,增殖系数可达到2.8 倍,且无玻璃化现象发生。
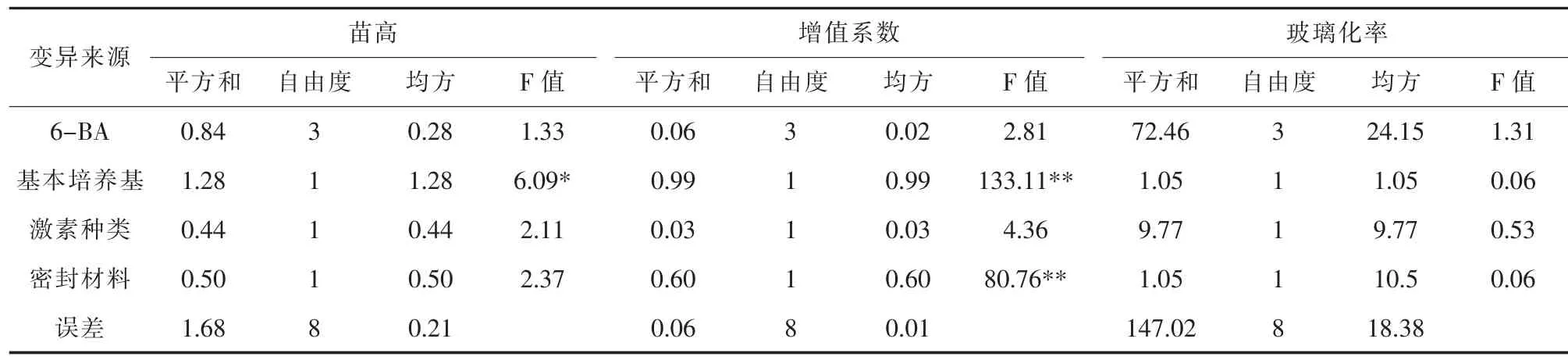
表2 不同因素对石竹增殖影响结果的方差分析Table 2 Variance analysis of the effect of different factors on the proliferation of Dianthus chinensis

表3 影响石竹增殖的各个处理间差异显著性检验分析表Table 3 Test and analysis table for the significance of differences between treatments affecting the growth of Dianthus chinensis
2.1.2 不同因素对瞿麦增殖影响的分析
不同因素水平对瞿麦增殖影响的重要性依次为(表4):基本培养基>6-BA 浓度>激素种类>封口材料。从各因素不同处理来看,MS 优于1/2MS 基本培养基,6-BA 浓度以0.1 mg/L 较好,苗高随着6-BA浓度的增加呈逐渐减小趋势,生长调节物质以NAA好于IBA,不同封口材料对瞿麦增殖过程中苗高影响不大。因此瞿麦增殖过程中苗高生长较佳培养基配方为:MS+NAA 0.1 mg/L+6-BA 0.1 mg/L 是最佳的配方,即处理1。从增殖系数来看,各因素水平对其增殖影响的重要性依次为:基本培养基>封口材料>6-BA浓度>空白列>激素种类。从各因素水平来看,MS 培养基对瞿麦的增殖效果优于1/2MS,封口材料用瓶盖较好,6-BA 浓度以0.5 mg/L 最佳,不同植物生长调节剂种类NAA 或IBA 对瞿麦增殖影响效果差别不大,瞿麦增殖的适宜培养基配方为:MS + 6-BA 0.5 mg/L+IBA(或NAA)0.1 mg/L,封口材料用瓶盖,即处理3。从玻璃化率来判断,各因素水平对其影响的重要性依次为:封口材料>基本培养基>6-BA 浓度>空白列>激素种类。从各因素水平来看,瓶盖与封口膜相比更容易导致无菌苗玻璃化,MS 基本培养基比1/2MS 中的苗玻璃化率更多,随着6-BA 浓度增大玻璃化率也呈增加趋势。因此,以增殖系数为主要参考指标,在综合评价苗高、玻璃化率的基础上,本实验选择瞿麦与石竹相同的增殖配方MS+6-BA 0.5 mg/L+NAA 0.1 mg/L,用塑料盖封口,即处理3。

表4 不同因素对瞿麦增殖影响的直观分析表Table 4 Visual analysis table of the influence of different factors on Dianthus superbus proliferation
2.2 不同因素对石竹壮苗培养的影响
将通过增殖获得的石竹无菌苗接种到不同壮苗培养基上,观察苗的长势,并在28 d 后进行统计苗高、茎粗和玻璃化率(见表5)。结果表明:随着多效唑浓度的增加,苗的高度呈下降趋势,但是茎的粗度没有明显的变化;随着蔗糖浓度的提高,石竹节间变短,叶片有所增大,叶色变绿舒展,茎粗没有明显的变化。综合评价苗的长势和高度,认为处理7最好。各处理均没有出现玻璃化苗。因此,本实验认为,添加40 mg/L 的多效唑和40 g/L 的蔗糖最有利于石竹的壮苗培养。

表5 不同因素对石竹壮苗培养的影响Table 5 The influence of different factors on the cultivation of strong seedlings of Dianthus chinensis
2.3 不同因素对石竹和瞿麦试管开花诱导的影响
将获得的无菌苗接种到不同开花诱导培养基中,60 d 后统计各不同处理开花情况(见表6)。结果表明,各处理间的石竹无一开花,瞿麦开花率仅为11.11%~16.67%,开花率极低。

表6 不同因素对石竹和瞿麦开花诱导的影响Table 6 Effects of different factors on flowering induction of Dianthus chinensis and Dianthus superbus

图1 石竹组织培养及试管开花诱导Figure 1 Dianthus chinensis s tissue culture and in vitro flowering induction

图2 瞿麦组织培养及试管开花诱导Figure 2 Tissue culture of Dianthus superbus and in vitro flowering induction
3 讨论与小结
3.1 不同激素与浓度对石竹和瞿麦增殖培养的影响
根据实验结果,石竹增殖的最适宜配方为MS +6-BA 0.5 mg/L + NAA 0.1 mg/L + 琼脂7.0 g/L +蔗糖20 g/L,用塑料盖封口。全营养的MS 培养基不仅有利于石竹的长高,也有利于提高增殖系数。用0.1 mg/L 的NAA 效果要优于IBA。6-BA 的浓度对石竹的增殖效果不显著,而且随着浓度的提高会引起玻璃化苗的增加,这一结果与程云清的一致[8]。
瞿麦增殖最适宜的配方为MS + 6-BA 0.5 mg/L+ NAA 0.1 mg/L + 琼脂7.0 g/L + 蔗糖20 g/L。透气膜比塑料盖的透气性更好,有效降低在增殖培养期间的玻璃化率[9]。
3.2 多效唑和蔗糖对石竹壮苗培养的影响
实验结果表明,一定浓度的多效唑可以使石竹苗矮化,叶色加深变绿等作用,并且随着多效唑浓度的提高,石竹苗的高度降低。推测是由于多效唑能够促进植物叶片碳水化合物的合成,降低氮素的积累,提升碳氮比(C/N)[10]提高蔗糖的浓度也有利于石竹苗的矮化,随着蔗糖浓度的提高,石竹苗的高度降低。因此,40 mg/L 的多效唑和40 g/L 的蔗糖最适宜石竹的壮苗培养。但蔗糖对植物矮化作用的生理生化机制尚不清楚,还有待进一步深入研究[11]。
3.3 石竹和瞿麦试管开花影响因素
石竹和瞿麦同为石竹科石竹属的植物,组培过程中对培养基中各成分的响应规律相似,但在本实验中,接种在各处理培养基上的石竹均未开花,且瞿麦也仅有部分开花。推测原因一方面是石竹的外植体材料为种子,比以茎段为外植体的瞿麦更难诱导其开花;另一方面石竹科植物种子有休眠的特征[12],在种子萌发前没有进行催芽,瞿麦虽然开花,但是开花率低,后续可尝试通过改变培养基中N、P、K 元素配比,或改变其他环境因素,对植物试管开花的关键因素及内在调控机制进行进一步深入研究[13]。

