川芎嗪羟丙基-β-环糊精包合物柔性脂质体的药剂学性质研究
付丽娜,李伟泽,赵 宁,樊 琨,李 健,杨黎彬
(西安医学院药学院,西安 710021)
柔性脂质体(FL)是一种极具潜力的微粒型给药载体[1-2],是一种良好的抗肿瘤药物的载体。本课题组前期实验结果表明,以丙二醇为柔软剂制备的FL包封率、稳定性和吸收率均较好[3]。因此,将川芎嗪(LI)制备成川芎嗪柔性脂质体(LIFL),有利于提高LI的稳定性和治疗指数[4]。但其药物泄漏率较高,主要是因为丙二醇是一种水性柔软剂,包载入脂质双分子层后增加了其疏水性,降低了磷脂双分子层的屏障作用导致其不稳定。
羟丙基-β-环糊精(HP-β-CD)具有内疏水[5-7]、外亲水的特殊结构,可使难溶性药物通过置换作用进入到内腔形成包合物,是一种唯一可供注射用的包合物制备材料,在常温下具有良好的水溶性,在体内基本不会累积,且包合于其内部的药物在体内可迅速释放[8-9]。
本课题组以HP-β-CD为包合物包合LI得到HCD-LI,并以此为内水相药物制备其纳米柔性脂质体(HCD-LIFL),以解决液态LIFL泄漏率较高、稳定性不足的问题,对FL的进一步开发、应用奠定了基础。
1 仪器与试药
1.1仪器 Agilent1260型高效液相色谱仪(美国Agilent公司);差示扫描量热仪(DSC,Stare系统,瑞士Mettler-Toledo公司);ZEN-3600型激光粒度仪(英国Malvern Zetamaster公司);1-14sartorius型离心机和Quintix224-1 Cnsartorius型电子天平,均购自赛多利斯科学仪器有限公司;H11-1型恒温磁力搅拌器(上海司乐仪器有限公司);DHG9140B型电鼓风干燥箱(上海安亭科学仪器厂);FJ-200型高速分散匀质机和SHZ-D(Ⅲ)型循环水式真空泵,均购自巩义市予华仪器有限责任公司。
1.2试药 川芎嗪对照品(LI,中国药品生物制品检定所,批号110817-201903);盐酸川芎嗪(上海太伟药业有限公司,批号180212);注射用大豆卵磷脂(上海山浦化工有限公司,批号201281009);胆固醇(安徽科宝生物科技有限公司,批号171013);羟丙基-β-环糊精(HP-β-CD,天津市科密欧化学试剂有限公司,批号20180317);1,2-丙二醇(天津大茂化学试剂厂,批号20190203);硫酸鱼精蛋白(北京悦康凯悦制药有限公司,批号YY180502);TritonX-100 (国药集团沪试,批号20181121);其余试剂均为分析纯。
2 方法与结果
2.1测定方法的建立
2.1.1色谱条件 采用HPLC法测定LI的质量浓度,色谱柱:ZorbaxEcLIpseXDB-C18(150 mm×2.1 mm,0.45 μm),流动相:水-甲醇=40∶60,流速:1.0 mL·min-1,柱温:25 ℃,进样量:20 μL,检测波长:295 nm。
2.1.2建立标准曲线 精密称取LI对照品10.00 mg,置于10 mL量瓶中,加甲醇稀释定容,配成质量浓度分别为10、25、50、75、100、125 μg·mL-1的LI对照品溶液,精密移取上述各溶液20 μL,注入高效液相色谱仪,以LI的峰面积对质量浓度进行线性回归,得回归方程:y=46.04x-364.95,R2=0.999 3。结果显示,LI质量浓度在10~125 μg·mL-1范围内线性关系良好。
2.1.3方法学考察 精密度考察:分别精密量取2.1.2项下制备的质量浓度为10、25、75 μg·mL-1的LI对照品溶液各20 μL,按照2.1.1项下色谱条件,重复进样 6次,测定峰面积,测得RSD值分别为0.87%、0.29%、0.05%,表明仪器精密度良好。
稳定性考察:按照2.1.2项下方法配制质量浓度为50 μg·mL-1的LI对照品溶液,于室温下放置,在0、1、3、6、8、12、24 h分别取20 μL,按照 2.1.1项下色谱条件进样检测,测得RSD值为0.21%(n=3),表明该样品在24 h内稳定性良好。
回收率实验:精密吸取空白脂质体1.0 mL,分别加入2.1.2项下制备的低、中、高3个质量浓度(10、75、125 μg·mL-1)的LI对照品溶液,混匀后,精密吸取 20 μL注入高效液相色谱仪,按照2.1.1项下色谱条件测定,通过对照品测得量与加入量之比计算回收率。结果平均回收率分别为102.90%、99.14%、101.72%(n=3),RSD值均小于2.00%。
2.2HCD-LI的制备及考察
2.2.1HCD-LI的制备 精密称取盐酸川芎嗪2.00 g,加水溶解后加0.1 mol·L-1的氢氧化钠调节pH值至10,待析出白色LI结晶,减压抽滤,干燥得LI。测得其回收率为(98.94%±0.24%) (n=5)。
精密称取HP-β-CD,加水10 mL使溶解,得质量浓度为200、250、300、350、400 mg·mL-1的HP-β-CD溶液。分别精密称取5份0.24 g LI,分别置于100 mL烧杯中,加无水乙醇2 mL使溶解,在输入功率200 W、频率40 kHz条件下将上述不同质量浓度的HP-β-CD溶液缓慢注入LI的乙醇溶液中,常温超声60 min。4 ℃避光静置24 h,待未包合的LI析出,过滤,滤液进行冷冻干燥,得到白色粉末。用少量水和无水乙醇洗涤产物,烘干、粉碎后得到包合产物。按公式包合率=(W总-W析)÷W总×100%计算包合率,其中W总为LI的总量,W析为析出的LI,结果见图1。
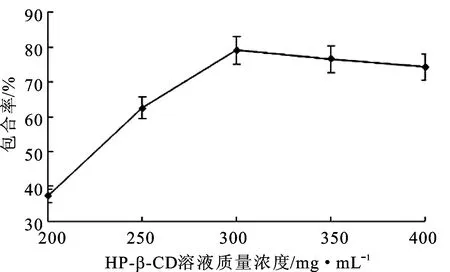
图1 HCD-LI包合率 (n=3)
由图1可知,随着HP-β-CD溶液质量浓度的增大,可能由于分子之间碰撞的几率增大,使得反应向生成包合物的方向进行,包合率随之增大;当质量浓度达到300 mg·mL-1时,HCD-LI对LI的包合率最大,随后随HP-β-CD溶液质量浓度的增大包合率变化较小。因此,以300 mg·mL-1的HP-β-CD溶液制备HCD-LI。
2.2.2差示扫描量热法验证HCD-LI包合物 用DSC在体积分数为99.99%的氮气氛围下,加热速率为20 K·min-1,升温范围为0~200 ℃,分别对HP-β-CD粉末(HCD)、LI粉末 (LI)、物理混合物(HCD+LI)、包合物粉末(HCD-LI)进行DSC扫描评价,结果见图2。
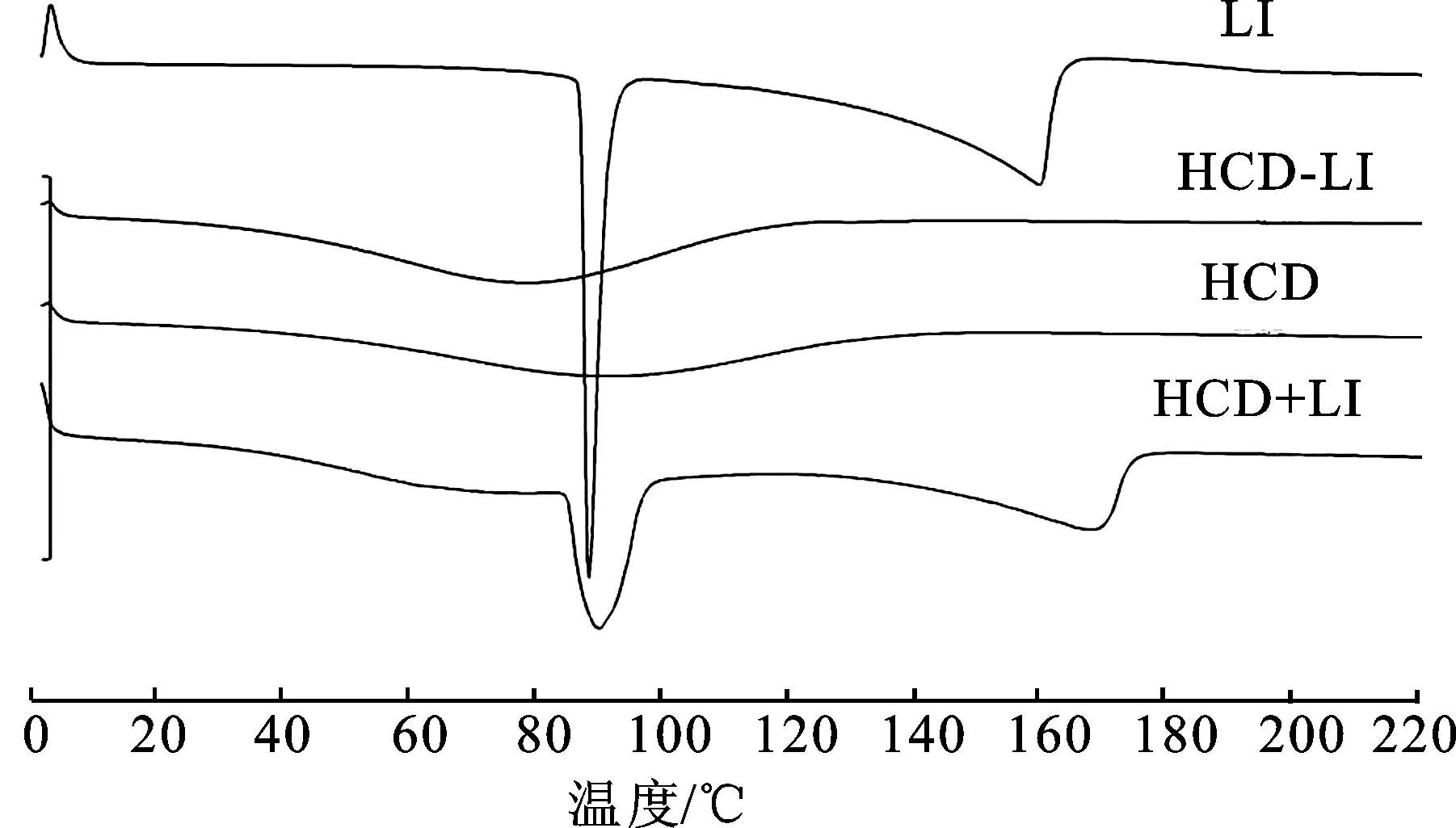
图2 HCD-LI包合物差示扫描量热图
由图2可知,LI在86、180 ℃左右各出现1个熔融峰和1个水峰,因为药物的熔点在80 ℃左右,且药物中含有的水分在175 ℃左右蒸发吸热。HCD+LI也出现了与LI相同的熔融峰和水峰,基本上是LI和HCD的叠加,而包合物HCD-LI无LI的熔融峰和水峰。说明在本实验条件下HCD能较好地包合LI,形成稳定、良好的包合物。
2.3LIFL和HCD-LIFL的制备及药剂学性质研究
2.3.1制备LIFL和HCD-LIFL 称取处方量的卵磷脂和胆固醇,置于茄形瓶中,加5 mL无水乙醇使溶解,于50 ℃、-0.05 MPa下浓缩后用无水乙醇复溶至5 mL,得油相,备用。取纯化水38 mL和1,2-丙二醇5 mL混合,得水相;取1/3水相,加入相当于0.15 g药物的HCD-LI置于磁力搅拌器上,在50 ℃以450 r·min-1、氮气氛围下将油相缓缓注入水相,水合5 min,高速均质(20 000 r·min-1)5 min,将剩余的水相缓缓加入,同条件下继续均质5 min;过0.22 μm微孔滤膜,即得HCD-LIFL,4 ℃避光静置备用。
将LI加入油相,同法制备LIFL。
2.3.2LIFL和HCD-LIFL的药剂学性质考察 包封率考察[10]:分别取LIFL和HCD-LIFL 0.5 mL,置于2 mL离心管中,加入质量浓度为10 mg·mL-1的鱼精蛋白溶液0.5 mL,摇匀,静置3 min,在室温条件下,以13 000 r·min-1离心15 min,取沉淀物以4倍量体数分数为10%TritonX-100甲醇溶液消解至澄清透明。过0.22 μm 针筒过滤器,取20 μL进样测定脂质体的包封率。按公式包封率=(W包封÷W总量)×100%计算包封率,其中W包封为被脂质体包封的药量,W总量为实际加入的总药量。
结果显示,HCD-LIFL对LI的包封率为(69.2%±11.4%)(n=3),是LIFL的1.69倍,表明HCD包裹LI后,内水相药物的包封率增大。这可能是因为脂质体内水相包裹了LI的包合物后,增加了一层屏障,内水相药物透过脂质双分子层的难度加大,从而增大了药物的包封率。
粒径和电位的测定:取LIFL和HCD-LIFL,以纯化水为稀释剂,按照1∶10的比例稀释后,采用Malvern激光粒度仪测定HCD-LIFL的粒径和电位,结果见图3。HCD-LIFL和LIFL的粒径分别为(240.1±4.2)、(191.5±3.5) nm(n=3),二者的多分散性指数(PDI)均小于0.5,表明其粒径分布较均匀;其Zeta电位值分别为 (-33.9±2.3)、(-31.6±2.8) mV(n=3)。因此,药物被包合后存在于内水相药物中,对脂质体粒径和电位几乎无影响;当Zeta电位的绝对值大于30 mV时,脂质体微粒间存在的较大静电斥力将利于微粒给药体系稳定性的提高与粒径的均匀[11-12],因此制备的HCD-LIFL较稳定。

图3 HCD-LIFL的粒径和电位
2.3.3HCD-LIFL的泄漏率考察 分别量取LIFL和HCD-LIFL各5 mL,置于处理好的透析袋中,两边用夹子固定并置于装有一定体积生理盐水的烧杯中,置于恒温磁力搅拌器上(温度37 ℃,转速 350 r·min-1)透析至平衡,测定其包封率(E0);透析平衡后,换生理盐水,再次于4、25、37 ℃避光透析,分别在 0、3、6、9、12、24 h取样 1 mL,并及时补充等量的生理盐水,样品过 0.22 μm针筒滤头过滤器,用HPLC法检测LI的质量浓度,计算此时的包封率(Ei)。用公式泄漏率=(1-Ei÷E0)×100%[13]计算泄漏率。结果见图4。
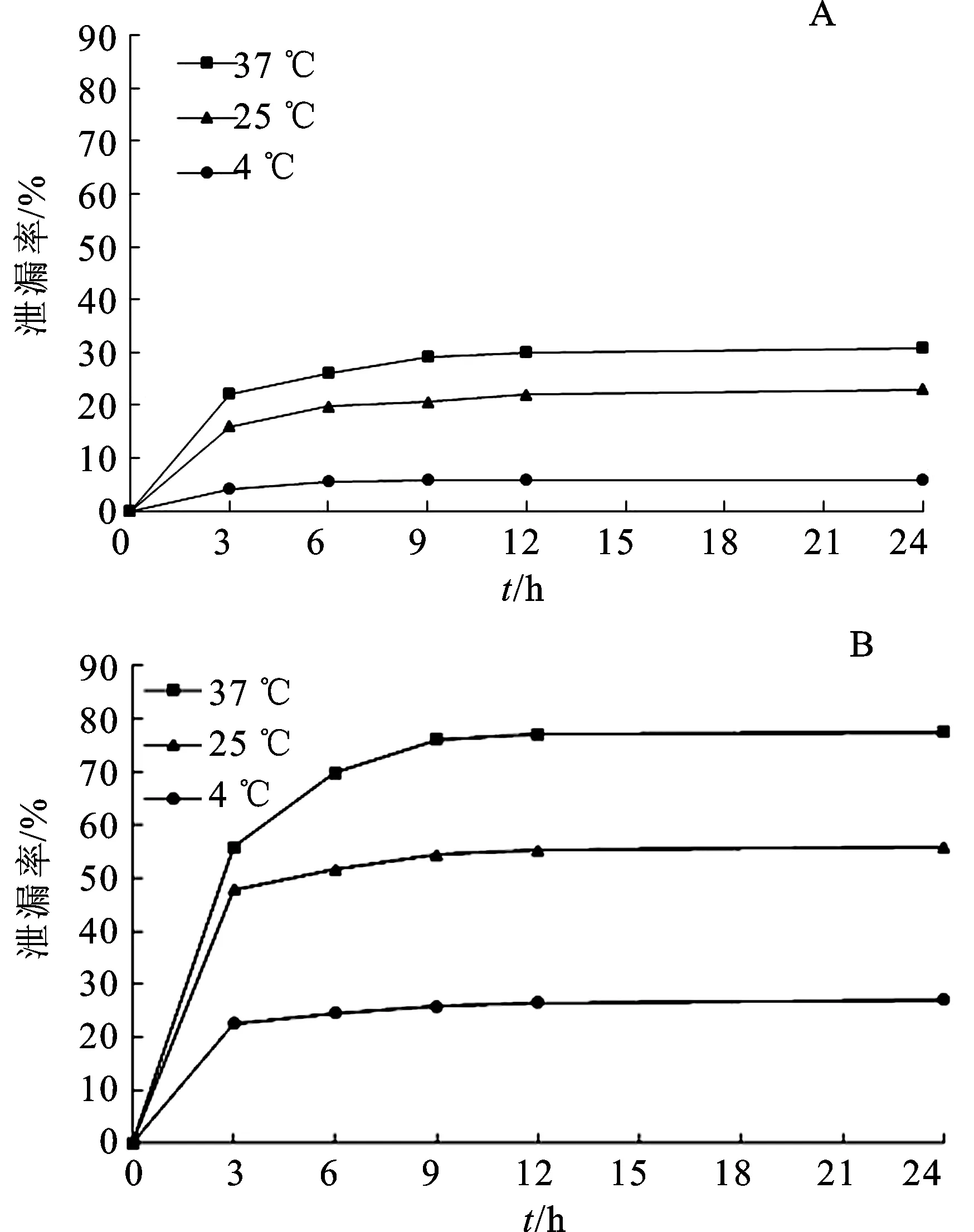
图4 脂质体的泄漏率 (n=3)
脂质体不稳定造成的药物泄露会改变药物代谢动力学过程和药效,还可能增大药物的毒性,因此,泄漏率是评价脂质体稳定性的重要指标[14]。由图4可知,随着时间的延长和温度的升高,2种脂质体泄漏率逐渐增大,可能是因为温度的升高加速脂质分子的热运动,造成膜的流动性变大,进而使包封于脂质体内的LI泄漏出来。同时,在相同温度条件下,HCD-LIFL的泄漏率明显低于LIFL。37 ℃条件下,6 h时LIFL的药物泄漏率是HCD-LIFL的1.50倍;12 h后,两者均达到平衡,LIFL药物泄漏率(92%)是HCD-LIFL(58%)的1.59倍。因此将LI用HP-β-CD包合后再制备其脂质体能有效抑制脂质体药物的泄漏。
3 讨论
LI是从伞形科植物川芎LigusticumChuanxiongHort.的干燥根茎中提取的一种有效成分,具有多种药理作用[15-16],如舒张血管、改善微循环、抗血小板凝集、活血化瘀、镇静镇痛和抑制肿瘤转移[17-19]等。临床用于治疗心绞痛以及脑血管疾病等,近年来在抑制肿瘤转移、诱导肿瘤细胞凋亡和自噬等方面也逐渐受到关注。目前常见的制剂有片剂、注射剂[20],但由于口服制剂在体内难以吸收,生物利用度低,为达到治疗质量浓度需频繁给药,易致蓄积LI质量浓度超过治疗窗甚至中毒,这一问题极大地限制了其开发应用。本课题组前期实验结果表明,以丙二醇为柔软剂制备的FL具有较好的变形性,因而更容易透过黏膜,包封率、稳定性和吸收率均较好。但液态脂质体由于不稳定易泄露常导致药效降低,难以达到治疗效果。因此,本实验将LI包合于HP-β-CD得到HCD-LI,再将HCD-LI包封于FL内制得HCD-LIFL,以解决脂质体的泄露问题。而HP-β-CD是一种可供注射用的包合物制备材料,常温下具有良好的水溶性,在体内基本不会累积,且包合于其内部的药物在体内可迅速释放,因此,HCD-LIFL是一种安全、稳定、有效的新型制剂。
体外透析实验结果表明,HCD-LIFL能明显减少药物的泄漏,提高脂质体的稳定性;而与普通LIFL相比,其包封率明显提高;脂质体粒径、电位无明显变化,说明HP-β-CD包合不影响脂质体的粒径及稳定性,而且药物被包埋于HP-β-CD后作为内水相制备得到的FL能有效降低水解等作用对药物的影响,增加制剂的稳定性,使其在药剂学中具有广泛的应用。
目前尚未发现将LI制备成包合物来解决LIFL泄漏的情况。因此,本文通过将LI包载入HP-β-CD中来改变其物理性质,增加LI分子的体积来减小LI透过磷脂双分子层的能力,从而延缓脂质体内水相药物的泄漏,从根本上提高了脂质体的稳定性,解决了液体状态下脂质体药物泄漏的问题,为其进一步应用奠定了良好的基础。

