大黄素联合奥曲肽对急性胰腺炎的疗效及血清水通道蛋白的影响
潘莹莹,展冠军,刘 静
(1.东南大学附属中大医院江北院区药剂科,南京 210000;2.东南大学附属中大医院药剂科,南京 210000)
急性胰腺炎(AP)是以胰酶激活诱发胰腺局部炎症为主要特征的急腹症,病因复杂多样,病情进展迅速,并发症较多[1]。目前,临床对AP早期治疗多以非手术综合治疗为主,如禁食、胃肠减压、营养支持、抗感染、调节酸碱及水电解质平衡、抑制胰酶分泌等,其中生长抑素类似物奥曲肽能够直接抑制胰腺外分泌,在AP治疗中应用较多[2]。大黄素是中药大黄的主要活性成分,已被证实可抑制胰酶分泌,并可抗炎、抗菌和调节免疫,且对AP具有良好的辅助治疗作用[3]。水通道蛋白(AQPs)异常在AP的发生及进展中具有重要作用[4]。本研究对AP采用大黄素联合奥曲肽治疗,监测了血清水通道蛋白5(AQP5)、水通道蛋白6(AQP6)及炎性因子的水平变化,旨在评价该方案的有效性和可能机制。
1 资料与方法
1.1一般资料 选取114例AP患者作为研究对象,按照随机数字表法均分为观察组与对照组,每组57例。观察组:男38例,女19例,年龄为25~73岁,平均(44.23±4.15) 岁;发病至就诊时间为6~24 h,平均(10.13±3.03) h;发病诱因:胆源性24例,酒精性15例,高脂血症性13例,其他5例;病情严重程度:13例轻症AP(MAP),35例中重症AP(MSAP),9例重症AP(SAP)。对照组:男35例,女22例,年龄为25~70岁,平均(43.19±4.04) 岁;发病至就诊时间为6~24 h,平均(10.09±2.78) h;发病诱因:胆源性21例,酒精性17例,高脂血症性16例,其他3例;病情严重程度:13例MAP,37例MSAP,7例SAP。2组性别、年龄、发病至就诊时间、发病诱因及病情严重程度等比较差异均无统计学意义(P>0.05),具有可比性。
1.2病例选择
1.2.1纳入标准 ①诊断符合《中国急性胰腺炎诊治指南(2013年)》[5]中对AP的诊断及分级标准;②年龄为19~75岁,性别不限;③发病至入院时间<48 h。
1.2.2排除标准 ①具有外科手术指征者;②合并严重心、肝、肺、肾功能不全者;③合并风湿免疫系统疾病、造血系统疾病、恶性肿瘤者;④合并其他部位急慢性感染者;⑤合并精神神经系统疾病者;⑥对本研究存在用药过敏或禁忌证者;⑦处于妊娠期、哺乳期等特殊时期患者。
1.2.3剔除标准 ①治疗期间发生严重不良事件需终止研究的患者;②治疗期间病情加重需转变治疗方案下者;③中途退出研究的患者。
1.3治疗方法 2组患者均按照《中国急性胰腺炎诊治指南(2013年)》[5]采取标准化西医基础治疗,包括禁食、胃肠减压、调节水电解质及酸碱平衡、液体复苏、器官功能保护、早期营养支持、使用抗生素等。在此基础上,对照组予以奥曲肽0.6 mg加入9 g·L-1氯化钠注射液500 mL静脉滴注,滴速控制为25 μg·h-1,每周1次。观察组在对照组治疗的基础上,加用大黄素1 g以温水混匀制成200 mL溶液,100 mL口服或鼻饲,另100 mL经肛门保留灌肠,保留时间为30 min,每日1次。2组均治疗7 d后评价疗效。
1.4观察指标 观察统计2组临床症状改善情况,统计并发症及死亡情况。治疗前及治疗7 d,评价急性生理功能与慢性健康评分(APACHEⅡ)和改良CT严重指数(MCTSI),得分越高表示病情越严重。治疗前及治疗7 d后,晨取患者空腹静脉血5 mL,采用全自动生化分析仪测定血清淀粉酶(AMY)和脂肪酶(LIP),采用酶联免疫吸附法(Elisa)测定血清AQP5、AQP6、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)水平。
1.5疗效标准 参照《临床疾病诊断依据治愈好转标准》[6]拟定疗效标准。显效:上腹疼痛、腹胀等症状消失,AMY恢复正常,CT或超声检查显示胰腺形态良好,无假性囊肿形成;有效:临床症状基本消失或明显好转,AMY降低,影像学检查有所改善;无效:临床症状、体征、影像学检查及AMY无明显改善。
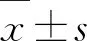
2 结果
2.12组患者的临床疗效比较 观察组的治疗总有效率(96.49%)高于对照组(84.21%),组间比较差异有统计学意义(χ2=4.930,P=0.026<0.05),见表1。
2.22组治疗前后APACHEⅡ和MCTSI评分比较 2组患者治疗前APACHEⅡ和MCTSI评分比较差异无统计学意义(P>0.05);治疗后,2组APACHE Ⅱ和MCISI评分均较治疗前降低,且观察组低于对照组,差异均有统计学意义(P<0.05)。见表2。

表2 2组治疗前后APACHEⅡ和MCTSI评分比较
2.32组临床症状缓解时间比较 观察组患者的退热时间、止吐时间、腹痛消失时间、腹胀消失时间、排气恢复时间、AMY正常时间和LIP正常时间均短于对照组,组间比较差异有统计学意义(P<0.05),见表3。

表3 2组临床症状缓解时间比较
2.42组患者治疗前后AMY和LIP水平比较 2组治疗前AMY和LIP水平比较,差异无统计学意义(P>0.05);治疗后,2组AMY和LIP水平均较治疗前降低,且观察组低于对照组,差异均有统计学意义(P<0.05),见表4。

表4 2组治疗前后AMY和LIP水平比较
2.52组治疗前后AQP5和AQP6水平比较 2组治疗前AQP5和AQP6水平比较,差异无统计学意义(P>0.05);治疗后,2组上述指标均较治疗前升高,且观察组高于对照组,差异均有统计学意义(P<0.05),见表5。

表5 2组治疗前后AQP5和AQP6水平比较
2.62组治疗前后IL-6和TNF-α水平比较 2组治疗前IL-6和TNF-α水平比较,差异无统计学意义(P>0.05);治疗后,2组上述指标均较治疗前降低,且观察组低于对照组,差异均有统计学意义(P<0.05),见表6。

表6 2组治疗前后IL-6和TNF-α水平比较
2.72组并发症及死亡率比较 观察组1例肾损伤,1例多器官功能障碍综合征(MODS),1例呼吸窘迫综合征(ARDS),总发生率为5.26%(3/57),其中1例因MODS死亡,死亡率为1.75%(1/57)。对照组1例休克,1例肾功能衰竭,2例MODS,3例ARDS,总发生率为12.28%(7/57),2例死于MODS,1例死于休克,死亡率为5.26%(3/57)。2组并发症总发生率及死亡率比较差异无统计学意义(χ2=1.754、1.036,P=0.185、0.309>0.05)。
3 讨论
AP具有发病因素众多、发病机制复杂、病情进展迅速、并发症多及死亡风险高等特点[7]。奥曲肽是AP非手术治疗的常用药物之一,属于生长激素类似物,作用类似于天然内源性生长素,但其作用更持久,可强效抑制胰酶、胃酸、胰岛素及胰高血糖素等的分泌,可减轻胰腺的病理生理损伤进程。同时,奥曲肽对多种炎症细胞因子及血小板活化因子的释放具有抑制作用,可减少内毒素的损伤,保护胰腺实质细胞[8]。尽管近年来临床在AP的治疗方面获得了较大进展,但AP发展为SAP的概率及死亡率仍处于较高水平。AP属于中医学“脾心痛”、“腹痛”等范畴,病机主要为中焦湿热壅滞,不通则痛,故可见恶心呕吐、腹痛、腹胀诸症,治疗当取消积导滞、通腑泻热、活血攻下之法[9]。中药大黄味苦性寒,归肝、脾、胃、大肠和心包经,具有清热泻火、泻下攻击、凉血解毒和逐瘀通经等功效,与AP病因病机基本相符。现代药理学研究表明,大黄的主要活性成分大黄素能够抑制胰酶分泌,保护肝肾功能,并可降低血液黏稠度、改善微循环等进而保护脏器功能[10]。同时,大黄素有助于增强肠道的蠕动,促进肠道水的分泌和胃肠功能的恢复[11]。此外,大黄素还有抗炎、抗肿瘤、抗氧化及免疫调节等作用,对AP具有多途径、多靶点治疗作用[12]。
本研究对AP患者在常规综合治疗的基础上,采用大黄素鼻饲或内服联合灌肠,鼻饲/内服可整体调理,保留灌肠则可直达病所,刺激肠道内毒素及病原菌的排出,保护胃肠黏膜,并可抑制继发性肠源性感染的发生[13]。此外,与奥曲肽联合用药避免了单一用药的不足,且可实现整体治疗与局部治疗,具有疗效协同或叠加的作用。研究结果显示,观察组治疗后APACHEⅡ和MCTSI评分均低于治疗前及对照组,退热时间、止吐时间、腹痛消失时间、腹胀消失时间和排气恢复时间均短于对照组,且总有效率较对照组明显提高。表明大黄素联合奥曲肽治疗AP更有利于改善患者的临床症状,减轻病情严重程度,促进胃肠功能恢复,提高整体疗效。AMY是临床诊断AP的经典血液学指标,在AP发病6~12 h即可明显升高,3 d左右逐渐下降,对病情评价具有重要意义[14]。LIP主要由胰腺胰泡分泌,其组织来源相对于AMY更少,故血清LIP水平升高时可提示胰腺胰泡损伤,且持续升高时间较AMY更长[15]。因此,检测AMY和LIP水平能较好地反映AP的病情变化情况。本研究中,2组治疗后血清AMY和LIP水平均明显下降,且观察组低于对照组,观察组的AMY和LIP水平恢复正常时间均较对照组明显缩短,进一步证实大黄素与奥曲肽联用治疗AP能够更好地保护胰腺,促进病情康复。分析其原因为:该方案通过中西医结合、整体与局部治疗结合,多靶点调节患者的生理状态以及胰腺病理生理变化,这也体现了中医学局部与整体调治的独特优势。2组的整体并发症发生率、死亡率差异小,均处于较低水平,且观察组更低,提示可能联合用药方案对改善预后具有一定作用,但还有待进一步大样本研究论证。
AP的发生机制主要为胰酶异常激活导致胰腺细胞受损,同时伴随单核-巨噬系统激活及炎症因子释放,如不及时治疗可形成全身炎症反应综合征(SIRS)甚至发生MODS[16]。IL-6是一种多效性促炎细胞因子,其过表达可刺激多种炎症细胞因子的释放,还可刺激氧自由基和弹力蛋白酶等的释放,从而加重胰腺细胞的损伤、凋亡[17]。TNF-α也被诸多研究证实在AP的发生及发展中具有重要作用,尤其是其高表达与SIRS密切相关,其血清浓度对疾病严重程度及临床预后均具有良好的预测作用。此外,TNF-α还可直接或间接损伤胰腺及胰腺外组织,介导机体炎症级联反应,促进疾病的发生与发展[18]。本研究结果显示,2组患者治疗后血清IL-6和TNF-α水平均较治疗前明显降低,且观察组明显低于对照组(P<0.05)。提示大黄素联合奥曲肽治疗较单用奥曲肽能更好地控制机体过度炎症反应,从而抑制胰腺细胞的损伤、坏死和凋亡。AQPs为水分子跨膜运输蛋白家族,广泛分布于机体各脏器细胞的表面,参与多种病理生理过程。AP患者由于大量炎症递质的释放加之血容量不足,可诱发肠道缺氧缺血,损伤胃肠道功能,且胰腺的解剖位置较为特殊,其毗邻的肠道为首要受累器官,故可影响肠道上皮细胞的通透性及其水代谢,导致AQPs表达异常[19]。AQPs的主要成员AQP5和AQP6对组织液体跨膜转运具有重要作用,已被证实在AP时呈明显低表达,且与IL-6和TNF-α密切相关[20]。本研究显示,2组治疗后血清AQP5和AQP6水平均明显升高,且观察组明显高于对照组。提示大黄素联合奥曲肽治疗AP可能通过减轻炎症反应、调节肠道血管透通性及水代谢等而发挥作用。
综上所述,大黄素联合奥曲肽治疗AP有利于改善临床症状、减轻病情并提高近期疗效,其机制可能与抑制AMY及LIP分泌、抑制炎症反应、上调AQP-5和AQP-6水平而调节肠道水代谢过程等有关。但本研究样本量少且观察指标有限,还有待进一步研究。

