原发性睾丸弥漫性大b细胞淋巴瘤鼻部转移1例报告
黄丽丽 李梅君
【摘要】原发性睾丸淋巴瘤(PTL)是一种少见的淋巴瘤亚群,预后差且无法治愈。最常见的是弥漫性大b细胞淋巴瘤。在较晚期,PTL有扩散到全身结外部位的倾向,如对侧睾丸和中枢神经系统;然而,鼻部复发是相当罕见的。在此,我们提出一例以前未见过的鼻部复发的PTL病例。
【关键词】睾丸淋巴瘤;大B细胞淋巴瘤;鼻部转移
【中图分类号】R733 【文献标识码】A 【文章编号】2026-5328(2021)01-019-04
PTL占原发性睾丸淋巴瘤的80-98%,约占所有非霍奇金淋巴瘤的1%。它最常见于50-60岁的>老年人。PTL患者的无进展生存期(PFS)为49个月,中位OS为96个月,5年独占生存期为60.2%。然而,血睾丸屏障和远处复发阻碍了许多有效的治疗方式。因此,原发性睾丸淋巴瘤仍被认为预后不良,无法治愈。睾丸的NHL可能与结外参与有关。
1.个案报告
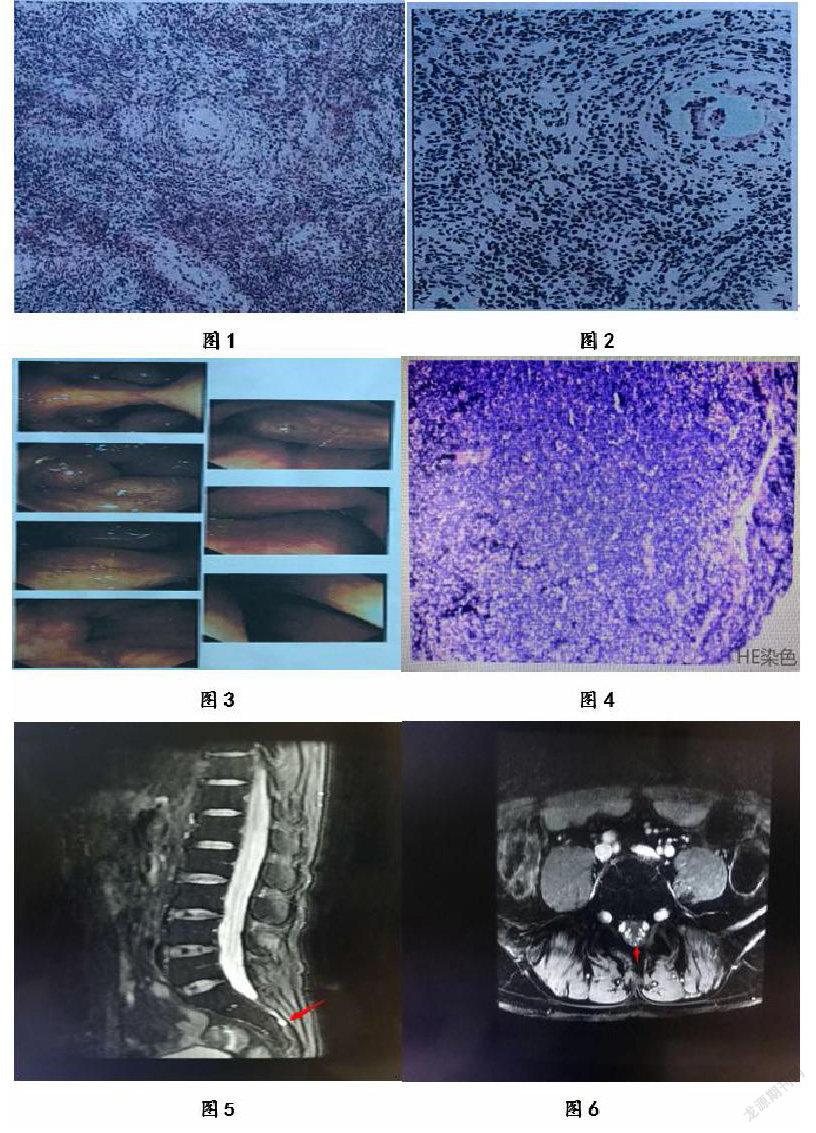
患者报告右睾丸增大2个多月,10天前疼痛加重;他于2019年5月13日住院。确诊右侧睾丸有一个5.3*3.3*3.5 cm的阴囊肿块。该肿块被怀疑为恶性睾丸肿瘤。病人接受睾丸切除术并切除肿块。病理活检结果与GCB型弥漫性大b细胞淋巴瘤一致。免疫组化显示肿瘤为CD3-、CD10+、CD20+、CD56-、GRB-、Pax5 +、BCL2 +,Ki67 +约占80%(图1-2)。建议评估BCL2、BCL6和MYC基因重排,以确定肿块是双重或三重打击淋巴瘤。但患者拒绝接受进一步检查,并转到我院接受进一步治疗。右头、脸麻木肿胀疼痛3个月,病情加重,视力模糊偏斜1个月。患者接受了头部磁共振成像(MRI)和增强CT扫描。前者显示淋巴瘤没有中枢神经系统受累的证据。双侧上颌窦、筛窦、蝶窦炎症;右下鼻甲肥大;鼻中隔轻度偏曲。后者提示鼻窦炎,左侧耳咽管和下鼻甲肥大。随后,患者在耳鼻喉科接受电子内窥镜检查,结果显示在鼻窦前部有一个非光滑的肿瘤(血供丰富),并延伸至右鼻腔后端及鼻中隔后端。侵入鼻咽尖后壁及左鼻腔后端(图3)。病理分析显示(右下鼻甲)弥漫性大b细胞淋巴瘤。免疫组化提示CK(上皮细胞+)、CyclinD1(-)、BCL-6(约70%+),MUM1(约50%+),CD30(-), Ki-67(约80%),CD3(少数细胞+),CD20(扩散+),pax-5(扩散+),BCL-2(+),CD21(-),CD10(约50%+)、CD23(-)、CD5(少数细胞+)、EBV(-)(图4)。超声检查示双侧腹股沟、腋窝、颈部淋巴结肿大。乳酸脱氢酶水平为131iu /L。他接受了7个周期的R-CHOP化疗和4次鞘内注射。经过2期化疗,患者临床症状略有改善,无不良副作用,但头部和面部左侧开始出现麻木疼痛,腹股沟淋巴结未缩小,腋窝和颈部淋巴结明显减少。患者经4个疗程治疗后,左侧头面部仍有麻木肿胀,腹股沟、腋窝、颈部淋巴结明显增大。考虑到治疗无效或病情进展,患者静脉注射高剂量MTX 5 g/m2,联合化疗利妥昔单抗。在治疗期间,他的转氨酶2比正常水平高出1倍。在完成两次鞘内注射2个月后,患者出现左上眼睑下垂,只留下间隙,明显腰痛。整个身体都处于恶病质的状态。体格检查发现左眼有瞳孔不等长及反射迟缓。眼眶及颅脑CT检查未见明显异常,眼底检查示双眼玻璃体混浊。腰椎MRI增强扫描显示部分腰椎间盘T2W1信号减弱,腰椎间盘3-4椎间盘向后延伸超过椎体后缘。注射GD-DTPA后,双侧神经根区和马尾神经明显增强,未排除淋巴瘤脊髓播散(图5-6)。由于考虑到患者的经济状况,未进行正电子发射断层摄影(PET)/CT、腰椎穿刺、FISH等基因检测。虽然没有进行彻底的系统评估,但临床症状表明复发。因为神经系统快速退化和对侧睾丸受累。根据预防中枢神经系统淋巴瘤复发指南,给予高剂量甲氨蝶呤鞘内化疗(5mg/m2)。然而,没有进行预防性阴囊照射。大剂量甲氨蝶呤两个周期治疗均未取得疗效,且患者的身体耐力也使其无法再进行周期治疗。因此,我们将治疗方案改为R2-CHOP(利妥昔单抗、环磷酰胺、表柔比星、长春斯碱、来那度胺、泼尼松)和R2-CHOPE(利妥昔单抗、环磷酰胺、表柔比星、长春斯碱、来那度胺、泼尼松、依托泊苷)联合2轮鞘内注射治疗。在7个周期的R-CHOP和4次鞘内注射甲氨蝶呤后,随访的腰椎MRI显示疾病进展。最后一次随访于2020年6月20日。
2.讨论
我们报告了一例晚期PTL的鼻部受累,在接受包括R-CHOP和鞘内注射在内的治疗后仍处于疾病的晚期。PTL涉及鼻腔是非常罕见的,从来没有报道过。本例患者鼻部症状不严重,主要表现为鼻塞。入院时上述症状加重,面部麻木。随后的内窥镜检查发现了一个不光滑的肿瘤,并且根据先前的睾丸淋巴瘤病史做出了鼻腔淋巴瘤的病理诊断。然后,病人接受了包括R-CHOP在内的6个周期的全身化疗。在最后两个R-CHOP周期中,他还接受了每月两次鞘内甲氨蝶呤(IT-MTX)的中枢神经系统预防。但病情进展,患者表现为左上眼睑下垂,视力模糊,双下肢行走困难,腰背明显疼痛。腰椎MRI增强扫描显示,注射GD-DTPA后腰段和马尾神经双侧神经根区明显增强,不排除淋巴瘤脊髓播散。为进一步改善预后,我们给予患者1周期R2-CHOPE联合2次鞘内治疗,但患者仍有下腰痛伴下肢疼痛。患者继续使用ibrutinib和PD-1治疗,效果仍然较差。
PTL是一种极为罕见的疾病,在所有原发性睾丸淋巴瘤中占80-98%,在所有非霍奇金淋巴瘤中占1%。它是一種罕见但侵袭性结外淋巴瘤,尽管最初完全缓解(CR),但因累及中枢神经系统和对侧睾丸而复发的风险很高。目前还没有预防PTL中枢神经系统复发的标准治疗方法,但结合睾丸切除术、全身化疗、中枢神经系统预防和对侧睾丸局部放疗或手术治疗已取得较好的疗效。睾丸切除术不仅可以用于病理诊断。同时也消除了由血睾丸屏障产生的化疗潜在障碍。R-CHOP化疗被认为在穿透血脑屏障和达到CNS的治疗浓度方面无效。Mannisto S等发现,免疫化疗并没有降低中枢神经系统复发的风险,这也与其他研究的结果一致,尽管与RICOVER-60试验的结果相矛盾。除R-CHOP外,符合条件的患者通常通过静脉或鞘内(it)甲氨蝶呤(MTX)或阿糖胞苷(cytarabine)进行中枢神经系统预防,可以更好地控制全身疾病和改善预后。Mannisto S还指出静脉注射优于鞘内化疗,特别是在老年患者。HD-MTX通常对原发性和继发性中枢神经系统淋巴瘤有效;然而,这是决定中枢神经系统浸润是否对MTX敏感的关键。对于MTX敏感的患者,推荐使用HD-MTX,随后采用噻替派或卡莫司汀为基础的调整方案和自体造血干细胞移植。其他通过血脑屏障的药物,如大剂量阿糖胞苷或异环磷酰胺,已与HD-MTX联合使用,并显示出令人鼓舞的疗效。另外,Tokiya等人证明,预防性RT确实是I/II期PTL患者的必要治疗措施。指南还表明,阴囊RT应给予25-30Gy,难治性疾病的初级治疗应给予30-55Gy。它还建议对大多数非霍奇金淋巴瘤亚型的未受累淋巴结不需要放疗。然而,中枢神经系统预防和放射治疗的作用仍不清楚。一项前瞻性研究是必要的,以提高我们对该肿瘤生物学的理解,并修订目前的治疗。例如,IELSG-10 II期试验表明,联合6个周期的R-CHOP-21、鞘内MTX和对侧睾丸照射治疗I-IIE期疾病的好结果(5年PFS和OS分别为74%和85%),RT消除了对侧睾丸的复发。目前,最令人兴奋的研究是CAR-T细胞治疗。出于安全原因,CAR-T产品只在没有中枢神经系统参与的血液肿瘤中推广,之前的两种或更多的治疗方法都没有成功。最近,Abramson等人使用CAR-T疗法成功治疗了1例CNS累及的难治性淋巴瘤,但没有严重的CRES。Matthew Frigault等回顾性总结了CD19 CAR-T细胞单中心试验治疗继发性中枢神经系统淋巴瘤的结果。这项研究表明,静脉注射tisagenlecleucel可能对中枢神经系统转移的有效。注射后28天评价CAR-T在中枢神经系统的疗效动态变化与在外周神经系统的疗效相似。更重要的是,本研究提示中枢神经系统参与并不是严重中枢神经系统毒性的危险因素。Ping N等人通过CAR-T治疗成功治疗了1例中枢神经系统受累和高东部肿瘤合作组(ECOG)评分的难治性PTL患者,没有严重毒性。综上所述,CAR-T治疗已广泛应用于R/R BALL和B细胞淋巴瘤,但不适用于CNS淋巴瘤或高ECOG评分的患者。对于CNS肿瘤负荷低的患者,CAR-T治疗并不是绝对禁忌症,但前提是及时、适当的治疗。在未来,CNS淋巴瘤侵袭患者也可以纳入CAR-T临床试验,并可能受益于CAR-T治疗。但是,这一假说还需要更广泛的临床试验来证实。
在分子生物學预后方面,Schmitz等总结了DLBCL中EZB、BN2、N1、MCD等分子簇的关键特征。瑞金医院574例DLBCL患者,通过指标筛选,筛选出72个基因进行分子分类。分子分型法将基因分为两类,一类是判断哪些患者容易复发的预后基因,另一类是判断哪些靶向药物适合患者的治疗相关基因。例如,EZB和BN2在PFS和OS上优于MCD和N1。Chapuy等人还总结了DLBCL中C0- C5分子团簇的关键特征,C0占主导的GEP剖面为NA;C1、C5属于ABC型,临床预后良好;C3、C4属于GCB型,预后不良;C2均属于。这种分子分型方法不仅操作相对简单,而且对患者的经济负担也不重。随着对DLBCL认识的不断深入,DLBCL的分子分类也进一步细化。
在我们之前的理解中,顽固性复发性淋巴瘤可以通过二线或三线药物治疗,最终有一天可以治愈。然而,SCHOLAR-1的研究推翻了这一观点。我们总结了该患者治疗失败的原因。首先,患者被发现处于晚期,而相关的遗传信息无法获得。其次,患者没有接受对侧睾丸的化疗,而是对中枢神经系统进行预防性治疗。最后,对原发性睾丸淋巴瘤的前瞻性临床试验很少,大多数治疗都是回顾性研究。因此我们推荐CAR-T细胞治疗或临床试验。由于它的稀有和侵袭性。需要进行更多的前瞻性试验,以确定治疗晚期PTL的新策略。
3.结论
在7次R-CHOP注射和4次鞘内甲氨蝶呤注射后,患者的病情仍有进展。随着CAR-T治疗的引入,PTL完全缓解和长期生存的报道也越来越多。因此,PTL的复发和转移也有望成为讨论的话题。考虑到PTL合并鼻部转移的病例少且既往预后不良,进一步的回顾性和前瞻性研究是有必要的,以更好地描述PTL患者鼻部复发的治疗。
参考文献:
[1]Sukswai,N.et al.Diffuse large B-cell lymphoma variants:an update.Pathology,2020.52(1):53-67.
[2]Ma,R.Z.et al.The survival and prognostic factors of primary testicular lymphoma:two-decade single-center experience.Asian J Androl,2018.20(6):615-620.
[3]Chen,B.et al.Adult primary testicular lymphoma: clinical features and survival in a series of patients treated at a high-volume institution in China.BMC Cancer,2020.20(1):220.
[4]Ellatif,M.et al.Two Cases of Primary Testicular Lymphoma Presenting with Direct Spread along the Spermatic Cord and Gonadal Vessels.Case Rep Radiol,2019,9:595.
[5]AA,G.et al.Testicular cancer among US men aged 50 years and older. Cancer Epidemiol,2018,55:68-72.
[6]Xu,H.and F.Yao,Primary testicular lymphoma:A SEER analysis of 1,169 cases.Oncol Lett,2019,17(3):3113-3124.
[7]Xu,J.et.al.Role of prophylactic radiotherapy in Chinese patients with primary testicular diffuse large B-cell lymphoma: a single retrospective study. J BUON,2019,24(2):754-762.
[8]Leivonen,S.K.et al.T-cell inflamed tumor microenvironment predicts favorable prognosis in primary testicular lymphoma. Haematologica, 2019,104(2):338-346.
[9]S, M.et al.Intravenous but not intrathecal central nervous system-directed chemotherapy improves survival in patients with testicular diffuse large B-cell lymphoma. European journal of cancer, 2019,115: 27-36.
[10]CK, C. and C. CY, How I treat patients with aggressive lymphoma at high risk of CNS relapse.Blood,2017,130(7):867-74.
[11]Tokiya, R.et al.Efficacy of prophylactic irradiation to the contralateral testis for patients with advanced-stage primary testicular lymphoma:an analysis of outcomes at a single institution. Int J Hematol, 2017. 106(4):533-540.
[12]Kridel,R.et al.Diffuse large B-cell lymphoma with testicular involvement: outcome and risk of CNS relapse in the rituximab era. Br J Haematol, 2017,176(2): 210-221.
[13]Jovanovic,M.P.et.al.Clinicopathological and fluorescence in situ hibridisation analysis of primary testicular diffuse large B-cell lymphoma:a single-centre case series. Pol J Pathol,2018,69(2):136-142.
[14]S,S.and M. B,Global pivotal phase 2 trial of the CD19-targeted therapy CTL019 in adult patients with relapsed or refractory(R/R) diffuse large B cell lymphoma (DLBCL)-an interim analysis. Hematological oncology, 2017,35:27.
[15]Abramson,J.S.et al.Anti-CD19 CAR T Cells in CNS Diffuse Large-B-Cell Lymphoma. N Engl J Med,2017,377(8): 783-784.
[16]Frigault, M.J.et al.Tisagenlecleucel CAR T-cell therapy in secondary CNS lymphoma. Blood,2019,134(11): 860-866.
[17]Ping,N.et al.Successful chimeric antigen receptor T cell therapy in a case of primary testicular diffuse large-B-cell lymphoma with central nervous system progression.Leuk Lymphoma,2019,60(11): 2814-2816.
[18]Schmitz,R.t al.Genetics and Pathogenesis of Diffuse Large B-Cell Lymphoma. N Engl J Med,2018,378(15):1396-1407.
[19]Chapuy,B.et al.Molecular subtypes of diffuse large B cell lymphoma are associated with distinct pathogenic mechanisms and outcomes.Nat Med,2018,24(5):679-690.
【作者簡介】黄丽丽(1991.12),女,汉族,江西省南昌人,硕士研究生学历,锦州医科大学血液内科住院医师,主要研究方向:淋巴瘤及多发性骨髓瘤。

