鄂西清风藤化学成分及其α-葡萄糖苷酶抑制活性研究
丁同同 邓颖 邓璐璐 李江 穆淑珍
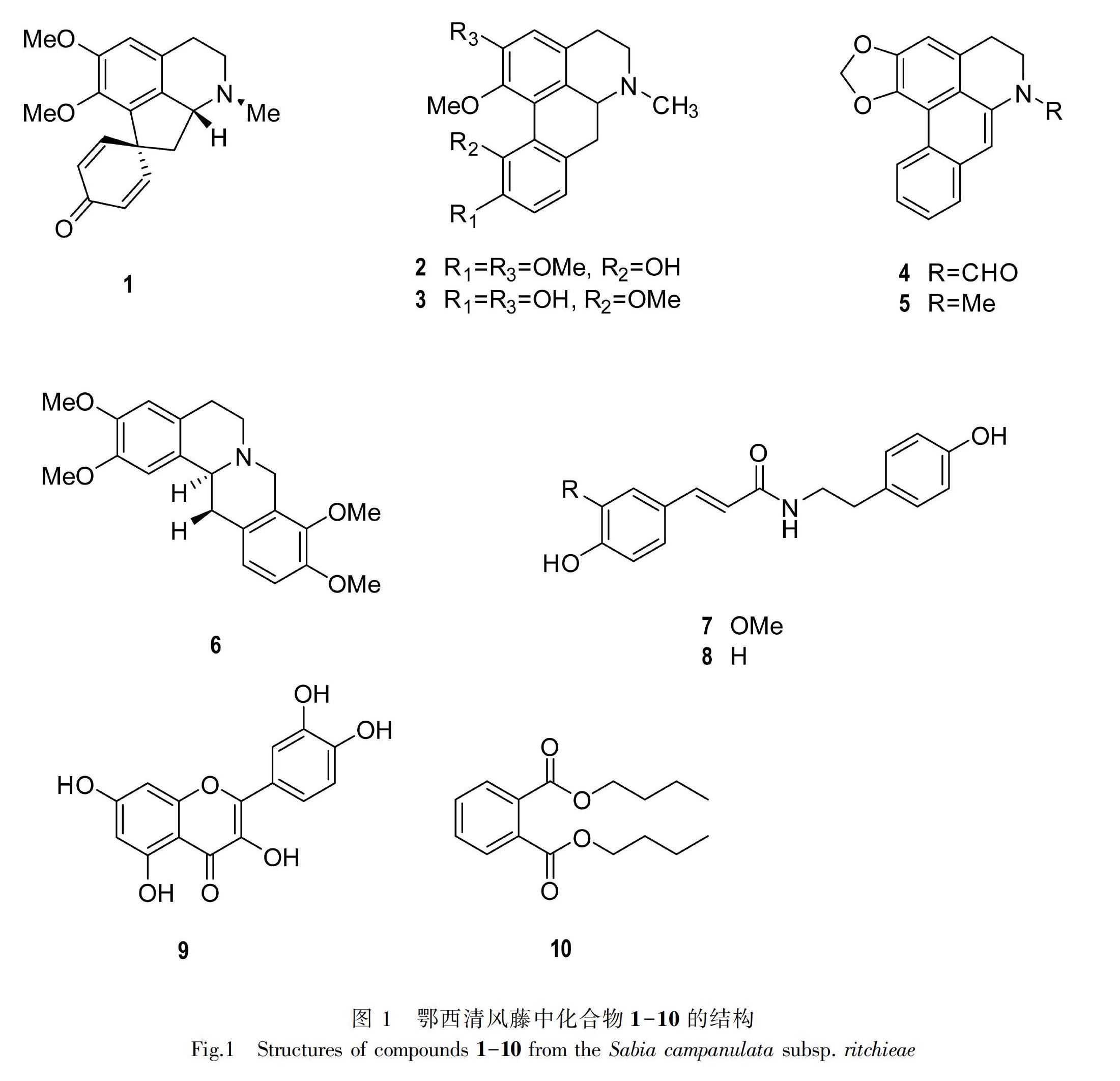
摘 要: 为了研究鄂西清风藤在降低血糖方面的物质基础,该研究采用硅胶柱色谱、Sephadex LH-20 凝胶柱色谱、半制备型高效液相色谱和重结晶等分离纯化方法从鄂西清风藤中提取分离化合物,并采用PNPG法筛选体外活性。结果表明:从鄂西清风藤95%乙醇提取物中分离得到10个单体化合物,分别为Pronuciferine(1)、(6R, 6aS, P)-Isocorydine(2)、N-methylhernovine(3)、N-formyldehydroanonain(4)、Roemerine(5)、(-)-Tetrahydropalmatine(6)、N-feruloyltyramine(7)、N-p-coumaroyltyramine(8)、Quercetin(9)、Dibutylphthalate(10)。所有化合物均為首次从该植物中分离得到。采用PNPG法筛选体外活性,研究结果显示化合物7、8、9具有明显的α-葡萄糖苷酶抑制活性,IC50值为6.1~38.8 μmol·L-1,其中化合物7、8的活性是阳性药阿卡波糖的40倍。该研究结果丰富了鄂西清风藤化学成分研究,为该植物在降血糖方面的开发提供了科学依据。
关键词: 鄂西清风藤, 物质基础, 生物碱, 体外活性,α-葡萄糖苷酶
中图分类号: Q946.91 文献标识码: A 文章编号: 1000-3142(2021)07-1070-07
Abstract: In order to investigate the material basis of Sabia campanulata subsp. ritchieae in reducing blood sugar. A total of 10 monomer compounds were isolated from 95% ethanol extracts of S. campanulata subsp. ritchieae by gel column chromatography, Sephadex LH-20 gel column chromatography, semi-preparative high performance liquid chromatography and recrystallization. Ten compounds were Pronuciferine (1), (6R, 6aS, P)-Isocorydine (2), N-methylhernovine (3), N-formyldehydroanonain (4), Roemerine (5), (-)-Tetrahydropalmatine (6), N-feruloyltyramine (7), N-p-coumaroyltyramine (8), Quercetin (9) and Dibutylphthalate (10). All compounds were isolated from the plant for the first time. In vitro activity results showed that compounds 7, 8 and 9 had significant α-glucosidase inhibitory activity with IC50=6.1-38.8 μmol·L-1 by the method of PNPG. Expecially, the activities of compounds 8 and 9 were 40 times more than the positive drug acarbose. This study enriched the chemical constituents of S. campanulata subsp. ritchieae, and also provided a scientific basis for the development of this plant resource in reducing blood sugar.
Key words: Sabia campanulata subsp. ritchieae, material basis, alkaloid, in vitro activity, α-glucosidase
鄂西清风藤(Sabia campanulata subsp. ritchieae)为清风藤科(Sabiaceae)清风藤属(Sabia)植物,落叶灌木,主要分布于江苏、湖南、贵州等长江以南地区。该植物具有缓解风湿痹痛、脊髓炎、水肿、脚气、骨折、脊髓炎、跌打肿痛等功效(温迪等,2016),药理作用主要表现在抗炎、免疫调节、保肝、抗病毒、降血压、抗心率失常等方面(熊力群等,2017)。保肝活性主要是五环三萜类化合物,这类化合物也是人们研究的热点(李曼姝等,2018)。
鄂西清风藤作为清风藤属植物的一个种,该植物化学成分的研究主要包括五环三萜类和苯衍生物,药理学研究表明该植物所含的五环三萜类化合物对ConA造成的免疫性肝损伤具有一定的保护作用(王莉云等,2019)。但是关于该植物中含有的生物碱类化合物及其可能的降糖活性未有报道。糖尿病是当今社会一种危害性极大的慢性疾病,可引起全身性的器官病变(沈佳奇,2019)。高血糖是糖尿病的主要症状。因此,具有降血糖活性的药物可以用于治疗糖尿病。α-葡萄糖苷酶抑制剂就是具有较好效果的降血糖类药物。着眼于来源广泛且价格低廉的传统药用植物,从中分离获得低毒且具有较好降糖活性的天然产物,可将其进一步开发成为天然绿色保健药品,用于糖尿病的辅助治疗,这将对糖尿病的防治具有重要意义。为丰富鄂西清风藤中的化学成分,探索其降糖保健药用价值,本文对鄂西清风藤95%乙醇提取物通过酸碱处理富集生物碱,运用现代天然产物分离技术得到10个化合物(图1),其中包含8个生物碱,所有化合物均为首次从该种植物中分离得到。为了探究鄂西清风藤的降糖功效,选择了与血糖控制相关的重要指标α-葡萄糖苷酶进行了体外活性筛选(袁海波等,2002),其中有机胺类生物碱和黄酮类化合物具有显著的α-葡萄糖苷酶抑制活性。
1 材料与仪器
实验所用药材由云南中医药大学张君老师采集并被鉴定为鄂西清风藤(Sabia campanulata subsp. ritchieae)的干燥枝叶,标本存放于贵州省中国科学院天然产物化学重点实验室。
仪器:Sim-HPLC半制备色谱仪(美国Wasters公司);ESI-MS电喷雾质谱仪(布鲁克道尔顿公司);600 MHz型超导核磁共振仪(瑞士Bruker公司);酶标仪(美国Thermo scientifc公司);N-1100型旋转蒸发仪(上海爱郎仪器有限公司)。
试剂:Sephadex LH-20葡聚糖凝胶(40~70 μm,瑞士Amersham Pharmacia Biotech AB 公司);柱层析硅膠(200 ~ 300目和300 ~ 400目),硅胶H(10 ~ 40 μm)和薄层层析用硅胶GF254(0.20 ~ 0.25 mm)(青岛海洋化工厂)。实验所用HPLC试剂均为色谱纯;二氯甲烷、石油醚、乙酸乙酯、甲醇、乙醇(分析纯,上海泰坦科技股份有限公司);氯仿(工业级,使用前经重蒸处理);阿卡波糖(上海源叶生物科技有限公司);α-葡萄糖苷酶(美国Sigma公司)。
2 实验方法
2.1 提取分离
鄂西清风藤干燥枝叶40 kg,95%乙醇加热回流提取3次,每次3 h。提取液减压浓缩,纯水置换乙醇,用10%的酒石酸调整溶液pH约为2后,用石油醚反复萃取至石油醚层无颜色;用饱和Na2CO3调整溶液pH约为10后,用氯仿反复萃取至氯仿层无颜色。浓缩回收溶剂,得到氯仿萃取物580 g。取氯仿萃取物通过常压硅胶柱层析用不同比例氯仿∶甲醇(100∶1~ 0∶1)梯度洗脱,获得5段粗分段产物Fr.1-Fr.5。Fr.1(500 mg)通过Sephadex LH-20葡聚糖凝胶(氯仿∶甲醇=1∶1)以及半制备高压液相色谱(乙睛∶水=80∶1~40∶1)分离得到化合物4(5 mg)和化合物6(50 mg)。Fr.2(110 g)经正相硅胶柱色谱梯度洗脱(二氯甲烷∶甲醇=100∶1~ 0∶1)得到Fr.2.1-Fr.2.10。Fr.2.1(3 g)经反复重结晶(氯仿和甲醇混合溶剂)得到化合物2(500 mg)。Fr.2.3(12 g)经正相硅胶柱色谱分离(洗脱剂为石油醚∶氯仿=5∶1)以及重结晶 (甲醇) 得到化合物1(1.7 g),之后经正相硅胶柱色谱洗脱(洗脱剂为石油醚∶二乙胺=20∶1)得到化合物5(470 mg),剩余部分通过Sephadex LH-20葡聚糖凝胶(甲醇),以及反复硅胶柱色谱得到化合物3(60 mg)和化合物10(20 mg)。Fr.2.8-Fr.2.10(38 g)经反复重结晶(氯仿甲醇混合溶剂)和正相硅胶柱色谱洗脱(石油醚∶二乙胺=5∶1)得到化合物7(3 g)、化合物8(360 mg)和化合物9(280 mg)。
2.2 α-葡萄糖苷酶活性筛选
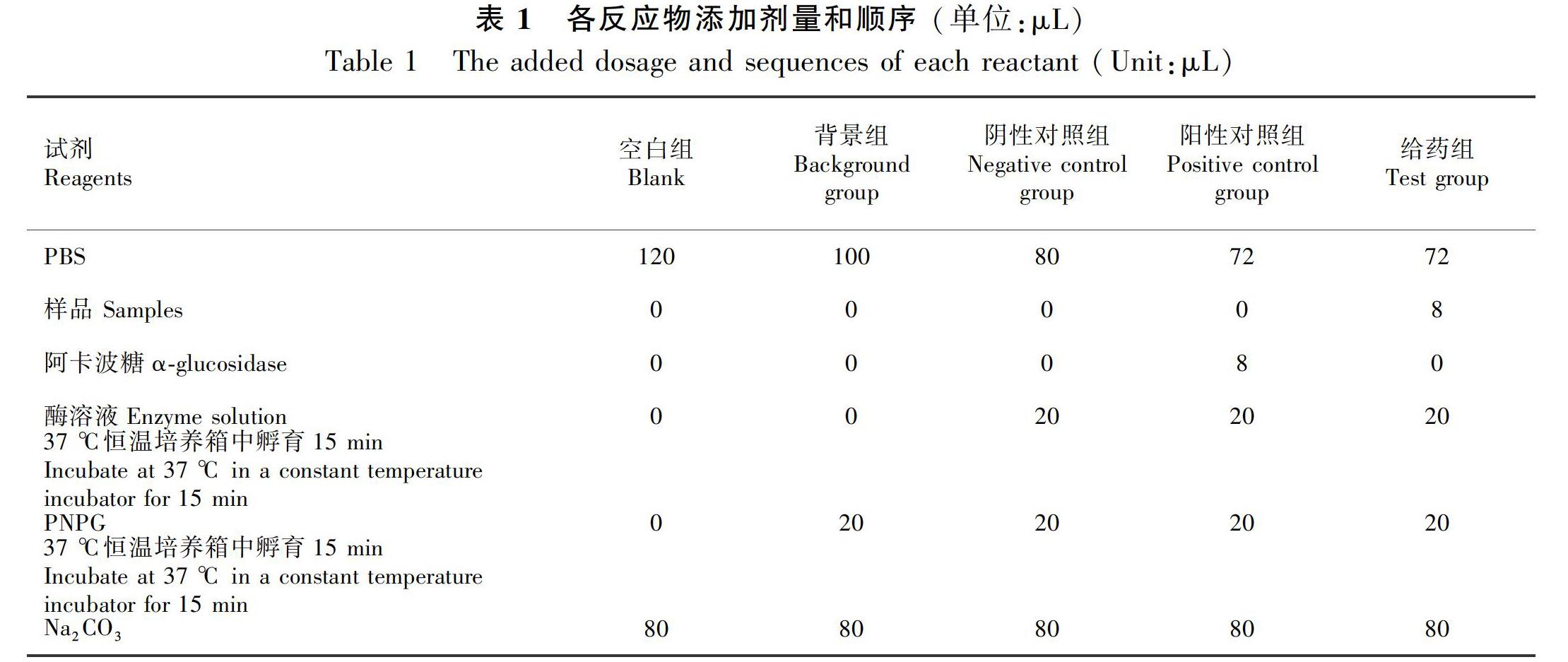
α-葡萄糖苷酶抑制活性测定使用PNPG法(Chen et al.,2016)。将PBS、不同浓度的样品或阳性药、α-葡萄糖苷酶溶液共120 μL,震荡混匀,37 ℃恒温培养箱中孵育15 min;加入20 μL的PNPG(2.5 mmol·L-1),震荡混匀,37 ℃恒温培养箱中继续孵育15 min;加入Na2CO3(0.2 mmol·L-1)溶液80 μL终止反应,405 nm波长下酶标仪测其吸光度OD值。实验共设空白组、背景组、阴性对照组、阳性对照组、给药组5个组,每组3个平行复孔。各组试剂加入量及顺序如表1所示。
抑制率=[1-(OD样品-OD背景)/(OD阴性-OD空白]×100%。
3 结果与分析
3.1 结构鉴定
化合物1 黄色固体粉末,碘化铋钾反应呈阳性。ESI-MS m/z 334 [M + Na]+。1H-NMR(600 MHz,CDCl3 ) δ:7.03(d,J=10.0 Hz,1H,H-12),6.87(d,J=10.8 Hz,1H,H-8),6.63(s,1H,H-3),6.38 (d,J=9.9 Hz,1H,H-9),6.27(d,J=11.6 Hz,1H,H-11),3.79(s,3H,2-OMe),3.58(s,3H,1-OMe),3.44(m,1H,H-6a),3.10(m,1H,H-5α),2.96(m,1H,H-4β),2.82(s,1H,H-4α),2.51(m,2H,H-7β,5β),2.36(s,3H,N-Me),2.22(t,J=11.2 Hz,1H,H-7α);13 C-NMR(150 MHz,CDCl3 ) δ:186.24(C-10),153.62(C-2),153.37(C-8),150.17(C-12),144.38(C-1),134.38(C-3b),132.67(C-13a),128.18(C-3a),127.80(C-9),127.36(C-11),111.77(C-3),65.68(C-6a),61.01(1-OMe),56.28(2-OMe),54.90(C-5),51.20(C-13),47.47(C-7),43.51(C-4),27.45(N-Me)。以上数据与文献(Fajardo et al.,2009)报道一致,故鉴定化合物1为Pronuciferine。
化合物2 黄色固体粉末,碘化铋钾反应呈阳性。ESI-MS m/z 364 [M + Na]+。1H-NMR(600 MHz,CDCl3 ) δ:6.82(q,J=8.1 Hz,2H,H-8,9),6.67(s,1H,H-3),3.87(d,J=13.6 Hz,6H,2,10-OMe),3.68(s,3H,1-OMe),3.16-3.09(m,1H,H-4α),3.01(dd,J=13.2,3.5 Hz,1H,H-7α),2.99-2.94(m,1H,H-5α),2.86-2.79(m,1H,H-6aα),2.69-2.62(m,1H,H-4β),2.49(s,3H,N-Me),2.45-2.36(m,2H,H-5β,7β);13 C-NMR(150 MHz,CDCl3 ) δ:151.26(C-2),149.46(C-10),144.02(C-11),142.16(C-1),130.22(C-7a),130.03(C-1b),129.28(C-3a),125.93(C-1a),120.19(C-11a),118.96(C-8),111.13(C-3),110.98(C-9),62.92(C-6a),62.02(1-OMe),56.12(10-OMe),55.83(2-OMe),52.76(C-5),43.93(N-Me),35.94(C-7),29.39(C-4)。以上数据与文献(Ferreira et al.,2010)报道一致,故鉴定化合物2为(6R,6aS,P)-Isocorydine。
化合物3 黄色固体粉末,碘化铋甲反应呈阳性。ESI-MS m/z 352 [M + Na]+。1H-NMR(600 MHz,DMSO-d6 ) δ:6.77(d,J=8.0 Hz,1H,H-8),6.62(d,J=8.0 Hz,1H,H-9),6.62(s,H,H-3),3.72(d,J=2.7 Hz,6H,1,11-OMe),3.30-3.13(m,2H,H-4,7α),3.09-2.95(m,2H,H-5,7β),2.63(s,3H,N-Me),2.33(t,J=13.1 Hz,1H,H-6α);13 C-NMR(150 MHz,DMSO-d6 ) δ:149.60(C-2,10),146.88(C-11),145.19(C-1),128.69(C-3a),125.70(C-1b),122.48(C-11a),121.63(C-1a),120.32(C-7a),116.91(C-8),110.74(C-9),110.43(C-2),62.92(C-6a),56.21(1-OMe),55.98(11-OMe),52.56(C-5),42.51(N-Me),34.44(C-7),27.42(C-4)。以上数据与文献(刘大护等,2011)报道一致,故鉴定化合物3为N-methylhemovine。
化合物4 白色固体粉末,碘化铋钾反应呈阳性。ESI-MS m/z 314 [M + Na]+。1H-NMR(600 MHz,CDCl3 ) δ:9.04-8.98(m,1H,H-11),8.91(s,1H,-NCHO),7.81-7.75(m,1H,H-8),7.61-7.52(m,2H,H-9,10),7.23(s,1H,H-7),7.05(s,1H,H-3),6.26(d,J=7.2 Hz,2H,-OCH2O-),4.13(dt,J=16.3,8.3 Hz,2H,H-5),3.20(t,J=5.9 Hz,2H,H-4);13 C-NMR(150 MHz,CDCl3 ) δ:160.76(-NCHO),146.07(C-2),142.50(C-1),133.55(C-6a),131.68(C-11a),127.46(C-10),127.35(C-8),127.13(C-11),126.83(C-7a),126.59(C-3a),125.95(C-9),118.87(C-11c),117.20(C-11b),111.43(C-7),109.02(C-3),101.44(-OCH2O-),38.68(C-5),30.31(C-4)。以上数据与文献(陈艳等,2015)报道一致,故鉴定化合物4为N-formyldehydroanonain。
化合物5 黄色油状液体,碘化铋钾反应呈阳性。ESI-MS m/z 280 [M + H]+。 1H-NMR(600 MHz,CDCl3 ) δ:8.09(d,J=7.6 Hz,1H,H-11),7.34(t,J=7.2 Hz,1H,H-9),7.27(dt,J=14.6,6.0 Hz,2H,H-8,10),6.58(s,1H,H-3),6.09(d,J=1.5 Hz,1H,-OCH2O-),5.94(s,1H,-OCH2O-),3.22-3.12(m,3H,H-4b,5a,6a),3.06(ddd,J=11.4,5.8,1.2 Hz,1H,H-7b),2.75-2.63(m,2H,H-4a,7a),2.57(s,3H,N-Me),2.56-2.51(m,1H,H-5a);13 C-NMR(150 MHz,CDCl3 ) δ:146.64(C-2),142.53(C-1),135.40(C-7a),131.08(C-11a),127.15(C-1b),128.14(C-8),127.42(C-9),126.94(C-10),126.82(C-11),126.53(C-3a),116.39(C-1a),107.43(C-3),100.65(-OCH2O-),62.06(C-6a),53.54(C-5),43.88(N-Me),34.63(C-7),29.16(C-4) 。以上数据与文献(Chen et al.,1998)报道一致,故鉴定化合物5为Roemerine。
化合物6 淡黄色固体粉末,碘化铋钾反应呈阳性。ESI-MS m/z 356 [M + H]+。1H-NMR(600 MHz,CDCl3 ) δ:6.88(d,J=8.3 Hz,1H,H-12),6.79(d,J=8.3 Hz,1H,H-11),6.73(s,H,H-1),6.62(s,1H,H-4),4.24(d,J=15.7 Hz,1H,H-8),3.86(dd,J=16.2,7.3 Hz,12H,2,3,9,10-OMe),3.54(dd,J=9.3,6.4 Hz,2H,H-5),3.31-3.10(m,2H,H-13),2.83(dd,J=15.5,11.6 Hz,1H,H-13a),2.64(dt,J=11.0,9.6 Hz,2H,H-6);13 C-NMR (150 MHz, CDCl3) δ:150.29(C-10),147.50(C-3),147.45(C-2),145.09(C-9),129.72(C-13b),128.71(C-12a),127.76(C-8a),126.82(C-4a),123.88(C-12),111.36(C-4),110.96(C-11),108.61(C-1),60.19(C-13a),59.34(2-OMe),56.09(3-OMe),55.89(9-OMe),55.86(10-OMe),54.03(C-8),51.54(C-6),36.36(C-13),29.13(C-5)。以上數据与文献(Blanchfield et al.,2003)报道一致,故鉴定化合物6为(-)-Tetrahydropalmatine。
化合物7 白色固体粉末,碘化铋钾反应呈阳性。ESI-MS m/z 336 [M + Na]+。1H-NMR(600 MHz,MeOD) δ:7.46(d,J=15.7 Hz,1H,H-β),7.12(t,J=7.1 Hz,1H,-CONH-),7.10-7.05(m,2H,H-3′,6′),7.04(dd,J=8.2,1.9 Hz,1H,H-6″),6.85-6.80(m,1H,H-3″),6.78-6.72(m,2H,H-2′,5′),6.43(d,J=15.7 Hz,1H,H-α),3.89(s,3H,OMe),3.55-3.44(m,2H,H-2),2.78(t,J=7.4 Hz,2H,H-1);13 C-NMR(150 MHz,MeOD) δ:167.81(C-1),155.53(C-4″),148.43(C-1′),147.89(C-4′),140.68(C-2),129.93(C-1″),129.38(C-2″,C-6″),126.90(C-3′),121.85(C-6′),117.37(C-2′),115.10(C-5′),114.91(C-3″,5″),110.16(C-3),55.00(OMe),41.17(C-α),34.42(C-β)。以上数据与文献(Min et al.,2006)报道一致,故鉴定化合物7为N-feruloyltyramine。
化合物8 黄色固体粉末,碘化铋钾反应呈阳性。ESI-MS m/z 306 [M + Na]+。1H-NMR(600 MHz,DMSO-d6 ) δ:8.02(t,J=5.6 Hz,1H,-CONH-),7.39(d,J=8.6 Hz,2H,H-2′,6′),7.33(d,J=15.7 Hz,1H,H-β),7.02(d,J=8.4 Hz,2H,H-2″,6″),6.80(d,J=8.6 Hz,2H,H-3′,5′),6.72-6.64(m,2H,H-3″,5″),6.41(d,J=15.7 Hz,1H,H-α),3.34(dd,J=14.1,6.5 Hz,2H,H-2),2.65(t,J=7.4 Hz,2H,H-1);13 C-NMR(150 MHz,DMSO-d6 ) δ:165.80(C=O),159.27(C-4″), 156.10(C-4′),139.06(C-β),130.01(C-1′),129.94(C-2′,6′),129.65(C-2″,6″),126.40(C-1″),119.20(C-α),116.21(C-3′,5′),115.59(C-3″,5″),41.16(C-1),34.92(C-2)。以上数据与文献(Chio & Go,1996)报道一致,故鉴定化合物8为N-p-coumaroyltyramine。
化合物9 淡黄色固体粉末。ESI-MS m/z 301 [M - H]-。1H-NMR(600 MHz,DMSO-d6 ) δ:7.67(d,J=2.2 Hz,1H,H-2′), 7.57-7.51(m,1H,H-6′), 6.89(t,J=7.7 Hz,1H,H-5′), 6.40(d,J=2.0 Hz,1H,H-8),6.18(d,J=2.0 Hz,1H,H-6);13 C-NMR(150 MHz,DMSO-d6 ) δ:176.24(C-4),164.84(C-7),161.16(C-9),156.64(C-5),148.20(C-4′),147.15(C-2),145.54(C-3′),136.16(C-3),122.41(C-1′),120.41(C-6′),116.07(C-5′),115.48(C-2′),103.30(C-10),98.77(C-6),93.87(C-8)。以上数据与文献(程永现,2001)报道一致,故鉴定化合物9为Quercetin。
化合物10 黄色油状液体。ESI-MS m/z 301 [M + Na]+。1H-NMR(600 MHz,CDCl3 ) δ:7.73-7.68(m,2H,H-3,6),7.54-7.50(m,2H,H-4,5),4.30(t,J=6.7 Hz,4H,H-1′),1.74-1.66(m,4H,H-2′),1.48-1.39(m,4H,H-3′),0.95(t,J=7.4 Hz,6H,H-4′);13 C-NMR(150 MHz,CDCl3 ) δ:167.72(COO-),132.33(C-1,2),130.92(C-4,5),128.84(C-3,6),65.56(C-1′),30.58(C-2′),19.19(C-3′),13.73(C-4′)。以上數据与文献(Li et al.,2009)报道一致,故鉴定化合物10为Dibutylphthalate。
3.2 α-葡萄糖苷酶活性筛选
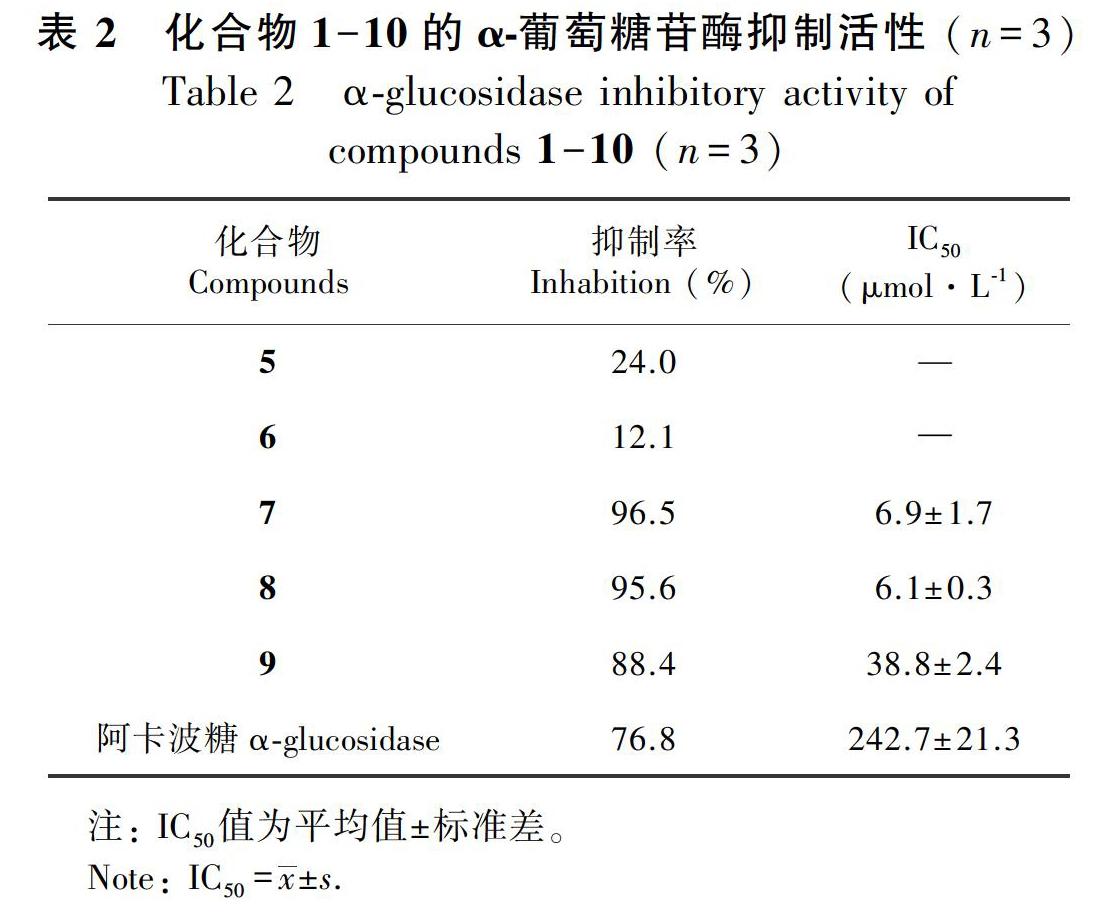
按2.1方法测试化合物1-10的α-葡萄糖苷酶抑制活性,结果如表2所示。样品溶液浓度为1 mmol·L-1时,化合物5、6、7、8、9表现出一定的α-葡萄糖苷酶抑制活性,但化合物5和6抑制活性较弱,未继续测IC50值。化合物7、8、9显示出明显的α-葡萄糖苷酶抑制活性,设置不同的给药浓度梯度,测得化合物7、8、9的IC50值分别为6.9、6.1、38.8 μmol·L-1。同等给药浓度条件下,化合物7和8的活性是阳性药阿卡波糖(IC50=242.7 μmol·L-1)的40倍,化合物9是阳性药的6倍,其余化合物无活性。
4 讨论与结论
本研究利用生物碱呈碱性的特性,酸化使之成盐易溶于水中,利用石油醚萃取除去提取物中的油脂,萜类等脂溶性非生物碱成分。碱化使盐变为原来的生物碱,利用生物碱易溶于氯仿的特点实现对鄂西清风藤中生物总碱的富集。本研究总共得到6个异喹啉类生物碱,2个有机胺类生物碱,2个非生物碱。所有化合物均为首次从该植物中分离得到。
从已报道的清风藤属植物化学成分来看,目前分离得到的生物碱类型主要是阿朴菲类生物碱(温迪等,2016),该类化合物具有抗A-549、HCT-8、KB、P-388、L-1210等恶性肿瘤细胞增殖及抗心律失常的效果(Wu et al.,1989;Wang et al.,2016)。另外,同属植物簇花清风藤中还含有机胺类生物碱N-反式香豆酰酪胺,该类生物碱具有抗炎、抗病毒、抗氧化、抑制α-葡萄糖苷酶等多种生物活性(李媛,2018)。这两类生物碱均为首次在鄂西清风藤中分离得到。从鄂西清风藤生物碱类型占比来看,化合物1、7在该植物中含量较大(克级),说明鄂西清风藤中不仅含阿朴菲类生物碱,同时也含有大量有机胺类(香豆酰酪胺类)生物碱。这两种生物碱,不仅可做为该药材质量标志物用于质量控制,还可作为该植物化学分类的重要参考。
糖尿病是由多种原因造成的以血糖升高为特征的代谢紊乱性疾病,可引起全身性器官病变,严重影响人民生活水平(沈佳奇,2019)。α-葡萄糖苷酶在体内分布广泛,并且参与许多生化过程,在体内扮演着重要角色,它的活性与很多代谢性疾病如糖尿病、癌症、病毒感染等息息相关。高效的α-葡萄糖苷酶抑制剂是糖尿病患者有效控制血糖的一种新手段(袁海波等,2002)。因此,本研究对所得单体化合物进行了α-葡萄糖苷酶抑制活性筛选,发现化合物5、6、7、8和9都具有α-葡萄糖苷酶抑制活性,尤其是化合物7、8的活性是阳性药阿卡波糖的40倍左右,化合物9的活性是阳性药的6倍左右。化合物7、8、9在鄂西清风藤中含量较为丰富,这就表明鄂西清风藤很可能具有潜在的降糖作用,这也是我们进一步研究的方向。本研究不仅丰富了鄂西清风藤植物化学成分的种类,也为鄂西清风藤作为降血糖药用植物资源开发与利用提供了实验依据,具有重要的研究价值。
参考文献:
BLANCHFIELD JT, SANDS DPA, KENNARD CHL, et al., 2003. Characterisation of alkaloids from some Australian Stephania (Menispermaceae) species [J]. Phytochemistry, 63: 711-720.
CHEN KS, CHANG FR, CHIA YC, et al., 1998. Chemical consituents of Neolitsea parvigemma and Neolitsea konishil [J]. J Chin Chem Soc, 45: 103-110.
CHEN Y, HAUNG T, YUAN CM, et al., 2015. Chemical constituents of Sabia parviflora [J]. Chin Trad Herb Drug, 46(21): 3146-3150. [陈艳, 黄滔, 苑春茂, 等, 2015. 小花青风藤化学成分的研究 [J]. 中草药, 46(21): 3146-3150.]
CHEN Z, HAO J, WANG L, et al., 2016. New α-glucosidase inhibitors from marine algae-derived Streptomyces sp. OUCMDZ-3434 [J]. Sci Rep, 6: 1-8.
CHENG YX, ZHOU J, TAN NH, 2001. The chemical consituents of Parakmeria yunnanensis [J]. Acta Bot Yunnan, 23(2): 352-356. [程永现, 周俊, 谭宁华, 2001. 云南拟单性木兰的化学成分 [J]. 云南植物研究, 23(2): 352-356.]
CHOI JS, GO CH, 1996. Further study on the constituents of Allium tuberosum leaves [J]. Arch Pharm Res, 19(1): 60-61.
FAJARDO V, ARAYA M, CUADRA P, et al., 2009. Pronuciferine N-Oxide, a proaporphine N-Oxide alkaloid from Berberis coletioides [J]. J Nat Prod, 72: 1355-1356.
FERREIRA MLR, PASCOLI ICD, NASCIMENTO IR, et al., 2010. Aporphine and bisaporphine alkaloids from Aristolochia lagesiana var. intermedia [J]. Phytochemistry, 71: 469-478.
LI JT, YIN BL, LIU Y, et al., 2009. Mono-aromatic constituents of Dendrobium longicornu [J]. Chem Nat Compd, 45(2): 234-236.
LI MS, LI JQ, HU JZ, et al., 2018. Chemical constituents of Sabia parviflora and their hepatocyte protection activity [J]. Bio Res, 40(8): 491-494. [李曼姝, 李劍桥, 胡建忠, 等, 2018. 小花清风藤的化学成分及其对肝细胞的保护作用 [J]. 生物资源, 40(8): 491-494.]
LI Y, 2018. Cis-trans isomerization and solubilization of trans-N-p-coumaroyltyramine [D]. Kaifeng: Henan University: 1-6. [李媛, 2018. 反式香豆酰酪胺的顺反异构化和增溶作用研究 [D]. 开封: 河南大学: 1-6.]
LIU DH, ZHANG TC, LIU JX, et al., 2011. Chemical constituents of alkaloids from Dicranostigma leptopodum [J]. Chin Trad Herb Drug, 42(8): 1505-1508. [刘大护, 张天才, 柳军玺, 等, 2011. 秃疮花生物碱类化学成分研究 [J]. 中草药, 42(8): 1505-1508.]
MIN YD, CHOI SU, LEE KR, 2006. Aporphine alkaloids and their reversal activity of multidrug resistance (MDR) from the stems and rhizomes of Sinome-nium acutum [J]. Arch Pharm Res, 29(8): 627-632.
SHEN JQ, 2019. Preparation of malt root polypeptide and its inhibition on α-glucosidase Activity [D]. Guangzhou: South China University of Technology: 22-25. [沈佳奇, 2019. 麦芽根多肽制备及其抑制α-葡萄糖苷酶活性的研究 [D]. 广州: 华南理工大学: 22-25.]
WANG H, CHENG X, KONG SJ, et al., 2016. Synthesis and structure-activity relationships of a series of aporphine derivatives with antiarrhythmic activities and acute toxicity [J]. Molecules, 21(12): 1555.
WANG LY, SUN QW, MU SZ, et al., 2019. Study on the chemical constituents of Sabia campanulata subsp. ritchieae [J]. Guangzhou Chem Ind, 47(7): 102-107. [王莉云, 孙庆文, 穆淑珍, 等, 2019. 鄂西清风藤的化学成分研究 [J]. 广州化工, 47(7): 102-107.]
WEN D, SUN QW, PAN GJ, et al., 2016. Research progress in Sabia medical plants [J]. Guizhou Sci, 34(3): 25-30. [温迪, 孙庆文, 潘国吉, 等, 2016. 清风藤属药用植物研究进展 [J]. 贵州科学, 34(3): 25-30.]
WU YC, LIOU, YF, LU SH, et al., 1989, Cytotoxicity of isoquinoline alkaloids and their N-Oxides [J]. Plant Med, 55: 163-165.
XIONG LQ, YU SP, LI WP, et al., 2017. Clinical application research in Sabia [J]. Asia-Pacific Trad Med, 13(5): 63-65. [熊力群, 余舒鹏, 李文龙, 等, 2017. 清风藤临床应用研究概况 [J]. 亚太传统中药, 13(5): 63-65.]
YUAN HB, SHEN ZM, YIN JW, et al., 2002. The hypoglycemic effect of α-glucosidase inhibitor separated from Schisandra chinensis [J]. Chin J Biochem Pharm, 23(2): 112-114. [袁海波, 沈忠明, 殷建偉, 等, 2002. 五味子中α-葡萄糖苷酶抑制剂对小鼠的降糖作用 [J]. 中国生化药物杂志, 23(2): 112-114.]
(责任编辑 何永艳)

