坦布苏病毒感染DF-1细胞入侵途径的初步研究
章丽娇 李银 刘青涛 刘宇卓 韩凯凯 赵冬敏 黄欣梅 杨婧


摘要:坦布苏病毒是我国新发易引起家禽出现严重产蛋下降和中枢神经系统异常的重要传染病病原。通过特异性的化学阻断剂预处理DF-1细胞,噬斑计数法检测其对病毒滴度的影响,相对荧光定量RT-PCR检测其对病毒核酸表达的影响,并对影响显著的结果进行吸附和内吞试验。结果显示,网格蛋白抑制剂氯丙嗪和动力蛋白抑制剂dynasore可显著降低病毒滴度和病毒核酸表达,且主要作用于内吞过程,对病毒吸附无影响。胆固醇抽提剂甲基-β-环糊精、小窝蛋白抑制剂genistein及胞吞抑制剂EIPA对病毒滴度无明显影响。结果表明,坦布苏病毒入侵DF-1细胞依赖于网格蛋白和动力蛋白,而不依赖于胆固醇、小窝蛋白和胞吞作用。
关键词:坦布苏病毒;DF-1细胞;入侵
中图分类号:S852.65+7 文献标志码: A
文章编号:1002-1302(2021)15-0155-04
收稿日期:2021-03-14
基金项目:江苏省自然科学基金(编号:BK20180303);国家自然科学基金(编号:31802200)。
作者简介:章丽娇(1987—),女,浙江德清人,博士,助理研究员,主要从事家禽病毒分子生物学研究。E-mail:zhang62810003@126.com。
坦布苏病毒隶属黄病毒科黄病毒属,于2010年4月首先在我国东南沿海地区养鸭场暴发并迅速蔓延至我国大部分主要水禽养殖地区[1-2]。患病肉鸭主要表现为采食下降和生长缓慢,患病蛋鸭主要表现为产蛋下降,严重者均可出现共济失调、瘫痪等中枢神经系统症状,发病率高达100%,死亡率为5%~30%[3]。迄今为止,病毒感染宿主范围十分广泛,不仅包括不同品种的家养鸭,还蔓延至鹅、鸡、肉鸽甚至麻雀等其他禽类[4-7]。我国是水禽生产大国,坦布苏病毒的暴发和流行对水禽养殖业造成了巨大的经济损失。
病毒感染宿主细胞是一个复杂的过程,其中入侵是病毒对靶细胞建立有效感染的第一步,包括病毒与细胞受体结合、内吞与脱壳。研究报道,病毒可通过多种内吞方式进入宿主细胞,主要包括网格蛋白介导的内吞途径、小窝蛋白介导的内吞途径、巨胞饮作用及其他尚未明确的内吞机制等[8]。同时,各种宿主细胞元件诸如胆固醇、动力蛋白、Rab5等能够被病毒利用参与内吞过程。不同病毒入侵不同宿主细胞的方式是多样化的。比如,乙型脑炎病毒通过网格蛋白介导的内吞途径入侵C6/36和 HeLa 细胞[9-10],通过小窝蛋白介导的内吞途径入侵神经细胞[11];而西尼罗病毒则依赖脂笩入侵神经细胞和HeLa细胞[12]。
坦布苏病毒感染宿主广,有组织泛嗜性,体外感染鸭胚成纤维细胞(DEF)、鸡胚成纤维细胞(CEF)、幼仓鼠肾细胞(BHK-21)、非洲绿猴肾细胞(Vero)及C6/36蚊子细胞等多种细胞系。入侵作为病毒感染的首要环节,与病毒泛嗜性密切相关。研究入侵对病毒致病机制的深入理解具有重要意义。目前,对坦布苏病毒入侵方面的研究报道较少,故本研究利用针对不同内吞途径的特异性化学阻断剂初步探讨坦布苏病毒入侵DF-1细胞的机制,为深入阐明坦布苏病毒的入侵机制提供试验依据,也为病毒的防控提供新的思路。
1 材料与方法
1.1 毒株和细胞
试验所用坦布苏病毒JS804株和DF-1细胞均由笔者所在实验室保存。
1.2 主要试剂和耗材
氯丙嗪(CPZ)、dynasore、甲基-β-环糊精(MβCD)、genistein和EIPA均,购自Sigma公司;胎牛血清,购自Hyclone公司;DMEM培养基,购自Gibco公司;RNA抽提试剂盒,购自Axygen公司;MLV反转录酶,购自Takara公司;SYBR qPCR Master Mix,购自诺唯赞公司;CCK-8试剂盒,购自碧云天生物技术公司。
1.3 细胞预处理和病毒感染试验
采用含10%胎牛血清的DMEM培养液培养 DF-1 细胞接种至12孔细胞培养板,置37 ℃、5%CO2恒温培养箱中培养约24 h。待细胞密度长至90%时,吸弃培养液,用灭菌PBS洗涤3次,分别加入不同入侵途径阻断剂(甲基-β-环糊精(MβCD)、氯丙嗪(CPZ)、genistein、dynasore和EIPA),同时设不处理空白对照,作用1 h后,以MOI=0.01的剂量接种坦布苏病毒,37 ℃孵育1 h,吸弃接种液,每孔加入1.5 mL含2%胎牛血清的DMEM培养液,置37 ℃、5% CO2恒温培养箱中培养。感染 24 h 后收集细胞病毒液,进行病毒滴度和核酸检测。
1.4 细胞预处理和病毒吸附及内吞试验
按“1.3”节步骤准备12孔板DF-1单层细胞并用药物进行预处理,以MOI=5的剂量接种坦布苏病毒,4 ℃孵育1 h,或吸弃接种液,用预冷的灭菌PBS洗涤3次后直接收集细胞进行病毒核酸检测(吸附试验);或将接种细胞移置37 ℃培养箱中继续培养2 h后吸弃接种液,预冷灭菌PBS洗涤3次,用 1 mg/mL 蛋白酶K在4 ℃条件下作用45 min后收集细胞进行病毒核酸检测(内吞试验)。
1.5 病毒滴度测定
用噬斑计数法进行病毒滴度的测定。用预冷的DMEM基础液将收集样品进行10倍系列倍比稀释,接种至预先制备的12孔板单层BHK-21细胞,置 37 ℃、5% CO2培养箱中孵育1 h,吸弃孔内接种液,每孔加入1.5 mL含4% FBS的2%低熔點琼脂与 2×DMEM基础培养液等体积混合的上层琼脂培养基,4 ℃放置10 min,使低熔点琼脂冷却,置 37 ℃、5% CO2细胞培养箱培养72 h,每孔加入 0.5 mL 终浓度为0.02%中性红染液至上层琼脂,37 ℃放置12 h后观察结果,记录噬斑数,计算病毒滴度。
1.6 相对荧光定量PCR检测病毒核酸表达
按RNA抽提试剂盒说明书提取收集细胞样品RNA并利用MLV反转录酶合成cDNA。以获取的cDNA为模板,用SYBR Green染料法进行相对荧光定量PCR的扩增。坦布苏病毒扩增上下游引物分别为:5′-GTGAGATCTTACTGCTATGAG-3′和5′-ACTTGGCACATGTC TGTATGC-3′;细胞内参基因actin扩增上下游引物分别为:5′-TTGGAGGCTCTATCCTGG-3′和5′-TAGAAGCATTTGCGGTGG-3′。反应条件为:95 ℃预变性3 min;95 ℃ 变性10 s,60 ℃ 退火30 s,40个循环。用2-ΔΔCT法计算病毒基因的相对表达量。
1.7 细胞活性试验
用CCK-8法检测药物对细胞活性的影响。制备96孔板DF-1单层细胞,用不同浓度的药物 37 ℃ 处理2 h,每孔加入10 μL CCK-8溶液,设置加处理药物、CCK-8溶液和相应培养液但不加细胞的孔作为空白对照,孵育1 h后,测定450 nm处的吸光度。
2 结果与分析
2.1 坦布苏病毒入侵DF-1细胞依赖网格蛋白
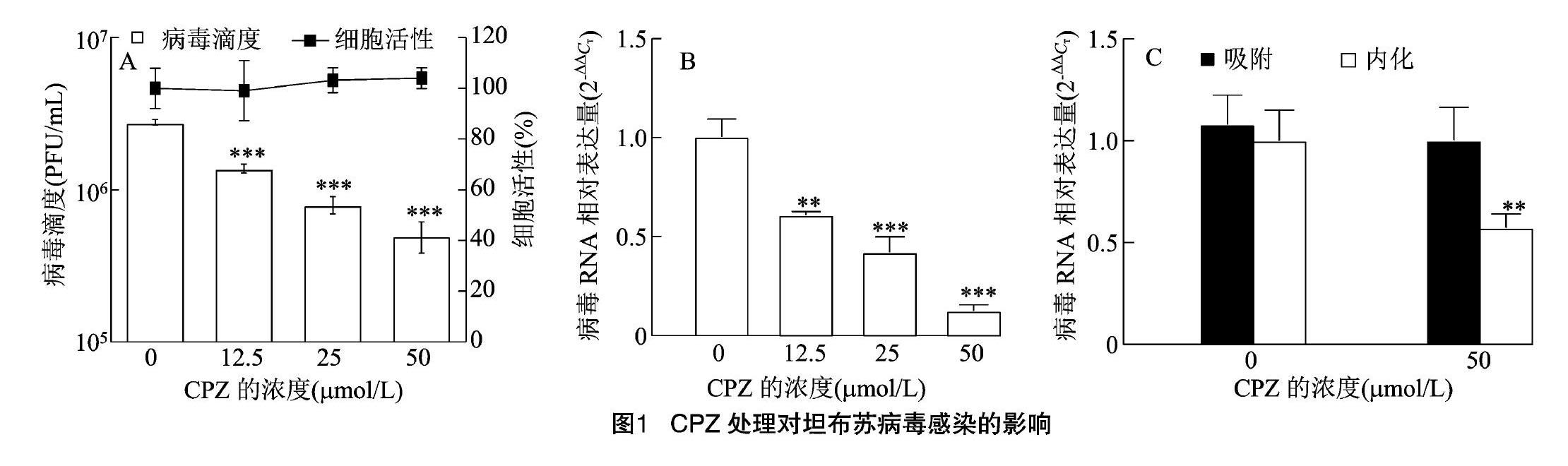
为观察网格蛋白对坦布苏病毒感染DF-1细胞的影响,本试验分别用不同浓度的网格蛋白抑制剂CPZ(0.0、12.5、25.0、50.0 μmol/L)预处理细胞后感染病毒,用噬斑计数法测定感染24 h后的病毒滴度,同时用qRT-PCR测定病毒核酸表达。由图1可知,与对照组相比,抑制剂CPZ处理细胞后可显著降低病毒滴度和病毒核酸相对表达量,并且呈剂量依赖性;吸附和内吞试验结果显示,CPZ可显著抑制病毒的内吞,对病毒的吸附无明显影响。提示坦布苏病毒通过网格蛋白依赖内吞途径入侵DF-1细胞。
2.2 坦布苏病毒入侵DF-1细胞不依赖于小窝蛋白
为观察小窝蛋白对坦布苏病毒感染DF-1细胞的影响, 本试验分别使用不同浓度的小窝蛋白抑制剂genistein(0、100、200、400 μmol/L)预处理细胞后感染病毒,用噬斑计数法测定感染24 h后的病毒滴度。由图2可知,与对照组相比,不同浓度genistein处理细胞后,病毒的滴度无显著差异,表明坦布苏病毒入侵DF-1细胞不依赖小窝蛋白。
2.3 坦布苏病毒入侵DF-1细胞不依赖于胆固醇
为观察细胞膜胆固醇对坦布苏病毒感染DF-1细胞的影响,本试验分别用不同浓度的胆固醇抽提剂MβCD(0.0、2.5、5.0、7.5、10.0 mmol/L)预处理细胞后感染病毒,用噬斑计数法测定感染24 h后的病毒滴度。由图3可知,与对照组相比,不同浓度MβCD处理细胞后,病毒的滴度无显著差异,表明坦布苏病毒入侵DF-1细胞不依赖于胆固醇。
2.4 坦布苏病毒入侵DF-1细胞依赖于动力蛋白
为观察动力蛋白对坦布苏病毒感染DF-1细胞的影响,本试验分别用不同浓度的动力蛋白抑制剂dynasore(0、20、50、100 μmol/L)预处理细胞后感染病毒,用噬斑计数法测定感染24 h后的病毒滴度,同时用qRT-PCR测定病毒核酸表达。由图4可知,与对照组相比,抑制剂dynasore处理细胞后可显著降低病毒滴度和病毒核酸相对表达量,并且呈剂量依赖性。吸附和内吞试验结果显示,dynasore可显著抑制病毒的内吞,对病毒的吸附无明显影响。以上试验结果表明,坦布苏病毒入侵DF-1细胞依赖于动力蛋白。
2.5 坦布苏病毒入侵DF-1细胞不依赖于胞吞途径
为观察坦布苏病毒入侵DF-1细胞是否依赖于胞吞途径,试验分别使用不同浓度的胞吞途径抑制剂EIPA(0、10、20、50 μmol/L)预处理细胞后感染病毒,用噬斑计数法测定感染24 h后的病毒滴度。由图5可知,与对照组相比,不同浓度EIPA处理细胞后,病毒的滴度无显著差异,表明坦布苏病毒入侵DF-1细胞不依赖于胞吞途径。
3 讨论与结论
入侵是病毒进入宿主细胞并建立有效感染的第一步。目前,研究表明,大多数动物病毒能够利用宿主细胞的多种内吞方式完成入侵过程。其中网格蛋白依赖的内吞是一种经典的内吞途径,也是许多病毒进入细胞的主要途径,如乙脑病毒入侵BHK-21细胞[13],猪瘟病毒入侵ST细胞[14],牛腹泻病毒入侵MDBK细胞[15]等。通常情况下,病毒与细胞受体结合后招募网格蛋白,使包膜内陷成包被小凹,随之形成骨架为网格蛋白的包被囊泡,病毒被包裹其中。在动力蛋白参与下,囊泡颈部膜断裂,囊泡脱离细胞膜,将病毒递送到内体中[8]。小窝依赖的内吞也是病毒入侵细胞的常见途径,比如乙脑病毒入侵神经细胞[11],埃博拉病毒入侵骨肉瘤细胞[16]等。细胞膜上的小窝由胆固醇、鞘脂及小窝蛋白组成,也是脂笩的一种形式。小窝依赖的内吞过程同样需要动力蛋白的参与,使内陷的小泡脱离胞膜[8]。此外,巨胞饮作为细胞的一种重要生理过程,一般由生长因子诱导引起细胞膜褶皱形成巨饮胞体,主要介导某些大分子物质的内吞,也可以帮助某些病毒完成入胞过程,比如牛痘病毒、单纯疱疹病毒1型等[8]。同时,病毒的入侵需要诸多宿主元件的参与,除上述动力蛋白外,还有肌动蛋白、酪氨酸激酶、胆固醇等等。文献报道,胆固醇在黄病毒的入侵过程中发挥重要作用,比如甲基-β-环糊精去除胞膜胆固醇可显著抑制西尼罗病毒和登革热病毒在一些哺乳动物细胞上的入侵效率[17]。本研究发现,分别用网格蛋白组装抑制剂氯丙嗪和动力蛋白抑制剂dynasore预处理DF-1细胞后,均能显著抑制坦布苏病毒的感染,且主要作用于病毒的内吞过程,而小窝蛋白抑制剂、胆固醇抽提剂和巨胞饮抑制剂处理细胞则对病毒的感染无明显影响,提示坦布苏病毒主要利用网格蛋白介导的内吞途径入侵DF-1细胞,并依赖于动力蛋白。
病毒入侵是一個复杂而多样化的过程,病毒可同时利用多种内吞途径进入宿主细胞,同一病毒可通过不同途径进入不同细胞,不同病毒在同一细胞上的入侵方式也各有差异。本试验初步研究了坦布苏病毒在DF-1细胞上的入侵途径,但对于病毒为何选择这种途径与如何利用这种途径的具体机制以及可能存在的其他入侵途径等需要进一步深入研究。
参考文献:
[1]曹贞贞,张 存,黄 瑜,等. 鸭出血性卵巢炎的初步研究[J]. 中国兽医杂志,2010,46(12):3-6.
[2]Su J,Li S,Hu X,et al. Duck egg-drop syndrome caused by BYD virus,a new Tembusu-related flavivirus[J]. PLoS One,2011,6(3):e18106.
[3]Cao Z Z,Zhang C,Liu Y E,et al. Tembusu virus in ducks,China[J]. Emerging Infectious Diseases,2011,17(10):1873-1875.
[4]Liu M,Chen S,Chen Y,et al. Adapted tembusu-like virus in chickens and geese in China[J]. Journal of Clinical Microbiology,2012,50(8):2807-2809.
[5]Chen S,Wang S,Li Z,et al. Isolation and characterization of a Chinese strain of Tembusu virus from Hy-Line Brown layers with acute egg-drop syndrome in Fujian,China[J]. Archives of Virology,2014,159(5):1099-1107.
[6]Yun T,Ye W,Ni Z,et al. Identification and molecular characterization of a novel flavivirus isolated from Pekin ducklings in China[J]. Veterinary Microbiology,2012,157(3/4):311-319.
[7]Tang Y,Diao Y,Yu C,et al. Characterization of a tembusu virus isolated from naturally infected house sparrows (passer domesticus) in northern China[J]. Transboundary and Emerging Diseases,2013,60(2):152-158.
[8]Mercer J,Schelhaas M,Helenius A. Virus entry by endocytosis[J]. Annual Review of Biochemistry,2010,79:803-833.
[9]Chuang C K,Yang T H,Chen T H,et al. Heat shock cognate protein 70 isoform D is required for clathrin-dependent endocytosis of Japanese encephalitis virus in C6/36 cells[J]. The Journal of General Virology,2015,96(4):793-803.
[10]Khasa R,Vaidya A,Vrati S,et al. Membrane trafficking RNA interference screen identifies a crucial role of the clathrin endocytic pathway and ARP2/3 complex for Japanese encephalitis virus infection in HeLa cells[J]. The Journal of General Virology,2019,100(2):176-186.
[11]Zhu Y Z,Xu Q Q,Wu D G,et al. Japanese encephalitis virus enters rat neuroblastoma cells via a pH-dependent,dynamin and caveola-mediated endocytosis pathway[J]. Journal of Virology,2012,86(24):13407-13422.
[12]Medigeshi G R,Hirsch A J,Streblow D N,et al. West Nile virus entry requires cholesterol-rich membrane microdomains and is Independent of alphavbeta3 integrin[J]. Journal of Virology,2008,82(11):5212-5219.
[13]Liu C C,Zhang Y N,Li Z Y,et al. Rab5 and Rab11 are required for clathrin-dependent endocytosis of Japanese encephalitis virus in BHK-21 cells[J]. Journal of Virology,2017,91(19):e01113-e01117.
[14]梁武龍,方 佳,林 鸷,等. 猪瘟病毒通过网格蛋白介导的内吞途径入侵ST细胞[J]. 畜牧兽医学报,2017,48(1):140-149.
[15]Lecot S,Belouzard S,Dubuisson J,et al. Bovine viral diarrhea virus entry is dependent on clathrin-mediated endocytosis[J]. Journal of Virology,2005,79(16):10826-10829.
[16]Marjom ki V,Pieti inen V,Matilainen H,et al. Internalization of echovirus 1 in caveolae[J]. Journal of Virology,2002,76(4):1856-1865.
[17]Osuna-Ramos J F,Reyes-Ruiz J M,Del R. The role of host cholesterol during flavivirus infection[J]. Frontiers in Cellular and Infection Microbiology,2018,8:388.

