杂交兰叶艺品系主要生理特性的比较
林榕燕 吴建设 林兵 叶秀仙 钟淮钦


摘要:为探明叶色变异对杂交兰叶片主要生理特性的影响,对杂交兰紫妍氏及其3个叶艺品系叶片的可溶性糖含量、丙二醛(MDA)含量、相对电导率、抗氧化酶活性及三磷酸腺苷酶(ATP)活性等进行比较分析。结果表明,相较于对照组(K21绿色叶片、K21-1和K21-2绿色区叶片),3个叶艺品系叶艺区叶片中ATP活性均有所下降,而超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性和相对电导率、丙二醛含量均有所提升。此外,相关性分析结果显示,相对电导率、SOD活性和CAT活性与叶绿素a、叶绿素b、总叶绿素含量存在显著或极显著负相关关系;而POD活性、MDA含量、ATP活性、可溶性糖含量与叶绿素a、叶绿素b和总叶绿素含量不存在显著相关关系。由此推测叶色变异对相对电导率和抗氧化酶活性影响较大,抗氧化酶活性的提高有利于清除代谢产生的有害物质,防止膜脂过氧化加剧,对维持植物的正常生理代谢具有积极的作用。本研究结果为进一步开展杂交兰叶艺形成机制研究奠定了基础。
关键词:杂交兰;丙二醛含量;相对电导率;抗氧化酶;相关性分析;叶艺性状
中图分类号: S682.310.1 文献标志码: A 文章编号:1002-1302(2021)13-0136-05
叶色突变是自然界中一种比较常见的突变性状,当叶绿素的合成与降解途径出现异常,或是叶绿体结构遭到破坏,都可能导致叶色突变体的产生[1]。截至目前,人们已经在拟南芥(Arabidopsis thaliana)[2]、玉米(Zea mays)[3]、水稻(Oryza sativa)[4] 和黄瓜(Cucumis sativus)[5]等多种作物中获得了叶色突变体。叶色突变体的应用范围较广,不仅可以作为研究光合作用、叶绿素代谢和叶绿体遗传发育等方面的特殊材料,还可以作为优良的种质资源[6-8]。现阶段,虽然已有叶色突变体生理特性方面的研究,但不同的突变体研究结果不尽相同[9-10]。而且相对于模式植物和大田作物,有关兰科植物叶色突变体的研究较少,突变机制仍不清晰。
笔者所在课题组于2008年在杂交兰品种紫妍氏组培快繁过程中获得1条黄化条纹根状茎,经变异根状茎增殖和筛选、试管苗筛选、叶艺性状稳定性观测等,选育出3个稳定的杂交兰叶色变异品系福韵西施、爪艺紫妍氏和中透紫妍氏[11]。新品系的选育为深入解析叶艺杂交兰叶色变异的机制提供了理想材料。笔者所在课题组前期已对杂交兰品种紫妍氏(K21)及其3个叶色变异品系(K21-1、K21-2、K21-3)的光合色素、显微结构、超微结构等进行比较分析,相较于对照(K21绿色叶片),3个叶艺品系叶艺区叶片中的叶绿素a、叶绿素b及类胡萝卜素含量均显著降低,叶绿体数量明显减少,且不具备正常叶绿体的结构特征,推测叶艺品系中叶绿体的结构和功能都已受到影响。但有关叶色变异对杂交兰叶片中可溶性物质、丙二醛(MDA)含量等生理特性的影响还未见相关报道。因此,本研究在前期研究的基础上,以K21、K21-1、K21-2、K21-3为材料,研究不同叶艺品系叶片中相对电导率、可溶性糖含量、MDA含量及超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)及三磷酸腺苷酶(ATP)活性的差异,为揭示杂交兰叶色变异的生理机制提供参考依据。
1 材料与方法
1.1 试验材料
以福建省农业科学院作物研究所花卉研究中心种质资源圃保存的长势基本一致且生长状况良好的杂交兰紫妍氏(K21,叶片绿色)、福韵西施(K21-1,叶片边缘具黄色条纹)、爪艺紫妍氏(K21-2,叶片边缘具银色条纹)和中透紫妍氏(K21-3,叶片中间具黄白色宽条纹,尖端绿色)4个栽培品系为试验材料。试验于2020年7月在福建省特色花卉工程技术研究中心花卉生理实验室进行。
用编号和字母表示各品系叶片取样测定部位,即紫妍氏绿色叶片为K21(G);福韵西施绿色区域叶片为K21-1(G),叶艺区域叶片为K21-1(Y);爪艺紫妍氏绿色区域叶片为K21-2(G),叶艺区域叶片为K21-2(Y);中透紫妍氏叶艺区域叶片为K21-3(Y)。
1.2 测定指标与方法
1.2.1 相对电导率测定 称取样品后,用去离子水洗净,吸干水分,剪成小段放入小烧杯中,加入去离子水20 mL,置于25 ℃条件下保存1 h,取出后采用电导仪测量电导率(E1);再放入100 ℃ 沸水浴中20 min,取出,冷却至室温后测量煮沸后的电导率(E2)。用相对电导率(REC)来反映细胞膜的透性,计算公式为REC=(E1/E2)×100%。
1.2.2 可溶性糖含量、MDA含量测定 可溶性糖含量的测定参照植物可溶性糖含量检测试剂盒说明书(Solarbio),采用蒽酮比色法,在620 nm处测定吸光度;MDA含量测定参照MDA含量检测试剂盒说明书(Solarbio),采用硫代巴比妥酸(TBA)法,利用532 nm与450、600 nm下的吸光度差值按公式计算MDA的含量。
1.2.3 SOD、POD、CAT及ATP活性測定 SOD、POD、CAT及ATP活性的测定均参照相应的酶活性检测试剂盒说明书进行,SOD活性的测定采用氮蓝四唑法;POD活性的测定采用愈创木酚法;CAT活性的测定采用可见光法;ATP活性通过测酶促反应过程中无机磷的释放量来测定。
1.3 数据分析
采用Execl 2007和SPSS 20.0软件对文中涉及的数据进行统计、显著性分析及相关性分析。
2 结果与分析
2.1 紫妍氏及其叶艺品系可溶性糖含量的差异
由图1可知,K21-1、K21-2叶艺区叶片的可溶性糖含量显著高于K21-1、K21-2绿叶区叶片,K21-1叶艺区叶片的可溶性糖含量是K21-1绿叶区叶片中的2.13倍,K21-2叶艺区叶片的可溶性糖含量是K21-2绿叶区叶片中的1.53倍。而 K21-3叶艺区叶片的可溶性糖含量则显著低于K21-1、K21-2、K21的供试叶片,K21-3叶艺区叶片的可溶性糖含量仅为K21绿色叶片中的45.03%。不同叶艺品系叶艺区叶片的可溶性糖含量高低顺序为K21-1>K21-2>K21-3。
2.2 紫妍氏及其叶艺品系叶片MDA含量的差异
由图2可知,K21-1、K21-2叶艺区叶片中的MDA含量均显著高于其相应的绿色区叶片,K21-1叶艺区叶片的MDA含量为K21-1绿叶区叶片中的1.46倍,K21-2叶艺区叶片的MDA含量为 K21-2绿叶区叶片中的1.63倍,K21-3叶艺区叶片中的MDA含量为K21绿色叶片中的1.67倍。不同叶艺品系叶艺区叶片的MDA含量排序为 K21-2>K21-1>K21-3。
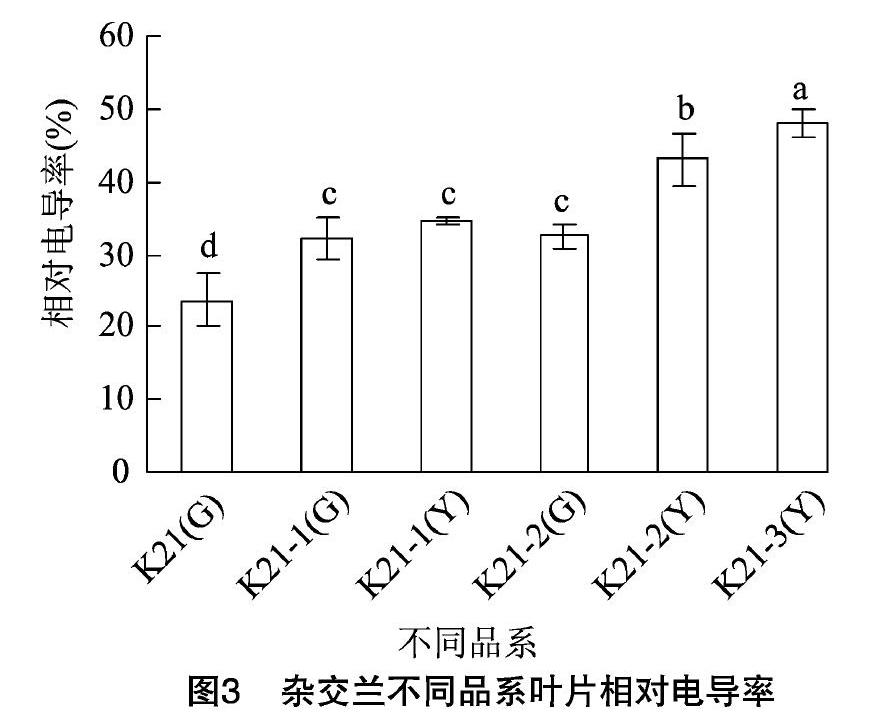
2.3 紫妍氏及其叶艺品系叶片相对电导率的差异
由图3可知,K21-2和K21-3叶艺区叶片的相对电导率均显著高于绿色区叶片,而K21-1叶艺区叶片的相对电导率与其相应的绿色区叶片间无显著性差异,但显著高于K21绿色叶片。其中K21-3叶艺区叶片的相对电导率是K21绿色叶片中的2.03倍。不同叶艺品系叶艺区叶片的相对电导率排序大小依次为K21-3>K21-2>K21-1。
2.4 紫妍氏及其叶艺品系叶片相关酶活性的差异
由图4可以看出,K21-1、K21-2和K21-3叶艺区中SOD、POD、CAT活性均高于供试的绿色区叶片,其中K21-3叶艺区叶片的SOD和CAT活性分别是K21绿色叶片中的1.88倍和1.64倍,K21-1叶艺区叶片的POD活性为K21-1绿叶区叶片中的2.55倍。K21-1和K21-2叶艺区叶片中ATP活性低于其相应的绿色区叶片,比例分别为62.29%和67.19%,K21-3叶艺区叶片中的ATP活性显著低于K21绿色叶片,仅为K21绿色叶片中的52.42%。
2.5 测定生理指标与叶绿素含量的相关性分析
将试验所测生理指标与前期测定的叶绿素含量进行相关性分析。由表1可知,相对电导率和SOD活性与叶绿素a、总叶绿素含量存在显著负相关关系,与叶绿素b含量存在极显著负相关关系(r=-0.928和r=-0.921);CAT活性与叶绿素a、叶绿素b和总叶绿素含量存在显著负相关关系;MDA含量、POD活性与叶绿素a、叶绿素b和总叶绿素含量存在负相关关系,但不显著;可溶性糖含量与叶绿素a、叶绿素b和总叶绿素含量相关性不大;ATP活性与叶绿素a、叶绿素b和总叶绿素含量存在正相关关系,但不显著。
3 讨论与结论
叶色突变体是研究植物光合作用、叶绿体发育、抗逆性机制及激素生理等的重要材料,同时也是创造优异种质资源的理想材料。张文慧等通过遗传分析与基因定位研究,发现了1个新的控制水稻葉色突变表型的基因[12]。刘忠祥等对玉米黄绿叶突变体进行遗传效应分析和基因初步定位,发现了控制该突变性状的隐性核基因[13]。相较于模式植物,目前有关兰花叶艺形成的研究报道还较少,许庆全等虽然通过比较光合色素含量、叶绿素荧光动力学参数、叶片结构,解析了墨兰、文心兰、春剑、建兰等叶艺形成的生理机制,但关于叶艺性状形成的机制仍然不清楚[14-18]。
笔者所在课题组前期选育出3个稳定的杂交兰叶色变异品系,同时通过研究推测这3个叶艺品系叶色变异的原因与叶绿素缺乏有关。在此基础上,本研究通过分析叶艺品系叶片中的一些主要生理特性与亲本的差异,并探讨了这些生理指标与叶绿素含量之间的相关性,发现叶色变异对叶片的MDA含量、ATP活性、抗氧化酶活性和相对电导率均有较大影响,其中相对电导率、SOD活性和CAT活性与叶绿素含量之间存在显著或极显著负相关关系。
植物体内的SOD、POD、CAT是重要的抗氧化酶,SOD通过催化超氧化物自由基发生歧化反应,从而清除超氧自由基;POD和CAT通过清除H2O2、羟自由基等过氧化物,维持体内活性氧代谢平衡[19-20]。因此,SOD、POD、CAT活性常被作为衡量植物抗逆性及抗氧化能力的指标。如蒲公英叶片中的SOD、POD和CAT活性在海水复合盐胁迫下增加[21];铝胁迫条件下,水稻根尖SOD、POD和CAT活性比对照组分别增加1.39、1.42和1.56倍[22];泡桐黄化突变体的SOD、POD和CAT活性均高于其他种[23]。本研究测定发现K21-1、K21-2和 K21-3叶片中的SOD、POD、CAT活性均高于相应的对照组,说明叶色变异可能导致叶片中产生大量的活性氧,从而激发叶艺品系叶片酶保护系统,通过提高抗氧化酶活性来调控活性氧平衡,以维持植物的正常生理代谢。
当植物受到逆境胁迫时,细胞内活性氧代谢平衡被破坏,活性氧的大量积累会引起膜脂过氧化,其产物MDA含量增加,细胞膜透性增加,电解质渗透加大,相对电导率升高[24-26]。因此MDA含量和相对电导率常被作为表征细胞膜受损程度及其透性的指标,反映对逆境反应的强弱。在紫花苜蓿碱胁迫[27]、春大豆叶片干旱胁迫[28]、泡桐黄化突变体[23]等研究中,均有MDA含量、相对电导率等指标的测定。本研究中3个叶艺品系叶片中MDA含量和相对电导率较对照组高,与中国兰叶色突变体叶艺隆昌素丙二醛含量及相对电导率较其亲本隆昌素升高的研究结果[29]一致,说明叶色变异导致叶艺品系叶片中细胞膜损伤程度增大,推测其可能是由于叶绿素缺乏引发的光胁迫导致电解质外渗,细胞膜透性增强。
综上,杂交兰3个叶艺品系的SOD、POD、CAT活性与MDA含量、相对电导率较对照组升高,且与叶绿素含量之间存在负相关关系,推测叶艺品系叶片中抗氧化酶活性的提高有利于清除代谢产生的活性氧和自由基,能防止膜脂过氧化加剧,减少但又不能完全消除叶色变异带来的生理代谢方面的不良影响,对维持植物的正常生理代谢具有积极的作用。叶色突变体作为一种特殊的研究材料,现已在基础研究和生产实践中被广泛利用,笔者所在课题组下一步将对该杂交兰叶艺品系进行基因精细定位及蛋白组转录组联合分析,旨在为杂交兰优良品系的定向选育提供理论基础。
参考文献:
[1]Jiang Y,Wang Q,Shen Q Q,et al. Transcriptome analysis reveals genes associated with leaf color mutants in Cymbidium longibracteatum[J]. Tree Genetics & Genomes,2020,16(3):44.
[2]戴 楠,袁光孝,刘小敏,等. 拟南芥黄化突变体k60的基因作图定位[J]. 北京林业大学学报,2017,39(7):40-45.
[3]王 飞,段世名,李 彤,等. 玉米叶色突变体遗传分析及基因定位[J]. 植物遗传资源学报,2018,19(6):1205-1209.
[4]Tan J,Zhang T,Xia S S,et al. Fine mapping of a novel yellow-green leaf 14 (ygl14) mutant in rice[J]. Euphytica,2019,215(5):100.
[5]Cao W,Du Y L,Wang C,et al. Cscs encoding chorismate synthase is a candidate gene for leaf variegation mutation in cucumber[J]. Breeding Science,2018,68(5):571-581.
[6]Li Y H,Wang B H,Dai Z Y,et al. Morphological structure and genetic mapping of new leaf-color mutant gene in rice (Oryza sativa)[J]. Rice Science,2012,19(2):79-85.
[7]Li Y,Zhang Z Y,Wang P,et al. Comprehensive transcriptome analysis discovers novel candidate genes related to leaf color in a Lagerstroemia indica yellow leaf mutant[J]. Genes & Genomics,2015,37(10):851-863.
[8]Zhong X M,Sun S F,Li F H,et al. Photosynthesis of a yellow-green mutant line in maize[J]. Photosynthetica,2015,53(4):499-505.
[9]任艺慈,朱迎春,孙德玺,等. 一个西瓜叶色黄化突变体的生理特性分析[J]. 果树学报,2020,37(4):565-573.
[10]胡亮亮,赵子瑶,张海强,等. 一个新的黄瓜叶色突变体的光合特性分析[J]. 西北农业学报,2018,27(11):1622-1628.
[11]林榕燕,吴建设,林 兵,等. 杂交兰尿卟啉原脱羧酶基因的克隆及其表达分析[J]. 核农学报,2020,34(9):1898-1905.
[12]张文慧,杨宜豪,陈铭蔚,等. 水稻-新黄绿叶突变体ygl10-2(t)的遗传分析与基因定位[J]. 扬州大学学报(农业与生命科学版),2019,40(1):1-7.
[13]刘忠祥,寇思荣,连晓荣,等. 玉米黄绿叶突变体表型鉴定及基因初步定位[J]. 植物遗传资源学报,2020,21(2):452-458.
[14]许庆全,杨凤玺,叶庆生,等. 墨兰‘达摩叶艺品系光合色素含量、叶绿素荧光特性和叶绿体超微结构的比较[J]. 热带作物学报,2017,38(7):1210-1215.
[15]王彩霞,田韦韦,田 敏,等. 文心兰黄化突变体的初步研究[J]. 核农学报,2013,27(12):1845-1852.
[16]謝泰祥,姚荣荣,陈 娟,等. 建兰叶艺品种光合色素含量及叶绿素荧光特性分析[J]. 亚热带植物科学,2019,48(3):232-236.
[17]熊剑锐,何俊蓉,蒋 彧,等. 中国兰春剑隆昌素叶色突变体光合特性的初步研究[J]. 辽宁农业科学,2015(2):23-27.
[18]蒋 彧,陶 炼,何俊蓉.兰属春剑叶艺突变体叶片结构的研究[J]. 植物科学学报,2018,36(1):112-118.
[19]李音音,于泽源,李兴国,等. 叶色黄化突变体甜瓜叶片叶绿素含量与抗氧化酶活性及膜脂过氧化程度的研究[J]. 中国果树,2013(6):23-26.
[20]郭美俊,白亚青,高 鹏,等. 二甲四氯胁迫对谷子幼苗叶片衰老特性和内源激素含量的影响[J]. 中国农业科学,2020,53(3):513-526.
[21]付 娆,张海洋,梁晓艳,等. 蒲公英对NaCl单盐和海水复合盐胁迫的生理响应[J]. 山东农业科学,2020,52(2):33-37.
[22]周小华,周泽仪,李昆志.铝胁迫下外源抗坏血酸对水稻幼苗抗氧化性能的影响[J]. 核农学报,2020,34(10):2368-2375.
[23]茹广欣,刘小囡,朱秀红,等. 泡桐黄化突变体生理特性分析[J]. 南京林业大学学报(自然科学版),2017,41(4):181-185.
[24]付丽军,李聪晓,苏胜宇,等. 黄瓜苗期耐热种质筛选与耐热性评价体系构建[J]. 植物生理学报,2020,56(7):1593-1604.
[25]易家宁,王康才,张琪绮,等. 干旱胁迫对紫苏生长及品质的影响[J]. 核农学报,2020,34(6):1320-1326.
[26]陈 天,刘云根,王 妍,等. 外源磷对砷胁迫下挺水植物抗氧化酶系统的影响[J]. 江苏农业学报,2019,35(5):1040-1046.
[27]韩 阳,邱漫莉,孟 靖,等. 碱胁迫对紫花苜蓿抗氧化酶的影响[J]. 辽宁大学学报(自然科学版),2020,47(3):193-199.
[28]王文佳,李 爽,马泽众,等. 水分胁迫对春大豆叶片保护酶活性及相对电导率的影响[J]. 中国农学通报,2019,35(11):14-18.
[29]蒋 彧,何俊蓉,熊剑锐,等. 中国兰叶色突变体生理生化分析[J]. 北方园艺,2015(7):65-68.

