汾酒发酵过程中的微生物菌群变化
蔚慧欣,秦丹,王燕*,张志旭
(1.山西杏花村汾酒厂股份有限公司技术中心,山西 汾阳 032205;2.湖南农业大学食品科学与生物技术湖南省重点实验室,湖南 长沙 410128;3.湖南农业大学食品科学技术学院,湖南 长沙 410128;4.湖南农业大学园艺学院,湖南 长沙 410128)
中国白酒酿造是一种古老的食品发酵技术,也是一种多菌种参与的固态发酵技术体系。汾酒以其独特的固态发酵酿造环境,造就了具有独特生理性能的微生物菌群,在白酒发酵中起着关键作用[1-2]。近年来,基于高通量测序结果研究表明,汾酒发酵过程主要包括2个阶段:阶段I(0~7 d),乳杆菌和毕赤酵母是丰度最高的微生物;阶段II(7 d~28 d),耐酸乳杆菌和酿酒酵母是丰度最高的微生物。其中耐酸乳杆菌的数量与白酒中乳酸乙酯的数量呈现正相关关系[3-4],芽孢杆菌在整个发酵过程占比维持稳定,参与风味物质的形成。因此,监测发酵过程中耐酸乳杆菌、芽孢杆菌和酵母菌的生物量可以为产品品质的人工调控提供更为准确的数据,为进一步利用特定微生物资源以及控制发酵代谢的深入研究做好基础铺垫。
白酒酿造过程中微生物群落组成复杂,随着发酵的进行微生物菌群组成会发生变化。采用可培养技术检测原位系统微生物菌群组成较为困难,无法准确分析微生物之间以及微生物与环境之间的相互关系[5]。高通量测序技术对微生物多样性及其动态的研究并不全面,无法对真菌和细菌同时进行准确定量。
实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,qPCR)是将普通PCR和光谱分析、实时检测等手段巧妙结合到一起的一项技术,具有特异性强、灵敏度高、重复性好、定量准确、自动化程度高等优点,已被成功用于复杂微生物群落中微生物的定量分析,如魏娜等[6]应用qPCR对浓香型白酒窖泥中优势菌群进行研究。已有学者采用微生物纯培养技术、变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCRDGGE)和高通量测序技术等对食醋发酵过程中微生物群落的结构进行了解析[7-9]。陈笔等[10]尝试用qPCR技术研究白酒发酵过程中塔宾曲霉(Aspergillus tubingensis)生物量变化。路虎等[11]利用该技术定量分析了产土味素的链霉菌。但是清香型白酒微生物的定量数据报道较少。
本研究采用qPCR技术对汾酒发酵过程酒醅中总细菌、总真菌、耐酸乳杆菌、芽孢杆菌和酵母菌生物量进行定量分析,为清香型白酒酿造机理解析、发酵工艺过程控制提供重要参数[12-14]。
1 材料和方法
1.1 样品采集
发酵过程酒醅样品取样于山西杏花村汾酒厂股份有限公司,采样时间点为大茬、二茬发酵0、7、15、28 d,选择同一车间4个班组作为平行样品,用无菌袋采样后迅速放置冰盒内,取样时间与样品处理时间间隔不大于20 min。
1.2 试剂与仪器
RNA 酶(10 mg/mL)、溶菌酶(50 mg/mL)、琼脂糖、细菌基因组DNA提取试剂盒(均为优级纯):天根生化科技有限公司;引物:生工生物工程(上海)股份有限公司;盐酸、乙二胺四乙酸、磷酸钠、溴化十六烷三甲基铵、氯化钠、三氯甲烷、异戊醇、异丙醇、无水乙醇(均为化学纯):国药集团股份有限公司;2×Taq MasterMix、Puc-T TA cloning kit、感受态细胞DH5α(均为优级纯):康为世纪生物科技有限公司;SYBR®Premix Ex TaqTMII(TliRNaseHPlus)ROXplus、DL2000DNAMarker(均为优级纯):宝生物工程(大连)有限公司。
ABI 7500实时定量PCR仪、核酸浓度测定仪BioSpectrometer®basic:赛默飞世尔科技公司;Power-PacBasic核酸电泳仪:美国BIO-RAD公司;Geldocit310凝胶成像系统:英国UVP公司;FMB40制冰机:日本SANYO公司;RC-6TMPlus离心机:Eppendorf公司。
1.3 酒醅总DNA的提取
酒醅总DNA提取采用月桂酸钠法。称取20 g酒醅,悬浮于180 mL磷酸盐缓冲溶液(phosphate buffer saline,PBS)中,漩涡振荡,静置1 min收集上清液。12 000 r/min,4℃离心1 min后收集细胞沉淀,液氮速冻并充分研磨。将研磨好的粉末转移到混合裂解液[9]中,涡旋振荡20 min,加入等体积的抽提液(酚∶氯仿∶异戊醇=25∶24∶1,体积比),摇匀。混合液在 12 000 r/min,4℃条件下离心10 min,吸取上清液,加入10 μL RNA酶,于37℃静置30 min,然后加入等体积的抽提液,抽提1次,再加入0.7倍体积异丙醇,置于-20℃,静置30 min;4℃,12 000 r/min离心20 min,收集沉淀。用70%乙醇洗涤沉淀2次,真空干燥。加入20μL的ddH2O溶解30min,-20℃保存备用。
采用核酸浓度测定仪确定DNA浓度,分析A260/A280评价DNA纯度,采用琼脂糖凝胶电泳检查DNA纯度及浓度。
1.4 qPCR特异性引物设计
针对酒醅中总细菌、总真菌、耐酸乳杆菌、芽孢杆菌和酵母菌分别设计特异性引物用于qPCR扩增,引物名称及序列见表1[15-17]。

表1 特异性引物的名称及序列Table 1 The information of specific primer
1.5 酒醅微生物的qPCR定量分析
采用绝对定量法跟踪白酒发酵过程中微生物的生物量,其中标准品为重组质粒,根据重组质粒的拷贝数与扩增循环数之间的线性关系构建标准曲线[18]。为了使从不同样品获得的结果具有更好的可比性,质量浓度转换成为模板拷贝数浓度的公式,公式如下。
CN=M×N/L×D
式中:M为质量浓度,g/mL;N为阿佛加德罗常数,6.02×1023;L为核酸分子长度(总长度为靶片段加载体之和),kb;D 为转换因子(dsDNA),6.6×105g/mol·kb。
qPCR反应体系如下:2×UltraSYBRMixture10μL,引物各 0.5 μL,模板 2 μL,加 ddH2O 至 20 μL。将质粒标准品进行10倍梯度稀释,每个梯度取2 μL为模板建立标准曲线。扩增程序为变性阶段95℃30 s;循环阶段95℃5 s、60℃40 s,40个循环。qPCR扩增结束后通过熔解曲线分析,验证扩增的特异性。
以白酒酒醅样品DNA为模板进行qPCR特异性扩增,并根据标准曲线计算酒醅中各类微生物的拷贝数。每份样本先稀释10倍,然后取稀释液DNA 2 μL作为反应量,每个样本进行3次重复检测。
1.6 标准曲线及熔解曲线
标准品检测结果和标准曲线回归方程如表2所示。
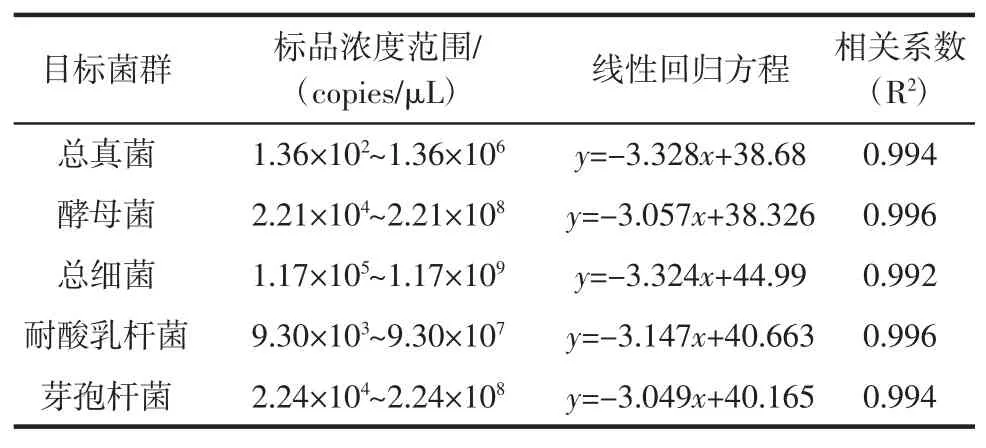
表2 标准品信息和标准曲线Table 2 Standard reference materials and standard curve
结果表明标准曲线可以用于荧光定量分析(R2>0.99)。
2 结果与分析
2.1 酒醅样品总DNA的提取
分析采用月桂酸钠法提取样品总DNA,琼脂糖凝胶电泳验证结果如图1所示。

图1 部分样品DNA电泳图Fig.1 The electrophoretogram of parts of sample DNA
由图1可知,本研究所提取的基因组较为完整。核酸浓度检测的A260/A280比值均在1.8至1.9左右,质量较好。
2.2 大茬、二茬发酵过程中微生物生物量的动态变化
大茬、二茬酒醅发酵过程中各类微生物实时扩增曲线如图2~图6所示,生物量的变化如图7所示。
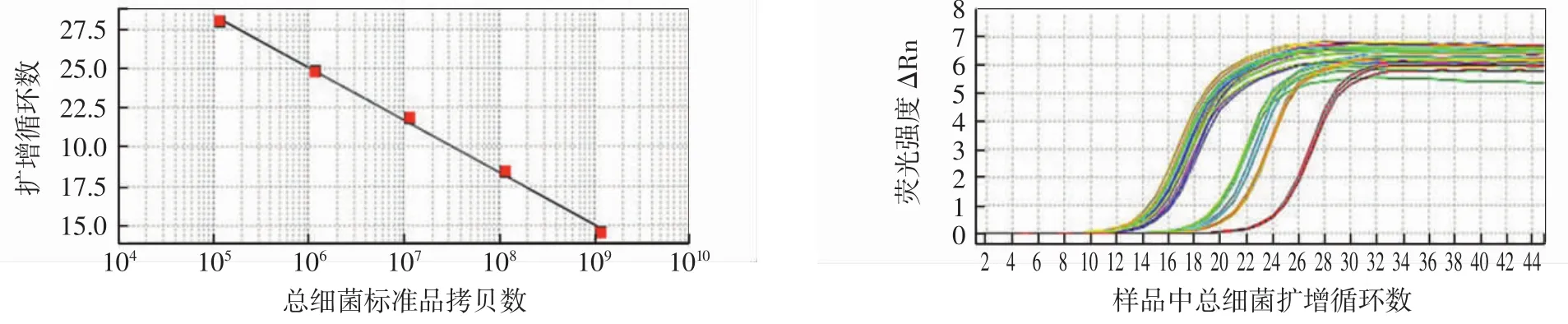
图2 总细菌标准曲线及样品中总细菌实时扩增曲线Fig.2 Standard curve and melting curve of total bacteria

图3 耐酸乳杆菌标准曲线及样品中耐酸乳杆菌实时扩增曲线Fig.3 Standard curve and melting curve of L.acetotolerans

图4 芽孢杆菌标准曲线及样品中芽孢杆菌实时扩增曲线Fig.4 Standard curve and melting curve of Bacillus

图5 总真菌标准曲线及样品中总真菌实时扩增曲线Fig.5 Standard curve and melting curve of total fungi

图6 酵母菌标准曲线及样品中酵母菌的实时扩增曲线Fig.6 Standard curve and melting curve of yeast

图7 酒醅发酵过程中各微生物动态变化曲线Fig.7 Dynamic curve of the microorganism during the fermentation process
汾酒大茬、二茬发酵过程中功能微生物前期(0~7 d)演替规律相似,二茬发酵中后期菌群呈现显著衰亡趋势。大茬总细菌的生物量呈上升趋势,耐酸乳杆菌和芽孢杆菌的生物量呈先上升后下降趋势,分别于第 28、15、7 天达到最大值(5.53×1016、1.40×1013、1.21×106copies/g酒醅DNA)。二茬总细菌、耐酸乳杆菌和芽孢杆菌的生物量整体呈先上升后下降趋势,分别于第15、15、7 天达到最大值(1.33×1016、6.77×1012、1.21×106copies/g酒醅DNA)。大茬总真菌在发酵过程中呈递增趋势,酵母菌在0~7 d增长,7 d~15 d下降,随后增长至大茬发酵结束。大茬总真菌和酵母菌的生物量在发酵0~7 d差异不大,呈快速增长趋势,且均在发酵结束达到最高(1.07×1015、1.56×1014copies/g酒醅DNA)。二茬总真菌和酵母菌在发酵过程中呈先增后减趋势。二茬中总真菌和酵母菌的生物量均在第7天达到最大值(1.51×1015、1.43×1014copies/g酒醅 DNA),第 7 天至发酵结束,总真菌和酵母菌的生物量逐渐降低。
在清香型白酒发酵过程中,酵母菌和乳酸菌是丰度最高的两类微生物,与发酵过程产醇、产酸密切相关。由图7可知,在整个发酵过程中总细菌生物量高于总真菌,耐酸乳杆菌的生物量高于酵母菌,采用qPCR方法辅助分析酒醅中优势菌能够较全面地反映各发酵阶段微生物群落结构。随着发酵的进行,地缸内逐渐形成厌氧、高浓度的有机酸和乙醇等特殊环境[19-20],大部分微生物由于不能适应而衰亡,然而乳酸菌和酿酒酵母菌属于兼性厌氧菌,且能够耐受较低的pH值,这些特性可能导致其逐渐成为发酵酒醅中主要微生物。但在二茬发酵后期,可能由于营养物质的逐渐消耗,各菌种的生长均受到限制,出现下降趋势。
3 讨论与结论
近些年qPCR方法虽然在医药、食品等研究中得到了广泛的应用,但用于检测白酒酿造过程中的微生物生物量还少见报道。本文针对汾酒发酵过程中功能菌群建立了一套qPCR方法,从基因组提取、设计引物、引物专一性验证、标准曲线的建立、方法准确性的验证,再到生产实践的具体应用。本研究证实了耐酸乳杆菌和酵母菌为酒醅中的主体微生物,二者分别占总细菌和总真菌总和的80%以上。与泸香型酒、芝麻香型等其他固态发酵体系相比,汾酒相应微生物菌群生物量除芽孢杆菌外数量级均高于前人研究。生物量是表征生物活性的一个重要指标,而白酒酿造微生物主要来源于大曲,推测该结果与汾酒大曲中低温培制工艺相关。
传统白酒固态发酵中,微生物菌群的结构与占比受环境因子以及微生物之间相互作用的影响。荧光定量PCR方法可与预测微生物学相结合,构建具有较强应用价值的数学模型,用于解析环境因素对微生物组成和生理特性的影响,微生物之间的相互作用关系,有助于实现发酵过程的人工调控。吴衍廉[13]在研究浓香型酒老窖时应用实时荧光定量PCR技术和预测微生物学建立了关于甲烷细菌与己酸菌的数学模型,开发了甲烷细菌与己酸菌共窖的二元发酵技术,探究两种菌在二元发酵中的数量变化规律及环境对其发酵的影响,优化了发酵工艺,降低了发酵成本。同时,该定量方法可以为研究酿酒微生物的生态模型提供基础数据,为白酒走出地域化提供可能。本研究构建了特定类群的快速定量方法,有助于建立针对不同生产周期新产酒质量的科学、全面的统一标准体系。

