成团泛菌CQ10脂多糖对紫花苜蓿种子萌发及苗期生长的影响
黄 荣, 姚 博, 张玉娟, 贾倩英, 李向阳, 张 宏, 张振粉*
(1.甘肃农业大学草业学院,甘肃 兰州 730070;2.草业生态系统教育部重点实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
紫花苜蓿(MedicagosativaL.)为豆科苜蓿属多年生牧草,茎叶中含有丰富的蛋白质、矿物质和维生素,因其营养丰富、适应性强、产草量高等优点,有“牧草之王”的美誉[1-3]。它不仅可以作为饲料作物,而且在改土肥田、保持水土和改善生态环境等方面也发挥着重要作用[4]。此外,紫花苜蓿是中国乃至世界上种植面积最大、种植范围最广的豆科牧草[5]。然而由于紫花苜蓿多种植在没有灌溉条件的贫瘠地与低产田上[6],其生产潜力受限无法充分发挥其价值,严重影响了苜蓿的经济利益和产业的发展[7]。因此,如何提高苜蓿在外界环境条件不适宜时的产量和质量成为苜蓿产业化发展领域的研究重点。
脂多糖(Lipopolysaccharide,LPS)是革兰氏阴性细菌细胞壁(Gram negative bacteria,GNB)的主要组成成分[8],也是一种重要的微生物相关分子模式(Microbe-associated molecular patterns,MAMPs),它可以引起植物叶绿体损伤和活性氧(Reactive oxygen species,ROS)迸发等反应[9],在植物生长发育调控过程中起到重要作用。研究表明从铜绿假单胞菌(Pseudomnasaeruginosa)中纯化的10~50 mg·mL-1商用LPS可引发植物先天免疫反应[10]和触发拟南芥ROS的双相产生[11]。前人对脂多糖的研究都集中在其对植物的致病能力的测定。种子、植物中分布着大量脂多糖,却并未引发大规模的植物病害,因此推测脂多糖在低浓度时无致病功能。冷静等[12]研究表明成团泛菌的脂多糖(Pantoeaagglomeranslipopolysaccharide,LPSp)是一种低毒性、安全性良好和纯度活性高的免疫增强剂,可以有效调节作物的生长发育进程[13]。因此,探索不同浓度的脂多糖对植物生长发育调节的作用具有重要意义。
为此,本试验以紫花苜蓿‘巨能551’品种为供试材料,测定了不同浓度成团泛菌CQ10菌株脂多糖(CQ10-LPSp)对紫花苜蓿种子萌发及苗期生长的影响,以期为开发具有促生性的外源添加脂多糖制剂提供理论指导。
1 材料和方法
1.1 供试菌株及紫花苜蓿品种
供试菌株成团泛菌(Pantoeaagglomerans)CQ10分离自紫花苜蓿种子,由甘肃农业大学草业学院牧草病理实验室提供。
供试紫花苜蓿品种:紫花苜蓿‘巨能551’(Medicagosativa‘Juneng 551’),由甘肃农业大学牧草种质资源实验室提供,种样在4℃恒温条件下保存。
1.2 供试培养基
营养琼脂培养基(Nutrient agar,NA)[14],主要用于成团泛菌CQ10菌株的纯化培养。
1.3 CQ10-LPSp的提取
CQ10菌株在NA培养基上生长48 h后,使用贝博生物科技有限公司BBproExtra脂多糖提取试剂盒,提取CQ10-LPSp,具体方法参照说明书。
1.4 CQ10-LPSp的活性检测
定量法鲎试剂测定CQ10-LPSp活性。具体参照GenScript的ToxinSensorTMEndotoxin Detection System试剂盒使用说明书操作方法。
根据说明书操作方法得出标准曲线,结果见图1。将3次测定样品的平均值带入标准曲线求得CQ10-LPSp活性为0.267 EU·mL-1。

图1 LPS含量测定标准曲线
1.5 种子发芽试验
1.5.1前期准备 (1)参照《牧草种子检验规程GB/T 2930.4-2001》[15]挑选籽粒饱满、无病虫害的的干净种子400粒,平均分为2组,各200粒。
(2)向玻璃发芽瓶中加入200 mL蒸馏水和不同浓度的(0,0.267,0.534和0.801 EU·mL-1)CQ10-LPSp,并记为CK(对照组),A,B和C处理,高温高压灭菌锅(121℃,0.11 Mpa)灭菌21 min后待用。
1.5.2发芽试验 种子分消毒组(消除种子表面微生物干扰)和未消毒组。其中消毒组采用质量浓度为75%的酒精浸泡1 min,质量浓度为3% NaClO浸泡5 min,无菌水冲洗3~4次;未消毒组不作任何处理。
将处理好的种子等距置于上述灭好菌的发芽瓶的发芽床上,每瓶25粒,n=4。接入种子后将发芽瓶放置于温度23℃、湿度45%、光照(18 Klux)18 h、黑暗6 h的生长室进行培养,期间需观察对照组和处理组种子生长状态。于种子发芽第7 d测定发芽势,第10 d测定发芽率和发芽指数,第30 d观察紫花苜蓿幼苗根系结瘤情况并取样测定幼苗根长、苗长、鲜重、干重和根系形态指标,并持续观察剩余样品的生长情况。
1.5.3指标测定 种子萌发的标准为胚根突破种皮,长出0.3 cm左右长的白色种根。
种子发芽率(Germination rate,GR)(%)=(第10 d发芽的种子数/25)×100%;发芽势(Germination potential,GP)(%)=(第7 d发芽的种子数/25)×100%;发芽指数(Germination index,GI)=∑Gt/Dt(Gt:第t d天的发芽数;Dt:相应的发芽日数)。
苗长(Seedling length,SL)和根长(Root length,RL)的测定:随机从各处理中选取10株紫花苜蓿幼苗,测量幼苗从根基部到植株最高部位的绝对长度为苗长;测量根基部到根尖的长度为根长。
鲜重(Fresh weight,FW)和干重(Dry weight,DW)的测定:随机从各处理中选取10株紫花苜蓿幼苗,滤纸吸干表面水分后称其鲜重,测完鲜重后将幼苗放置烘箱,75℃烘48 h至恒重后称重即为干重。
根系形态指标是将紫花苜蓿幼苗根系从发芽瓶取出,蒸馏水中冲洗干净,整理后用根系扫描系统扫描,输出的图片使用Win-RHIZO根系分析系统软件(Regent Instruments Canada Inc)进行分析,分别得出总根表面积(Surface area,SA,单个测量植株的所有根的面积,cm2)、总根体积(Root volume,RV,单个测量植株的所有根总体积,cm3)、平均根直径(Average diameter,AD,单个测量植株的所有根的平均直径,cm)。
1.6 数据分析
用Microsoft Excel 2010软件进行数据整理并作图,数值用平均值表示;运用SPSS 23.0统计软件对数据进项Duncan法比较种子处理和CQ10-LPSp浓度及二者交互作用对种子发芽及幼苗生长的影响;采用t检验效应分析CQ10-LPSp处理下不同种子处理对种子发芽及幼苗生长的影响。
2 结果与分析
2.1 不同浓度CQ10-LPSp对紫花苜蓿种子萌发的影响
由图2可知,随着CQ10-LPSp浓度升高,消毒组和未消毒组紫花苜蓿种子的发芽均受到了抑制。A,B处理下消毒组种子发芽率比对照组分别降低4.00%,9.00%,C处理时种子发芽率为0;A,B,C处理下未消毒组种子发芽率分别降低4.00%,3.00%,10.00%。随着CQ10-LPSp浓度升高,未消毒组种子发芽率差异不显著,而消毒组发芽率在C处理时显著降低,表明种子表面微生物使种子对脂多糖处理的响应有显著性差异。
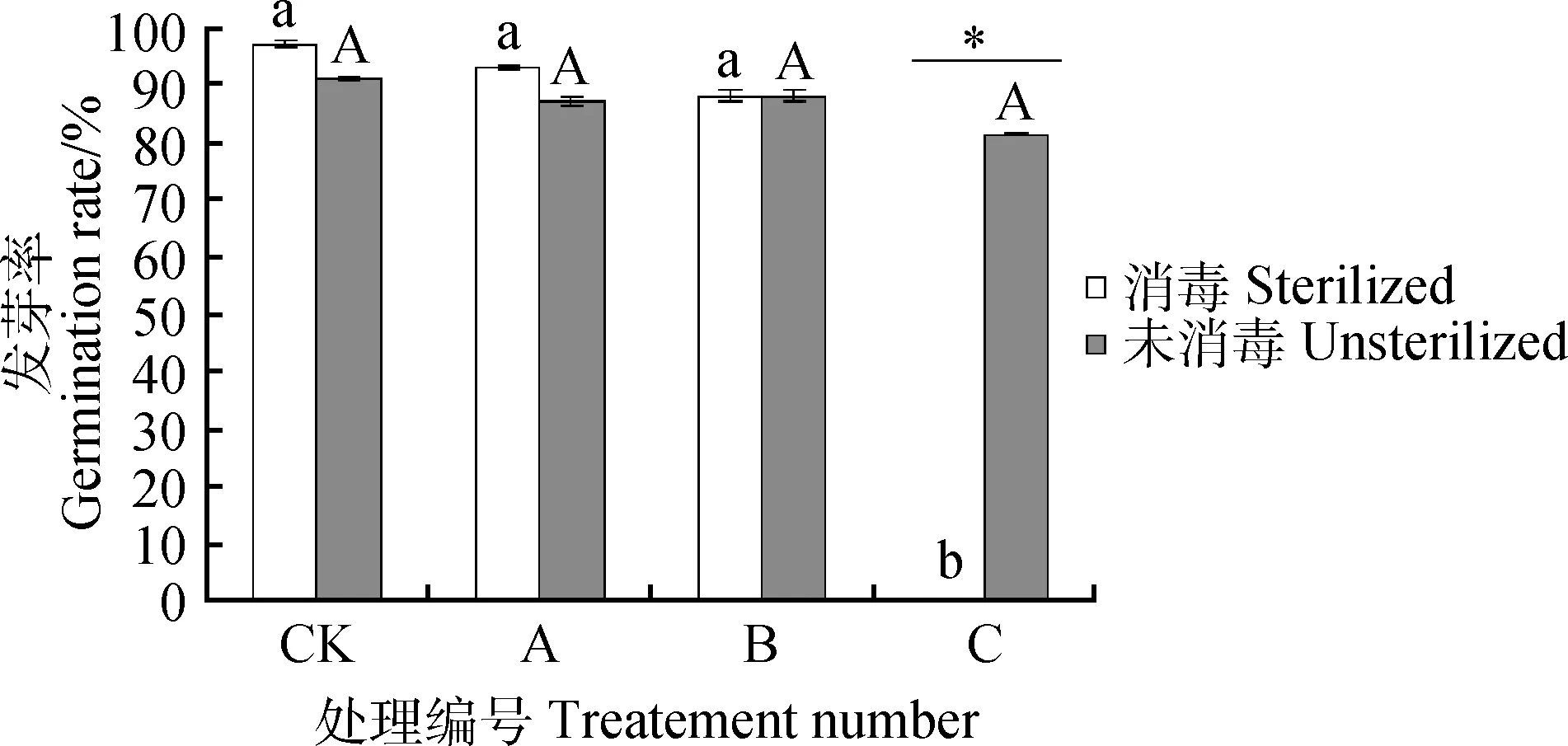
图2 紫花苜蓿在4个不同脂多糖浓度处理下的发芽率
由图3可知,随着CQ10-LPSp浓度升高,消毒组和未消毒组种子发芽势和发芽指数均降低。A处理下,消毒组发芽势和发芽指数分别比CK降低了4.00%,4.40,比B处理和C处理分别高1.00%和5.88,93.0%和8.16;未消毒组发芽势和发芽指数分别比CK降低了5.00%,9.23,比C处理升高了4.67%,8.16;消毒组发芽势、发芽指数分别比未消毒组高7.00%,9.81。B处理下,消毒组发芽势和发芽指数分别比CK降低了5.00%,14.21,比C处理高92.00%,32.85;未消毒组发芽势和发芽指数分别比CK降低了9.67%,9.95;消毒组发芽势和发芽指数比未消毒组分别高4.00%,2.69。C处理下,消毒组的发芽势和发芽指数均是0,与其他处理存在显著性差异(P<0.05);未消毒组的发芽势和发芽指数分别比CK降低了9.67%,9.95;未消毒组发芽势和发芽指数显著高于消毒组(P<0.05)。

图3 紫花苜蓿在4个不同脂多糖浓度处理下的发芽势和发芽指数
2.2 不同浓度CQ10-LPSp对紫花苜蓿幼苗根系生长的影响
如图4所示,随着CQ10-LPSp浓度的升高,消毒组和未消毒组的平均根直径呈上升趋势;总根表面积呈下降趋势。A处理下,消毒组紫花苜蓿幼苗的根长、苗长和平均根直径分别较CK增加了2.20,2.00,0.01 cm;未消毒组分别较CK增加了0.31,1.12,0.03 cm;消毒组较未消毒组根长和苗长分别增加了4.34,3.71,平均根直径减小了0.04 cm。B处理下,紫花苜蓿幼苗根系表现为短粗状,消毒组平均根直径和总根体积分别较CK和A处理增加了0.27 cm,0.50 cm3,根长、苗长和总根表面积显著低于CK和A处理(P<0.05);未消毒组平均根直径和总根体积分别较CK和A处理增加了0.02 cm,0.46 cm3,根长、苗长和总根表面积显著低于CK和A处理(P<0.05)。C处理下,消毒组种子未萌发,未消毒组种子虽有萌发,但后期逐渐枯萎腐烂,因此未测得幼苗的苗长和根长等指标(生长状况见图6-C和图6-G)。结果表明0.267 EU·mL-1CQ10-LPSp会促进消毒组和未消毒组紫花苜蓿幼苗的根长和苗长,对根直径和总根体积没有影响;0.534 EU·mL-1CQ10-LPSp会增加紫花苜蓿的根直径,降低其根长和苗长。

图4 紫花苜蓿在4个不同脂多糖浓度处理处理下的平均根直径、总根体积、总根表面积、根长和苗长
2.3 不同浓度CQ10-LPSp对紫花苜蓿幼苗鲜重和干重的影响
如图5所示,CQ10-LPSp在高浓度时对紫花苜蓿的生长有抑制作用,但在低浓度(A处理)时,对未消毒组生长有促进作用。A处理下,未消毒组鲜重和干重显著高于CK,B和C(P<0.05);未消毒组鲜重和干重高于消毒组。B处理下,未消毒组鲜重和干重均高于消毒组,且消毒组和未消毒组鲜重存在显著性差异(P<0.05)。

图5 紫花苜蓿在4个不同脂多糖浓度处理下的鲜重、干重
2.4 不同浓度CQ10-LPSp对紫花苜蓿结瘤的影响
结果如图6所示,添加不同浓度CQ10-LPSp对紫花苜蓿幼苗结瘤的影响差异较大,其中仅A处理未消毒组幼苗根部结瘤。且结瘤时间大约为处理后第22~24 d,比对照提前约16~18 d。随着生长期的延长,所结根瘤逐渐增多并变大(图6-J),但植株叶片伴有白化现象。

图6 4个不同CQ10-LPSp浓度处理下紫花苜蓿幼苗结瘤情况
3 讨论
3.1 CQ10-LPSp对紫花苜蓿生长的影响
糖类作为微生物、动植物及人体细胞表面的重要组成部分,在生命体的生长、发育和代谢等过程中发挥着极其重要的作用,可以调节植物的营养传输、下胚轴伸长、子叶绿化和芽的发育[16]。细菌细胞存在许多结构特异的荚膜多糖(Capsular polysaccharide,CPS)、胞外多糖(Exopolysaccharide,EPS)和脂多糖,在适应环境和与寄主互作中起着重要的作用。这些糖类结构复杂多样且高度保守,可作为一种有效的抗原类化合物[17]。张文平等[18]研究发现乳酸菌胞外多糖(20~2 000 mg·L-1)对水稻种子根的生长有促进作用;向达兵等[19]研究了内生真菌(Bionectriapityodes)多糖浸种对苦荞种子萌发的影响,结果表明当所用内生真菌多糖浓度为100 mg·kg-1时,对苦荞株高有明显的提高效果,但当多糖浓度继续升高时,其提高效果显著下降,而当浓度上升到800 mg·kg-1时,真菌多糖浸种处理有明显的抑制效果。本试验首次证实,成团泛菌脂多糖会影响紫花苜蓿种子的萌发和苗期的生长。结果表明,随着CQ10-LPSp浓度的升高,消毒组和未消毒组紫花苜蓿种子的发芽会受到抑制,其中发芽指标包括发芽指数、发芽势和发芽率,当CQ10-LPSp浓度为0.267 EU·mL-1时,消毒组和未消毒组的种子发芽指数、发芽势和发芽率和对照无显著差异,且紫花苜蓿幼苗的根长、苗长和平均根直径高于对照,未消毒组幼苗鲜重、干重和平均根直径高于对照。当CQ10-LPSp浓度为0.801 EU·mL-1时,会完全抑制消毒组种子的萌发和生长,这与前人的研究结果一致[18-19]。王娜等[20]认为植物内生菌提取物对植物的生长发育有明显的调控效应,并认为外用植物内生菌提取物必然会影响植株体内某些激素的含量以及激素间的平衡。综上,0.267 EU·mL-1CQ10-LPSp虽抑制了紫花苜蓿种子的发芽,但与对照无显著差异,未消毒组单株紫花苜蓿根长、苗长、平均根直径、鲜重和干重均高于对照,所以0.267 EU·mL-1CQ10-LPSp总体上提高了紫花苜蓿的总产量。因此,推测LPS作为一种外源物质,具有阈值效应,对植物具有双重作用,低浓度时会促进紫花苜蓿的生长和结瘤,高浓度时可能会导致植株体内的激素水平不平衡和活性氧过量产生而出现抑制现象[11,21-22]。基于此,0.267 EU·mL-1CQ10-LPSp具备作为一种植物生长调节物质的潜力。
3.2 CQ10-LPSp对紫花苜蓿结瘤的影响
紫花苜蓿可以和根瘤菌共生固氮,其共生固氮体系是自然界中固氮效率较高的体系之一[23],对改良土壤结构、增加土壤肥力和氮肥的施用量、养畜、保持水土及美化环境都有良好的改善作用,对于保护环境和农业的可持续发展也具有巨大的经济效益和生态效益。一氧化氮(Nitric oxide,NO)作为一种自由基反应性气体信号分子,在豆科植物根瘤菌共生体系的功能结瘤、共生固氮和响应非生物胁迫等方面发挥着重要的功能[24-26]。最近的研究表明,LPS可作为一种重要的生物类激发子可以诱导原生质体产生大量的NO[27-28]。在根瘤菌与植物共生过程中,LPS在根瘤菌对根毛的吸附、根瘤及侵染结构的形成保护细胞免受植物防卫反应的作用等方面都有重要的作用[29]。本试验结果发现,不同浓度CQ10-LPSp对紫花苜蓿根的结瘤影响差异较大,仅0.267 EU·mL-1CQ10-LPSp的未消毒组紫花苜蓿幼苗根会结瘤,其他试验组均无结瘤现象,推测出现该现象可能有两个原因:一是CQ10-LPSp诱导紫花苜蓿原生质体产生了NO,NO促使紫花苜蓿结瘤[27-28],且NO的含量是控制结瘤的重要因素之一;二是种子表面消毒杀死了紫花苜蓿种子表面的一些腐生菌,其中包括根瘤菌,该方法破坏了紫花苜蓿种子表面微生物的微生态环境,使得紫花苜蓿幼苗分泌的黄酮类化合物无法作用于根瘤菌的结瘤基因从而表达信号分子-结瘤因子[30],这一假设需要更进一步的研究来证实。
4 结论
本试验研究了CQ10-LPSp对紫花苜蓿种子萌发及苗期生长的影响,结果表明随着CQ10-LPSp浓度的升高,消毒组和未消毒组紫花苜蓿种子萌发受到不同程度地抑制。其中在0.267 EU·mL-1CQ10-LPSp处理下,种子发芽虽受到抑制,但与对照无显著差异,未消毒组单株紫花苜蓿根长、苗长、平均根直径、鲜重和干重均高于对照,且根瘤形成时间比对照组提前约16~18 d,根瘤数量也大于对照组。所以0.267 EU·mL-1CQ10-LPSp处理可促进未消毒组紫花苜蓿的生长和结瘤,总体上提高了紫花苜蓿的总产量。

