木聚糖酶检测底物筛选及玉米芯低聚木糖的制备
刘代云 李萌 田盼

摘 要:为解决木聚糖酶国标底物短缺,并筛选可用于酶法制备低聚木糖的木聚糖酶,首先以甘蔗渣和榉木来源的木聚糖替代GB/T 23874-2009《饲料添加剂木聚糖酶活力的测定》中规定的底物检测木聚糖酶活力,同时采用木霉和毕赤酵母木聚糖酶酶解不同木聚糖底物和玉米芯木聚糖,应用高效液相色谱法对酶解产物组分进行分析,并初步优化玉米芯木聚糖酶解条件。结果表明:与GB/T 23874-2009《饲料添加剂木聚糖酶活力的测定》中规定的底物检测结果相比,榉木木聚糖(Megazyme)检测结果与原底物检测结果基本一致;而甘蔗渣木聚糖检测结果偏高,但稳定性良好,两者均可替代原底物進行木聚糖酶活力检测。通过高效液相色谱法分析,毕赤酵母木聚糖酶水解不同底物的木二糖含量较木霉木聚糖酶的高,而木糖含量则相反。利用3种木聚糖酶同步水解玉米芯粉木聚糖,毕赤酵母木聚糖酶水解玉米芯粉木聚糖的产物中90%以上为低聚木糖,其中木二糖占72.54%,木三糖占17.86%,接近木聚糖酶Shearzyme 500L水解产物中的低聚木糖比例,高于木霉木聚糖酶,具有制备低聚木糖的应用潜力。毕赤酵母木聚糖酶水解玉米芯木聚糖的最优条件为反应温度60℃、pH 4.8,玉米芯底物浓度0.10 g·mL-1,酶解时间24 h,在此最优条件下玉米芯木聚糖的水解率可达76%。
关键词:木聚糖底物;木聚糖酶;低聚木糖;水解率
中图分类号:TQ 925 文献标志码:A 文章编号:0253-2301(2021)07-0074-08
DOI: 10.13651/j.cnki.fjnykj.2021.07.014
Screening of the Substrates for Xylanase Detection and thePreparation of Corncob Xylooligosaccharide
LIU Daiyun, LI Meng, TIAN Pan
(Yichang Dongyangguang Biochemical Pharmaceutical Co., Ltd., Yichang, Hubei 443000, China)
Abstract: In order to solve the shortage of xylanase substrate and screen the xylanase which could be used for the enzymatic preparation of xylooligosaccharides, firstly, the xylanase activity was detected by replacing the substrate specified in GB/T 23874-2009 ″Determination of xylanase activity in feed additives″ with xylanase derived from bagasse and beech. At the same time, The xylanase of trichoderma and pichia pastoris was used to hydrolyze different xylan substrates and corncob xylan by enzyme. The components of the enzymatic hydrolysates were analyzed by HPLC, and the enzymatic hydrolysis conditions of corncob xylan were preliminarily optimized. The results showed that compared with the detection results of the substrate specified in GB/T 23874-2009 ″Determination of xylanase activity in feed additives″, the detection results of beech xylan (Megazyme) were basically consistent with that of the original substrate. The results of bagasse xylan were higher, but the stability was good. Both of them could replace the original substrate for the detection of xylanase activity. By the analysis of HPLC, compared with trichoderma xylanase, the content of xylobiose was higher in the hydrolysis of different substrates by pichia pastoris xylanase, while the content of xylose was opposite. Three kinds of xylanase were used to hydrolyze corncob xylan simultaneously. More than 90% of the products of corncob xylan hydrolyzed by pichia pastoris xylanase were xylooligosaccharide, 72.54% and 17.86% of which was respectively xylobiose and xylotriose. being close to the proportion of xylooligosaccharide in the products hydrolyzed by Shearzyme 500L xylanase and higher than that by trichoderma xylanase, indicating that it had the application potential in the preparation of xylooligosaccharide. The optimal conditions for the hydrolysis of corncob xylan by pichia pastoris xylanase were as follows: reaction temperature of 60℃, pH of 4.8, the concentration of corncob substrate of 0.10 g·mL-1 and hydrolysis time of 24 h. Under these conditions, the hydrolysis rate of corncob xylan could reach 76%.
Key words: Xylan substrate; Xylanase; Xylooligosaccharide; Hydrolysis rate
木聚糖酶是一类可以将木聚糖降解成低聚木糖和木糖的水解酶,主要包含内切β1,4木聚糖酶、外切β1,4木聚糖酶和
β木糖苷酶,其中内切木聚糖酶切β1,4糖苷键生成低聚木糖,β木糖苷酶水解低聚木糖释放木糖[1]。木聚糖酶除用于饲料[2-3]、烘焙[4]、造纸[5]等行业外,其中内切木聚糖酶还可用于低聚木糖的制备[6-9]。木聚糖酶来源广,仅饲料添加剂品种目录(2013)中木聚糖酶允许使用产生菌种就有7个,而工业高密度发酵产生菌以长柄木霉[10-11]和毕赤酵母[1]为主,但两种菌种发酵酶活差异较大,组分也存在差异。酶活力可以表征地反应木聚糖酶的水解能力,现通用木聚糖酶活力检测方法为GB/T 23874-2009 《饲料添加剂木聚糖酶活力的测定》[12],底物为Sigma公司生产的X0627燕麦木聚糖,目前已停止生产。有研究发现以燕麦为底物检测结果要比桦木的高16%以上[13-14]。表明底物对酶活力检测结果有很大影响。由于各厂家使用底物不同,导致检测结果存在较大的差异。这对木聚糖酶的开发、应用及推广造成不利影响。
低聚木糖(XOS)亦称木寡糖,是由2个9个木糖单元,以β1,4糖苷键连接而成的以木二糖和木三糖为主要成分的混合物。XOS2-4指木二糖、木三糖、木四糖之和[15],木二糖是低聚木糖最主要的活性成分。现低聚木糖主要用酶法水解木聚糖生产,在工业化生产时所用酶制剂的内切木聚糖酶活力应尽可能高,而β木糖苷酶活力尽可能低,才能保证酶解产物中有较高的低聚木糖。现有研究大多集中在实验室规模,发酵酶活低[15],已报告的商业化产品诺维信Shearzyme 500L可用于水解甘蔗渣制备低聚木糖[6,16],但价格偏贵,实际应用生产成本较高。本研究利用不同来源的木聚糖底物检测木聚糖酶活性,以筛选国标底物的替代物。同时利用毕赤酵母和木霉木聚糖酶水解纯度较高的木聚糖底物和玉米芯木聚糖,分析比较2种木聚糖酶的酶解产物组分差异,以筛选适合用于制备低聚木糖的木聚糖酶并优化玉米芯木聚糖酶解条件,旨在为生产上提供参考依据。
1 材料与方法
1.1 试验材料
木聚糖酶标样:木霉木聚糖酶(10万U·g-1),毕赤酵母木聚糖酶(20万U·g-1),宜昌东阳光生化制药有限公司;木聚糖酶(Shearzyme 500 L),诺维信生物技术有限公司。底物:甘蔗渣木聚糖(≥85%),上海源叶生物公司(以下简称甘蔗渣底物);榉木木聚糖(>95%),爱尔兰Megazyme公司(以下简称Megazyme榉木底物);榉木木聚糖(X4252≥90%),美国SigmaAldrich公司(以下简称SigmaX4252榉木底物)。玉米芯木聚糖:经处理过的玉米芯粉,其中半纤维素含量占干基70.25%,纤维素含量15.25%[17-18]。
1.2 试验试剂及仪器
标准品为木二糖(98%)、木三糖(98%),上海麦克林生化科技有限公司生产;木糖(98%)、木四糖 (98%),上海源叶生物公司生产。紫外分光光度计 UV2600,日本岛津有限公司生产;Waters 3489/2695高效液相色谱仪,美国Waters公司生产。
1.3 试验方法
1.3.1 不同来源木聚糖底物对木聚糖酶活力的影响 木聚糖酶活力采用GB/T 23874-2009《饲料添加剂木聚糖酶活力的测定方法》进行检测。除使用甘蔗渣和榉木木聚糖(Megazyme)底物替代原底物榉木木聚糖(SigmaX4252)检测木聚糖酶活力外,其余步骤一致。检测时每个样品做3个平行样,以均值为报告酶活。
1.3.2 甘蔗渣木聚糖底物检测2种木聚糖酶活力稳定性 统计底物在不同时间段检测木霉和毕赤酵母木聚糖酶的酶活数据(期间底物已多次配制),计算均值、标准差及相对标准偏差。若相对标准偏差<5%,则认为检测稳定性良好,可作为替代物。
1.3.3 木霉和毕赤酵母木聚糖酶酶解不同底物组分分析 按照GB/T 23874-2009《饲料添加剂木聚糖酶活力的测定》中的方法配制100 mg·mL-1的甘蔗渣和櫸木木聚糖底物。将木霉和毕赤酵母木聚糖酶用pH 4.8的乙酸乙酸钠缓冲液稀释至200 U·mL-1。取底物和酶各2 mL混合均匀,在50℃下反应30 min,煮沸终止反应,取样检测木糖、木二糖等组分含量
[6,19-21]。
1.3.4 不同木聚糖酶对玉米芯木聚糖酶解的影响 取45 g玉米芯粉至300 g pH 4.8缓冲液中,分别加入玉米芯粉量1.5%的3种木聚糖酶,50℃水浴保温。在24 h和48 h分别取样检测还原糖含量,并用纯水稀释至还原糖含量约10 mg·mL-1,经0.22 μm微孔滤膜过滤后HPLC法检测水解液中产物,对比毕赤酵母和木霉木聚糖酶与Shearzyme 500L的酶解差异。
1.3.5 玉米芯木聚糖酶解条件初步优化 (1)底物浓度对玉米芯木聚糖水解率的影响。利用毕赤酵母木聚糖酶进行玉米芯木聚糖酶解试验,在酶加量1.5%、反应温度50℃、pH 4.8的条件下,研究底物浓度0.10、0.15 g·mL-1对玉米芯木聚糖水解率的影响。(2)反应温度对玉米芯木聚糖水解率的影响。利用酵母木聚糖酶进行玉米芯木聚糖酶解试验,在酶加量1.5%、底物浓度0.10 g·mL-1、pH 4.8的条件下,研究反应温度50℃、55℃和60℃对玉米芯木聚糖水解率的影响。
1.4 还原糖及水解率的测定
还原糖含量测定参照GB/T 23874-2009《饲料添加剂木聚糖酶活力的测定》方法,取水解液与DNS反应,通过木糖标准曲线读出还原糖含量。
水解率=还原糖含量加入底物重× 100%
1.5 酶解产物成分分析
高效液相色谱法:采用Waters3489/2695高效液相色谱仪,410示差折光检测器进行检测;色谱柱,waters Xbridge BEH Amide 5 um 4.6 mm×250 mm ;流动相:75%乙腈(0.1%氨水),流速1.0 mL·min-1,进样量10 uL,检测器内部温度35℃,柱温75℃。样品检测图谱中各成分峰面积由仪器工作站计算得到,结合标准品峰面积计算各组分含量。
2 结果与分析
2.1 不同来源木聚糖底物对木聚糖酶活力检测的影响
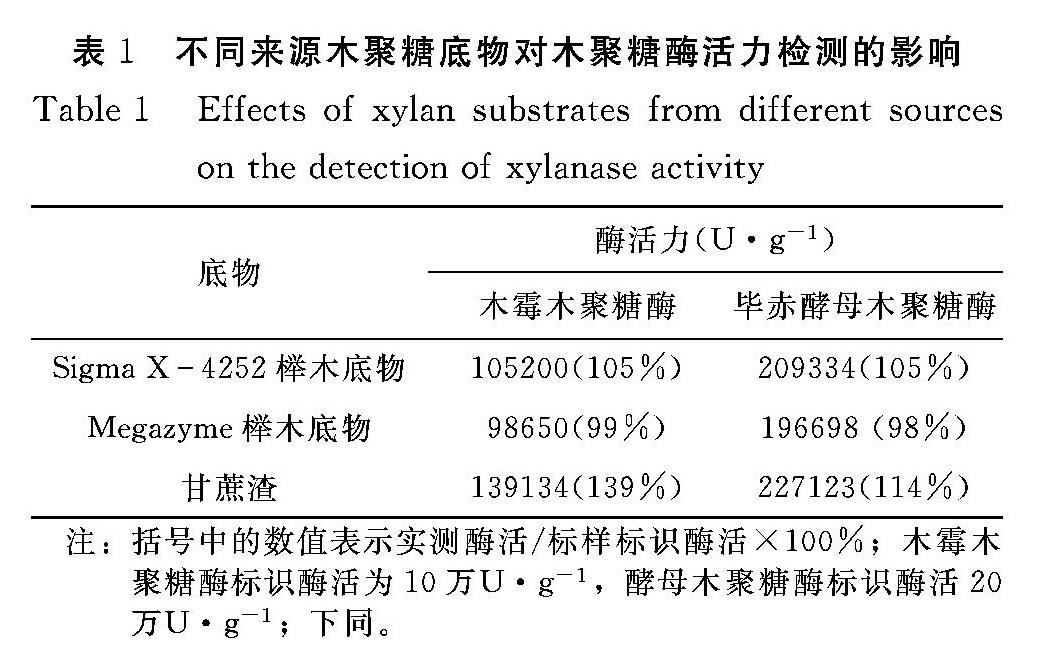
利用不同来源的木聚糖底物分别与木霉和毕赤酵母木聚糖酶反应,其中Sigma X4252为原行业通用底物,Megazyme榉木底物和甘蔗渣底物为候选底物。2种木聚糖酶标样分别用3种不同底物重复检测3次,取平均值,检测结果见表1。Megazyme榉木底物检测结果与标样酶活基本一致,可用于替换。甘蔗渣木聚糖底物检测木霉菌和毕赤酵母来源的木聚糖酶结果比标样酶活分别高1.40和1.15倍。
2.2 甘蔗渣木聚糖底物检测木聚糖酶活力稳定性
由于Megazyme榉木价格相对较高,试验对甘蔗渣木聚糖底物的检测结果做进一步分析,统计不同时间段2种木聚糖酶标样活力,以验证甘蔗渣底物替换的可行性。结果(表2)表明,使用甘蔗渣底物检测和毕赤酵母木聚糖酶活力均值分别为135 976 U·g-1和 214179 U·g-1,是标识酶活的136%和107%,变异系数在3.5%以内。表明使用甘蔗渣底物检测木聚糖酶虽然酶活力结果高,但数据稳定性好,误差符合GB/T23879-2009《饲料的测定肌醇》标准允许范围,按一定比例折算后与国家标准底物检测结果基本一致。
2.3 木霉和毕赤酵母木聚糖酶酶解不同底物组分分析
将木霉和毕赤酵母木聚糖酶酶解甘蔗渣和榉木木聚糖底物的水解液进行组分分析,液相图谱见图1~2。从图1~2可见,木霉木聚糖酶酶解3种底
物的水解组分均比毕赤酵母木聚糖多,而2种木聚糖酶酶解3种底物的水解组分均以甘蔗渣底物多。木霉木聚糖酶酶解3种底物的水解组分主要为木糖、木二糖、木三糖和木四糖,而毕赤酵母木聚糖酶酶解3种底物的水解产物中均未检出木四糖。毕赤酵母木聚糖酶和木霉木聚糖酶水解3种不同底物中的木糖、木二糖峰面积比也存在差异,毕赤酵母木聚糖酶水解3种不同底物中的木糖、木二糖峰面积比均小于木霉木聚糖酶水解产物,这与毕赤酵母木聚糖酶缺少含有将木二糖进一步水解成木糖的β木糖苷酶有关
[22-23]。
2.4 不同木聚糖酶对玉米芯木聚糖酶解的影响
利用内切木聚糖酶Shearzyme 500L制备低聚木糖已被确认有效[6,17]。本研究同时对木霉木聚糖酶、毕赤酵母木聚糖酶和Shearzyme 500L酶解玉米芯木聚糖的还原糖含量及其组分进行分析。从表3可见,木霉木聚糖酶酶解玉米芯木聚糖的还原糖含量最高,反应48 h达到100.5 mg·mL-1,高于毕赤酵母木聚糖酶和Shearzyme 500L。从图3、表4可知,木霉木聚糖酶水解产物主要为木糖,48 h达到70.8 mg·mL-1,占还原糖70%以上;而Shearzyme 500L和毕赤酵母木聚糖酶水解产物木糖含量仅为5.1和7.7 mg·mL-1。Shearzyme 500L和毕赤酵母木聚糖酶水解产物主要为木寡糖(XOS2-4),木寡糖含量分别为51.5 mg·mL-1和75.7 mg·mL-1,占还原糖90%以上,且主要为木二糖。由于不同来源的木聚糖酶成分不同,通过对玉米芯木聚糖酶解产物的组分分析,可以得知木霉木聚糖酶酶系较全,水解更彻底,故最终产物主要是木糖。而Shearzyme 500L和毕赤酵母木聚糖酶主要为内切木聚糖酶,水解产物多为木二糖。综合以上分析表明,毕赤酵母木聚糖酶酶解玉米芯粉水解产物中木寡糖(XOS2-4)含量达到75.7 mg·mL-1,即水解产物中有90%以上为低聚木糖。因此,采用酶法制备玉米芯低聚木糖时,毕赤酵母木聚糖酶的效果更佳。
2.5 玉米芯木聚糖酶解条件优化
2.5.1 底物浓度对玉米芯木聚糖水解率的影响 从表5可知,玉米芯木聚糖的酶解产物中还原糖含量在底物浓度0.15 g·mL-1、反应时间48 h时达到最大(79.1 mg·g-1),水解率在底物浓度0.10 g·mL-1,反应48 h时达到最大(53.5%)。在底物浓度相同条件下,玉米芯木聚糖水解率和水解产物中的还原糖含量均随着反应时间的延长而提高;
而在反应时间相同条件下,水解产物的还原糖含量随着底物浓度的增加而增加,但水解率反而略有下降。水解率随着底物浓度的增加而下降的原因,可能与其酶促反应速率下降有关,一方面底物浓度的增加以及反应体系黏稠性增加,影响了酶、底物和产物的扩散以及酶与底物的接触,从而降低了酶促反应速率;另一方面产物达到一定浓度后会对反应起到反馈抑制作用,造成酶促反应速率下降。因此,底物浓度以0.10 g·mL-1较适合。
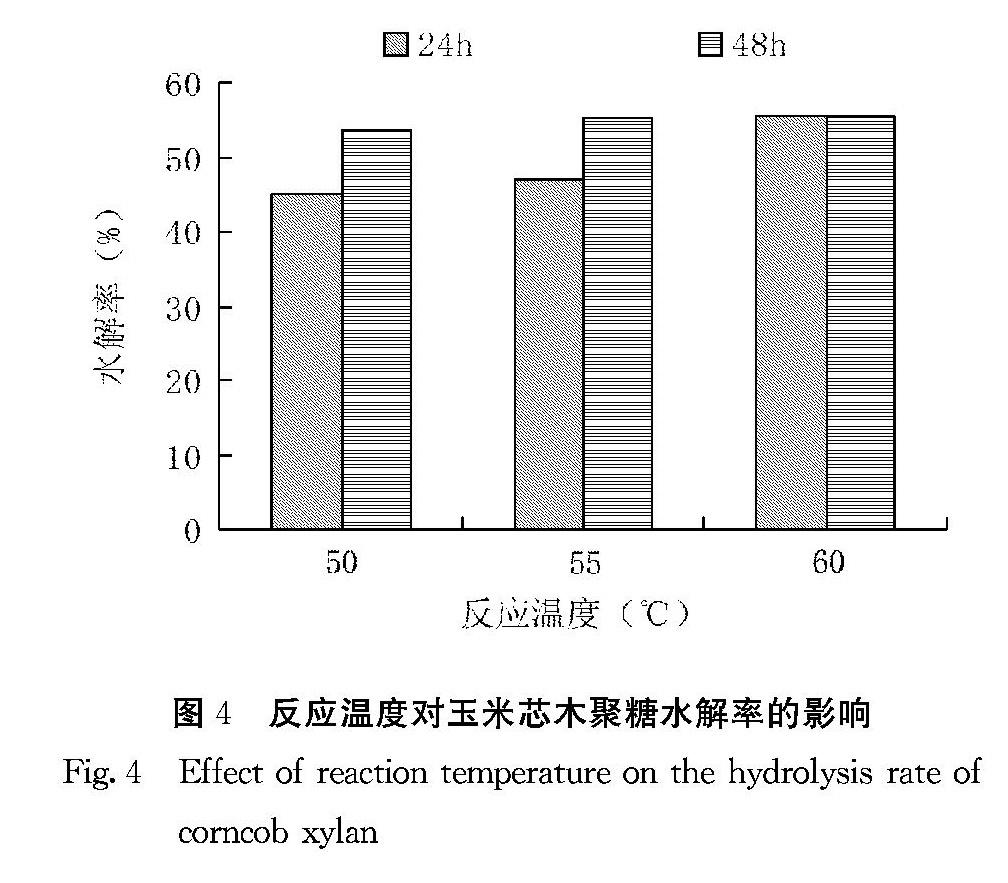
2.5.2 反应温度对玉米芯木聚糖水解率的影响 图4结果表明,反应温度由50℃提升至60℃,反应24 h后玉米芯木聚糖即可达到最大水解率(55%),按玉米芯中半纤维素纯度(72.5%)折算后水解率则达76%,高于文献报告值(63.1%)。继续反应至48 h时,水解率并未得到提升,与产物中存在的木糖会显著降低酶活性从而降低木聚糖的水解率有关。
3 结论与讨论
本研究结果表明,Megazyme榉木底物检测木霉和毕赤酵母木聚糖酶酶活结果与停产的Sigma榉木底物一致;而甘蔗渣底物检测木霉和毕赤酵母木聚糖酶活结果比Sigma榉木底物高,但其稳定性良好,其酶活变异系数均在3.5%以内。因此,Megazyme榉木底物和甘蔗渣底物均可替换停产的Sigma榉木底物用于木聚糖酶活力测定。由于Megazyme榉木价格高,生产上推荐使用甘蔗渣底物用于替换GB/T 23874-2009《饲料添加剂木聚糖酶活力的测定》中规定的Sigma榉木底物,但为保证木霉和畢赤酵母木聚糖酶的活力与原底物结果一致,需分别除以校正系数1.40和1.15。应用3种木聚糖酶酶解玉米芯木聚糖的结果表明,木霉木聚糖酶水解玉米芯木聚糖的产物以木糖为主,而毕赤酵母木聚糖酶和木聚糖酶Shearzyme 500L酶解玉米芯木聚糖的水解产物成分则以低聚木糖为主,水解48 h低聚木糖比例达到90%以上,且以木二糖和木三糖为主。表明,毕赤酵母木聚糖酶更具有工业应用价值。试验同时对毕赤酵母木聚糖酶酶解玉米芯木聚糖的条件进行初步优化,其最优条件为反应温度60℃、pH 4.8和玉米芯底物浓度0.10 g·mL-1,添加底物重量1.5%的毕赤酵母木聚糖酶解24 h,在此最优条件下玉米芯木聚糖水解率可达到76%。
酶解过程中水解产物产生的木糖不属于活性成分,石国良等[6]研究发现,木糖的积累会降低木聚糖酶活性,造成水解率难于进一步提升。因此,在实际应用时需寻找合适的办法及时去除酶解过程中产生的木糖,从而获得更高木二糖含量的水解产物。另外,玉米芯木聚糖经酶解处理后的水解产物中还含有15%纤维素,其存在会对半纤维素的水解造成不利影响。因此,下一步的研究重点是将可复配纤维素酶进行同步水解,进一步优化酶解条件,尤其是酶的添加量,从而降低应用成本。
参考文献:
[1]贾伟.毕赤酵母产木聚糖酶的发酵工艺研究[D].南京:南京工业大学,2008.
[2]白立新.木聚糖酶的作用机理及在畜禽饲料中的应用[J].兽医导刊,2020(6):254.
[3]BEG Q K,KAPOOR M,MAHAJAN L,et al.Microbial xylanases and their industrial applications: a review[J]. Applied Microbiology and Biotechnology, 2001,56(3-4):326-338.
[4]陈德柱.新型木聚糖酶在烘焙中的应用[J].粮食加工,2020(6):28-29.
[5]赵丽君,刘文,牛梅红,等.木聚糖酶在制浆造纸上的应用及研究进展[J].天津造纸,2015(4):15-18.
[6]石国良,周玉恒,张厚瑞,等.木聚糖酶Shearzyme 500L酶解蔗渣木聚糖的特性研究[J].食品科学,2010,31(24):102-106.
[7]毛连山,勇强,宋向阳,等.内切木聚糖酶的选择性纯化及酶解制备低聚木糖的研究[J].林产化学与工业,2006,26(1):124-126.
[8]马婷婷,杜倩,干昭波,等.木聚糖酶在制备低聚木糖中的应用进展[J].精细与专用化学品,2021(2):6-11.
[9]李秀婷,吕跃钢,宋焕禄,等.功能性低聚木糖与木聚糖酶酶制剂[C]//中国发酵工业协会第四届会员代表大会.北京,2009:65-67.
[10]HALTRICH D,NIDETZKY B,KULBE K D,et al.Production of fungal xylanases[J]. Bioresour Technol ,1996,58(2):137-161.
[11]魏瑛.里氏木霉发酵生产木聚糖酶的研究[D].无锡:江南大学,2008.
[12]中華人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 23874-2009饲料添加剂木聚糖酶活力的测定 分光光度法[S].北京:中国标准出版社,2009.
[13]罗长辉,陈冰,李书明,等.木聚糖酶酶活测定的几点体会[J].广东饲料,2011(5):37-38.
[14]范志恒.不同底物及NaOH的添加对木聚糖酶酶活测定的影响[J].饲料广角,2011(11):36-37.
[15]王月皎,何浪,王飞,等.嗜热木聚糖酶的克隆表达及其在酶解生产低聚木糖中的应用[J].食品工业科技,2018(13):105-109,116.
[16]陈海珊,石国良,覃香香,等.热带假丝酵母( Candida tropiclis )去除蔗渣木聚糖酶解副产物的研究[J].广西植物,2014(3):387-392.
[17]张文博,贺建龙,蒋浩,等.木质纤维物质中纤维素和半纤维素含量的测定[J].江苏农业科学,2017(5):281-284.
[18]熊素敏,左秀凤,朱永义.稻壳中纤维素、半纤维素和木质素的测定[J].粮食与饲料工业,2005(8):40-41.
[19]刘泰然,李洁,刘平,等.高效液相色谱示差折光法测定保健食品中的低聚木糖[J].中国食品卫生杂志,2012(2):132-135.
[20]郑凤家,李蔚,陈金东,等.保健食品中低聚木糖高效液相色谱示差折光法测定[J].中国公共卫生,2020(3):429-432.
[21]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.中华人民共和国国家标准GB/T 35545-2017低聚木糖[S].北京:中国标准出版社,2017.
[22]徐勇,陈牧,余世袁,等.木聚糖酶水解制取低聚木糖的研究[J].林产化学与工业,2002(2):57-60.
[23]杨本宏,刘斌,吴克,等.酶法制备低聚木糖中木二糖的提纯与色谱鉴定[J].工业微生物,2000(4):11-14.
(责任编辑:林玲娜)

