弱精子症与健康可育男性精子miRNA 表达谱差异分析
梁高照,张国晖,李 春,汪 清(通讯作者)
(1 深圳市宝安人民医院<集团>泌尿疾病中心 广东 深圳 518000)
(2 广东医科大学 广东 湛江 524000)
弱精子症(asthenozoospermia, AZS)是指精子前向运动(a 级+b 级)小于32%的病理状态,是男性不育的主要原因之一[1]。健康可育男性精子microRNA,(miRNA)是一类小的、单链的非编码RNA 分子,是基因表达中的一类调控因子。在精子发生过程中,miRNA 以细胞特异性方式表达,参与男性生殖细胞分化的每个步骤[2]。研究表明,miRNA 表达失调会导致AZS,是AZS形成的重要原因[3-5]。然而,由于实验对象、年龄、实验方法或miRNA 参考范围存在差异,各个研究中心之间关于AZS 的miRNA 的研究数据及表达谱仍然存在很大差异。鉴于miRNA 调控在AZS 发生中的重要作用及各研究中心之间关于miRNA 表达谱的参差不齐,旨在鉴定和表征AZS 不育男性和健康可育男性精子中的miRNA 表达谱,并进一步探讨miRNA 靶基因的功能聚类及控制通路,预测miRNA 在AZS 发生中的分子机制。
1.资料与方法
1.1 一般资料
于2018 年12 月—2019 年11 月,选取因不孕不育到深圳市宝安区人民医院泌尿外科就诊的年轻男性。(1)AZS 不育组纳入标准:25 ~40 岁男性;精液实验室检查符合AZS 世界卫生组织(World Health Organization WHO)诊断标准:活力PR 级(a+b 级)<32%、精子浓度≥15×106/mL、正常精子形态≥4%;未育;性激素水平正常;生殖系统体格检查正常。(2)正常对照组纳入标准:25 ~40 岁男性;精液实验室检查正常:PR 级(a+b 级)≥32%、精子浓度≥15×106/mL、正常精子形态≥4%;具有健康子代。(3)排除标准:精液异常(颜色、体积、液化异常)、精浆果糖异常、α-葡糖糖苷酶异常、泌尿生殖道感染。纳入的所有男性均签署知情同意书。
1.2 实验方法
1.2.1 样本收集 所有男性禁欲5 d 后收集精液,常温下液化。采用SCA 全自动精液质量分析仪对样本进行常规分析。分析所有精液样本的参数,包括体积、液化时间、pH、精子数量、精子活力、精子密度和形态。液化后立即在-80℃冰箱下保存。
1.2.2 样本总RNA 提取及质量检测 精液样品解冻,分离精浆,纯化精子。总RNA 提取方法参照RNA 提取试剂盒(invitrogen,美国)使用说明。采用Nanodrop 超微量核酸蛋白检测仪测定所提取的总RNA 浓度。1%的琼脂凝胶电泳检测RNA 样本质量。筛选满足条件的RNA 样本保存于-80℃冰箱。
1.2.3 MiRNA 文库构建 按照QIAseqTM miRNA Library Kit 说明书进行文库制备,文库制备完成后,对文库质量进行检测,确保文库有效浓度>2 nmol/L。在HiSeq-2000 系统上进行测序。通过HiSeq 控制软件进行实时分析和碱基识别。
1.2.4 小RNA 序列分析
测序下机后,分析原始数据,并删除低质量的reads。修剪3'衔接子序列后,使用miRDeep2 以默认参数从所有文库中提取长度大于17 nt 的小RNA 读数,以识别已知的和新颖的miRNA[6]。每个库分别处理。
1.2.5 靶基因预测和信息深度分析 通过miRTarBase 数据库预测差异表达miRNA 的靶基因。为了全面描述基因和基因产物的特性,我们采用topGO(version 2.18.0)从分子功能、生物过程和细胞组成三个方面进行了基因本体(gene ontology, GO)注释和富集分析,采用KOBAS(kobas2.0-20150126)[7]对筛选到的差异基因进行KEGG PATHWAY 富集分析,挖掘差异表达miRNA 靶基因参与的主要功能及生化代谢途径。
1.3 统计学方法
2.结果
2.1 一般资料
使用SCA 全自动精液质量分析仪对不育组35 例AZS不育患者精液样本和36 例健康对照组精液样本进行精液常规分析。收集并分析组间样本参数,发现组间样本在年龄、精液体积、pH、液化时间、精子密度、精子畸形率方面无统计学差异(P>0.05)。但弱精症组精子前向运动率明显低于正常对照组,具有统计学差异(P<0.05),见表1。
表1 两组精液样本参数比较( ± s)

表1 两组精液样本参数比较( ± s)
注:aP >0.05,bP <0.05。
项目 不育组(n=35) 对照组(n=36)年龄/岁 33.48±1.716a 30.33±1.871体积/mL 4.33±0.943a 4.33±0.471 pH 7.59±0.162a 7.49±0.067液化时间/min 25.00±2.454a 26.67±2.491密度/(106•mL-1) 87.82±4.451a 86.27±2.658活力/%(a+b) 24.05±1.232b 69.42±5.977畸形率/% 73.90±4.374a 75.63±3.027
2.2 RNA 纯度和浓度
使用Nanodrop 超微量核酸蛋白检测仪检测RNA 纯度和浓度,结果显示大部分样本所提取的RNA 浓度均处于较低水平;琼脂凝胶电泳检测RNA 质量发现RNA条带不清晰。RNA 样本筛选阈值设定为:RNA 浓度大于80 ng/μL、1.8 <OD260/OD280 <2.0 且RNA 电泳图条带清晰。仅有7 个样本(不育组4 例和对照组3 例)满足上述筛选标准,纳入测序实验,见表2。

表2 两组样本RNA 浓度和纯度比较
2.3 基因表达丰度统计
基因表达定量用TPM 作为单位,即每百万reads 中来自某一基因的reads 数[10]。对数据进行统计后得到如下的TPM 分布箱式图,见图1。

图1 TPM 分布箱式图
2.4 miRNA 差异表达谱
采用二代测序平台对样本进行测序,然后采用edgeR分析miRNA 的表达水平。本次分析中差异基因的筛选主要从差异倍数和显著水平两方面进行评估,筛选阈值设定为:|log2(FoldChange)|>1 且FDR <0.01。结果表明,共有16 个miRNA 的表达改变具有统计学意义,其中10 个miRNA 表达下调,6 个miRNA 表达上调,见表3。MiR-34c 在弱精症组中表达水平明显下调,具有最显著的表达差异(FDR=9.15×10-5);miR-34b表达水平同样下调,且表现出了最大倍数变化(|log2(FoldChange)|>4)。我们对不育组和对照组差异表达的16 个miRNA 的相互关系进行分层聚类。观察到2 个不同的簇团,弱精症组与正常对照组差异表达的miRNA 分别聚类。通过对差异表达的16 个miRNA 的靶基因进行预测,发现了这些miRNA参与了9 744 个靶基因的调节,见表3。

表3 符合筛选标准的miRNA
2.5 miRNA 靶基因信息学分析
为了更好地了解这些miRNA 的潜在含义,对目标基因进行了GO 富集分析和KEGG Pathway 富集分析,以评估其潜在功能。GO 分析结果表明,miRNA 靶基因显著富集于不同功能组(P<0.05)。这些差异表达的miRNA靶基因参与细胞代谢过程、RNA 生物合成过程的调控、RNA 代谢过程的调控、生物合成过程的调控等生物过程,参与了细胞器、细胞质、细胞核等细胞成分;参与蛋白质结合、DNA 结合、转移酶活性、酶结合等分子功能调节。我们分别对上调的6 个miRNA 的靶基因和下调的10 个miRNA 的靶基因进行GO 富集分析,也得出和上诉基本一样的结论。KEGG Pathway 富集分析结果表明miRNA 靶基因明显富集于90 个KEGG 途径(P<0.05),涉及的代谢通路非常广泛。MiRNA 调节的最活跃的代谢途径包括癌症中的microRNA、EGFR 酪氨酸激酶抑制剂耐药、慢性粒细胞白血病、胶质瘤、大肠癌、内分泌抵抗、前列腺癌、细胞衰老、乙型肝炎、癌症中的蛋白聚糖,见图2。
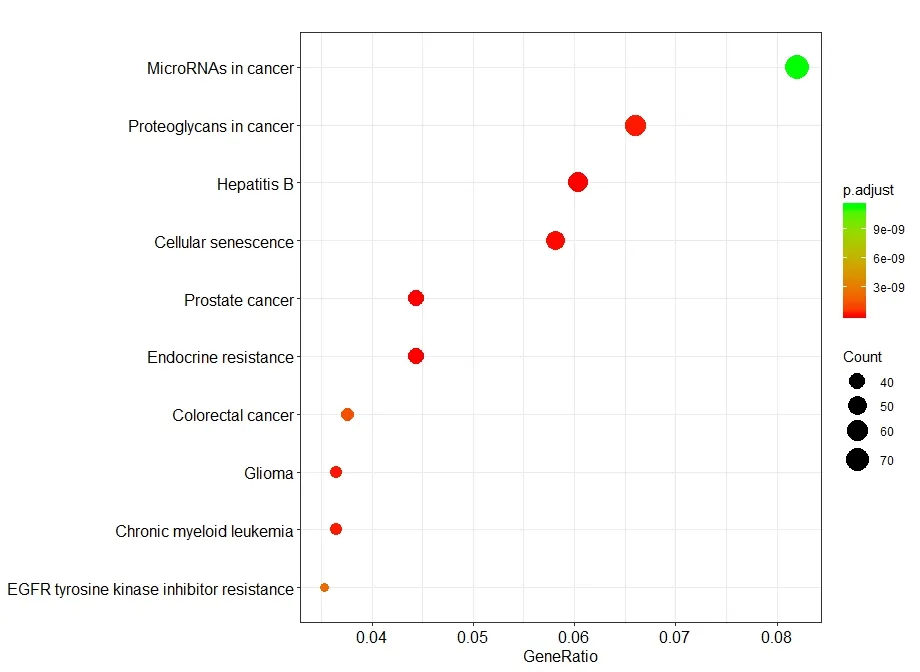
图2 差异表达基因KEGG 富集散点图
3.讨论
24%的不育男性因各种因素(精索静脉曲张、感染或遗传原因)而出现孤立的AZS[11-13]。然而,许多AZS病例在本质上是特发性的,并且不能将具体原因归因于该病症[14]。因此,需要进一步研究以更好地了解影响精子前向运动力的因素,以治疗/管理此类病例。精子发生是一个复杂过程,涉及众多miRNA 的精细调控。既往已经有部分文献表明miRNA 失调与AZS 相关[3-5]。
共收集了35 例AZS 不育男性精液样本和36 例健康可育男性精液样本。然而,在检测RNA 质量时,结果显示,绝大部分样本(64 例)RNA 浓度偏低,无法建库进行测序。经过分析,我们认为原因可能包括以下几点:(1)精子细胞RNA 含量极低,约为体细胞RNA 的1/100[15];(2)精子RNA 主要存在于致密的细胞核及核周围[16],大大增加提取难度;(3)RNA 自身结构中尚存在2 个游离的羟基,容易进攻自身的肽键;(4)RNA 是单链结构,极不稳定,在样本液化、储存、及实验过程中非常容易受外界环境(温度、RNA 酶、储存时间)影响,导致发生不同程度的降解,降低RNA 含量。由此可见,提取精子RNA 的难度相对较大,对实验设计及环境要求比较严格。从以上原因,我们认识到在涉及精子RNA 的实验中,我们应该优化实验方案,改善实验条件,避免储存过长时间,严格在低温条件下进行操作,尽量减少RNA降解[17]。
通过下一代测序平台评估了AZS 不育男性和正常可育男性的精子差异表达的miRNA 谱。我们的实验数据和Abu-Halima 等[17]以及Salas-Huetos 等[3]的研究结果吻合,比如miR-34b 和miR-143 在AZS 患者中均存在表达失调。更重要的是,我们还发现了很多之前未曾报道与AZS 相关的miRNA,极大地丰富AZS 中的miRNA 差异表达库,为后续研究miRNA 调控AZS 发生的生物学机制提供了新的方向。相较于健康对照组,AZS 不育患者中miR-34c 表达明显下降,表现出较大的表达倍数变化,且具有最显著的统计学差异。我们认为miR-34c 在AZS中具有巨大的潜在作用,有希望成为AZS 的诊断性生物标志物和治疗的生物靶点。
为了进一步了解和提供一些分子信息,以了解AZS 涉及这些miRNA 的生理功能和生物学过程,基于miRNA/mRNA 的相互作用原理预测了靶基因。GO 和KEGG功能注释结果表明,miRNA 靶基因的代谢途径涉及范围十分广泛。由此可见,在参与AZS 发生过程中,miRNA的生物学调节机制被整合于多个途径中,通过多种信号传导途径调节多种基因表达。广泛的靶标范围及作用途径充分表明这些miRNA 可能在AZS 发生的生物学调控中起着至关重要的作用。
本文对象是青壮年不育男性,文中尚未明确不同年龄组的miRNA 表达谱是否存在差异,有待进一步明确。
综上所述,AZS 不育男性和健康可育男性的精子miRNA 存在着不同的表达谱,同时也丰富了AZS 的miRNA表达谱,miR-34c 有望成为AZS 的生物标志物和治疗靶点。miRNA 靶基因显著富集于多个生物学通路中,通过多种信号通路影响精子的发生,导致AZS。

