火焰原子吸收光谱法测定铅精矿中氧化钙的含量
于 亮,王 军,王 晶
(株洲冶炼集团股份有限公司,湖南 株洲 412000)
铅精矿中的钙为火法炼铅炉料中的重点监控元素之一,关系到炉窑内物料的粘接性和流动性,工艺控制中需根据其中的钙和硅含量,确定掺入石灰或河沙的比例,以获得良好的渣型。准确检测其中的氧化钙对炼铅工艺质量提升有重要指导作用。钙的测定方法和应用有多种,如常量分析常用的滴定法、微量分析用ICP-AES法及痕量分析用的ICP-MS法等。滴定法对于含量较低的样品分析具有一定局限性且分析流程较长;ICP分析方法对实验室条件要求高,分析成本也较高。现试验用火焰原子吸收光谱法测定其中CaO含量,通过讨论和优化测定技术方案以达到简便、快捷和准确测量的目的。
1 试验部分
1.1 试剂
试验中均使用分析纯及以上纯度的试剂和符合GB/T 6682规定的二级水及以上纯度的水。
1.氢氟酸(ρ=1.15 g/mL)。
2.盐酸(ρ=1.19 g/mL)。
3.硝酸(ρ=1.42 g/mL)。
4.氢溴酸(ρ=1.50 g/mL)。
5.高氯酸(ρ=1.76 g/mL)。
6.盐酸(1+1)。
7.锶溶液(20 g/L):称取30.43 g氯化锶(SrCl2·6H2O)于250 mL烧杯中,用水溶解后,转移至500 mL容量瓶中,用水稀释至刻度,混匀。
8.氧化钙标准贮存溶液:称取1.784 9 g碳酸钙(基准试剂,预先在105~110℃烘干1 h,置于干燥器中冷却至室温)于250 mL烧杯中,加少量水润湿,加入40 mL盐酸溶解完全后,转移至1 000 mL容量瓶中,用水稀释至刻度,混匀。此溶液1 mL含1 mg氧化钙。
9.氧化钙标准溶液[1]:移取10.00mL氧化钙标准贮存溶液于100 mL容量瓶中,用水稀释至刻度,混匀。此溶液1 mL含100μg氧化钙。
1.2 仪器
原子吸收光谱仪,附钙空心阴极灯。
1.3 试验步骤
1.称取0.2 g样品(精确0.000 1 g)置于250 mL聚四氟乙烯烧杯中,加入少量水润湿,加入10 mL盐酸,置于电热板上低温加热5~10 min,加入10 mL硝酸,3~5 mL氢氟酸,加热蒸至体积约10 mL,加入5 mL高氯酸,加盖塑料表皿继续加热溶解,蒸至高氯酸冒白烟(如含碳高,补加2 mL高氯酸),蒸至近干,取下冷却[2]。加入40 mL盐酸,用水冲洗杯壁,加热使盐类完全溶解,取下冷却至室温。将溶液转移至100 mL容量瓶中,用水稀释至刻度,混匀,静置。
2.分取上清液5.00 mL于100 mL容量瓶中并补加2.0 mL盐酸,加入5.0 mL锶溶液,用水稀释至刻度,混匀。
3.将试液于火焰原子吸收光谱仪波长422.7 nm处,使用空气-乙炔火焰,与系列标准溶液同时,以水调零,测量溶液吸光度,从工作曲线上查出相应的氧化钙的质量浓度。
1.4 工作曲线的绘制
1.移取0 mL、1.00 mL、2.00 mL、3.00 mL、4.00 mL、5.00 mL、6.00 mL氧化钙标准溶液分别置于一组100 mL容量瓶中,加入4.0 mL盐酸,5.0 mL锶溶液,用水稀释至刻度,混匀。
2.与试料相同条件下,以水调零,测量溶液吸光度,减去“零”浓度溶液的吸光度,以氧化钙浓度为横坐标,吸光度为纵坐标绘制工作曲线,工作曲线如图1所示。

图1 工作曲线线性图
1.5 结果计算
氧化钙的含量以质量分数ωCaO计,按式(1)计算:
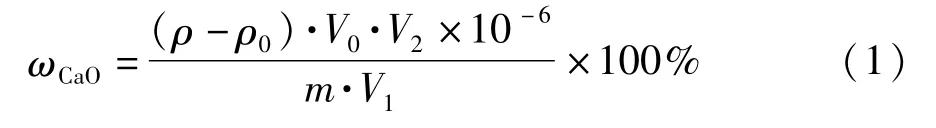
式中:ρ为自工作曲线上查得的试料溶液的氧化钙质量浓度/μg·mL-1;ρ0为自工作曲线上查得的空白溶液的氧化钙质量浓度/μg·mL-1;V0为试液总体积/mL;V2为分取试液稀释后的体积/mL;m为试料的质量/g;V1为分取试液的体积/mL。
2 试验结果及讨论
2.1 原子吸收光谱仪工作条件的选择
经优化,试验选择:贫燃焰(乙炔-空气火焰,经测试纯标准溶液测量用贫燃焰或富燃焰区别甚微,但测量试样及加干扰元素时富燃焰抗干扰能力太差),乙炔流量1.5~1.7 L/min;灯电流3 mA,狭缝0.2 nm,燃烧头高度6 mm。
2.2 溶样方法选择试验
2.2.1 样品消解方案试验
方案一依照设计草案用盐酸、硝酸、氢氟酸和高氯酸联合溶样;方案二采用较常规的王水加高氯酸溶样,试验现象及结果见表1。
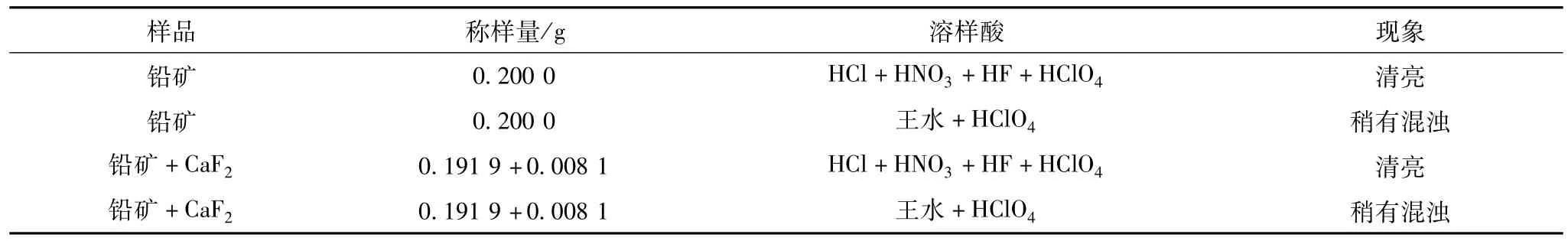
表1 溶样方法对比试验
考虑到矿样里面会有少量SiO2存在,且方案一样品处理后溶液清亮,故后续试验均采用盐酸、硝酸、氢氟酸和高氯酸联合的溶样方法。
2.2.2 盐类复溶加酸量选择
因溶样后加盐酸溶解盐类时出现沉淀物,故对复溶加酸量进行选择试验,选择含铅量较高的两个样品,消解后加入不同量盐酸,试验现象及数据见表2。
由表2可见复溶盐类加酸量对测定结果无明显影响,但为保证含Pb量更高样品和温度较低时不出现沉淀及不影响仪器性能,试验选择加入盐酸量为40.0 mL,即一次定容后盐酸浓度为20%。
2.2.3 测定溶液酸度选择
分别移取6.00 mLCaO标准溶液于一组100 mL容量瓶中,CaO标液浓度为6.00μg/mL加入不同量体积的盐酸,比较吸光度值,结果见表3。
由表3可知,1%~2%的盐酸浓度能保持较高的灵敏度,考虑为不使金属离子发生水解,选择使用2%的酸度。
2.3 锶盐浓度选择试验
为试验添加锶盐的必要性,取试样先做了回收率预研。按试验步骤称取单个试样做双份回收试验,试验结果见表4和表5。由表4和表5可见,加入锶盐时试样测试回收率良好。
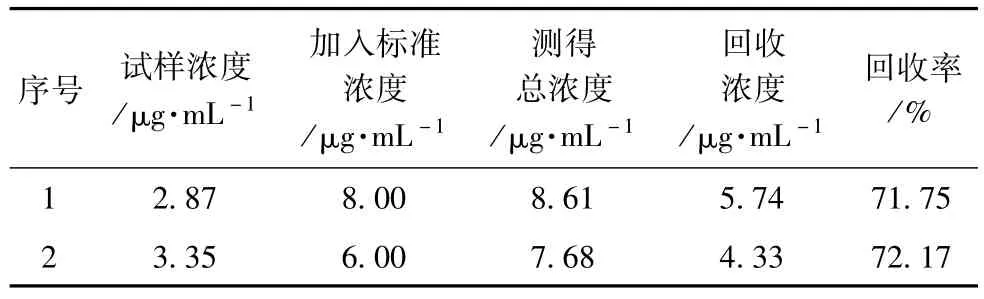
表5 不加锶盐条件下的试样加标回收率
为确定测试溶液中合适的锶盐用量,进行如下试验:移取2.00mL和6.00mLCaO标准溶液分别置于一组100 mL容量瓶中,加入4.0 mL盐酸,按表6加入多种干扰元素(同时做无干扰对照),再分别加入不同量锶溶液,比较吸光度值,测定结果见表7。

表6 干扰元素加入量

表7 不同锶溶液浓度中吸光度对比
由表7可见,多元素共存时,锶溶液添加量对待测元素影响较大,当加入量为5.0 mL时测量吸光度与纯标准溶液吻合,故选择5.0 mL加入量,即测定溶液中锶盐浓度为1.0 mg/mL。
2.4 杂质元素和铅基体干扰试验
以《铅精矿化学分析方法GB/T 8152》中各元素测定范围上限作为干扰杂质元素添加量依据,配制2.00μg/mL和6.00μg/mL两组CaO标准溶液,加入4 mL盐酸、5.0 mL锶溶液,再按表8分别加入不同量的干扰元素,试验结果见表8。
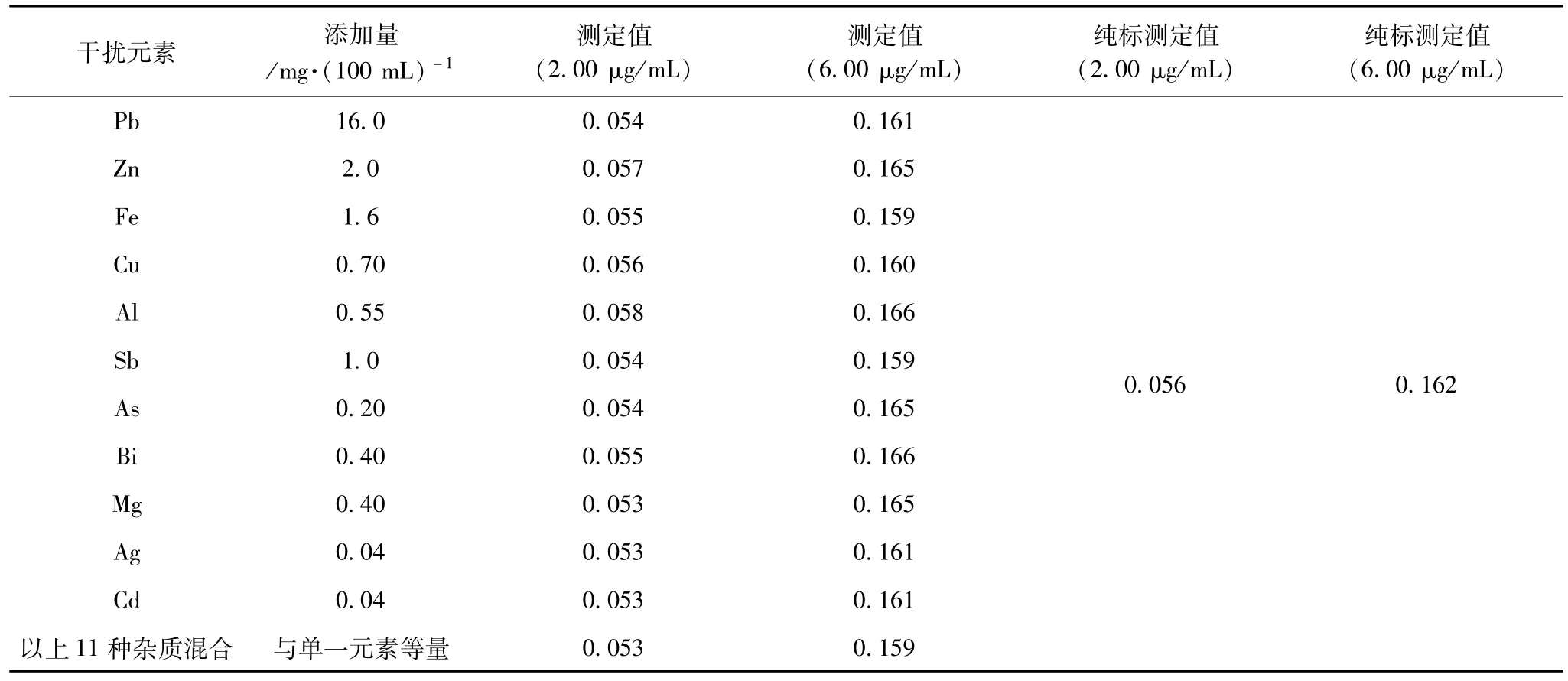
表8 杂质元素共存时测定吸光度对比 %
从表8可见,单一元素及各元素混合加入对Ca的测定都没有明显干扰。
2.5 试样加标回收试验
分别称取1#、2#、3#、4#四个样品0.200 0 g各3份,加入不同量CaO标准溶液,按试验步骤1.3处理试样,测得数据见表9。
由表9可见测得各样品回收率在94%~105%之间,该方法准确度良好,能够满足化学分析的要求。
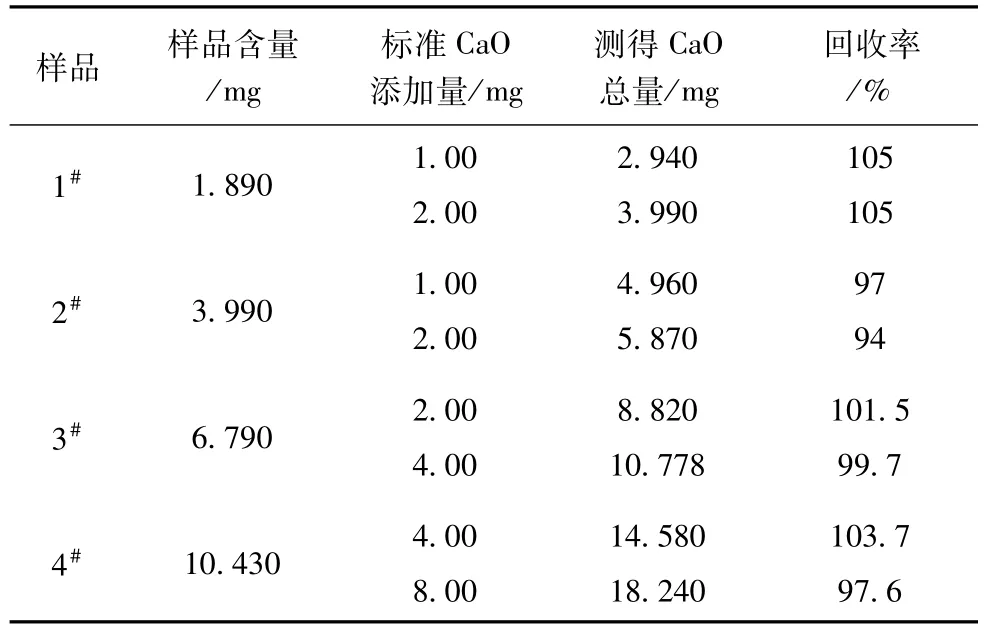
表9 试样加标回收率测试结果
2.6 精密度测试
取4个不同CaO含量水平的铅精矿试样,按试验步骤各进行11次独立测定。测定数据见表10。
从表10数据可见,4个不同水平的各11次独立测试相对标准偏差最大为3.75%,表明该方法精密度良好。
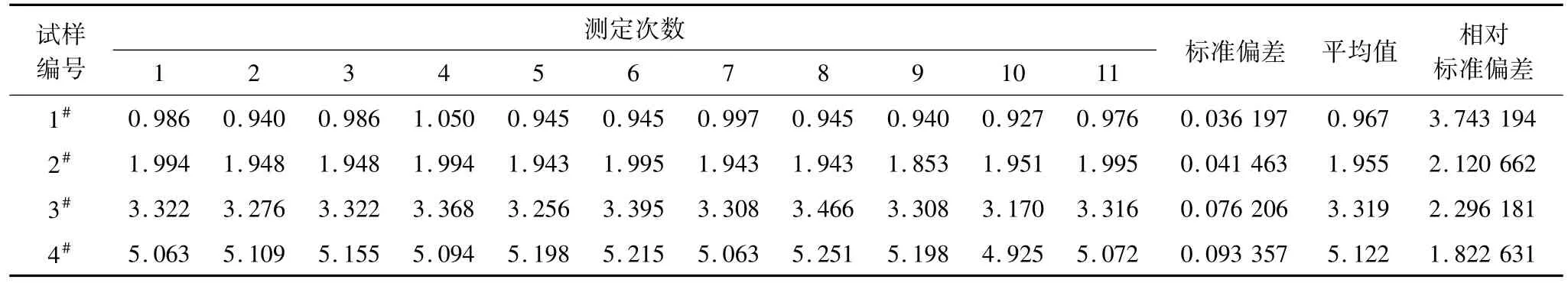
表10 试样精密度测试数据 %
3 结 论
试样以盐酸、硝酸、氢氟酸和高氯酸联合溶解,在2%盐酸介质中,加入锶盐抑制杂质元素和基体铅的干扰,用火焰原子吸收光谱法测定铅精矿中的CaO含量。该方法简单快捷、准确度和精密度良好,试验表明加标回收率在94%~105%之间,相对标准偏差小于3.75%,完全满足分析要求,可为生产控制提供技术支持。

