铜绿假单胞菌oprD基因的克隆、表达与纯化
翟文汉,宫 强,李雅静
(河南科技大学,河南洛阳471023)
铜绿假单胞菌引起禽类、水貂等多种动物发生化脓性肺炎、菌血症、败血症、心内膜炎及呼吸系统感染等疾病,给畜牧业带来较为严重的经济损失[1-6]。目前,该病的治疗主要依靠抗生素,但随着近年来该菌耐药性的日益严重,使抗生素治疗的效果降低,需要采取更加有效的预防和治疗手段。疫苗免疫是预防传染性疾病的有效策略之一,但传统的减毒疫苗和灭活疫苗在效力、安全效用方面存在着许多缺点。临床上无针对铜绿假单胞菌感染的商品化疫苗。因此,研制新型有效疫苗对预防和控制该病具有重要的意义。本研究以铜绿假单胞菌外膜蛋白oprD编码基因为目的基因,构建了其重组原核表达载体,导入大肠杆菌中进行表达与纯化,为其基因工程亚单位疫苗的研制提供参考。
1 材料与方法
1.1 试验材料
铜绿假单胞菌购自中国兽医药品监察所;大肠杆菌感受态细胞DH5α和BL21(DE3)以及原核表达载体pET32a为本实验室保存。引物合成与基因测序由上海生工生物工程有限公司完成。Taq DNA聚合酶、T4 DNA连接酶、限制性内切酶BamH I、Xho I、T-Vector pMD™19、高分子量蛋白Marker、DNA Marker DL10000及DL2000 Marker,均购自Takara公司。蛋白电泳制备试剂盒、细菌基因组DNA提取试剂盒、Ni-IDA蛋白纯化试剂盒和胶回收试剂盒,均购自生工生物工程(上海)股份有限公司。
1.2 引物设计与合成
根据GenBank上已发表的铜绿假单胞oprD基因全序列及原核表达载体pET32a多克隆位点设计合成用于扩增该基因的特异性引物,上下游分别含有BamH I、Xho I位点,引物由生工生物工程(上海)股份有限公司进行合成。序列为D-U:5'-CGGGATCCATGAAAGTGATGAAGTG GAGCGC-3',D-L:5'-CCCTCGAGTTACAGGATCGACA GCGGATAGTCGA-3'。
1.3 试验方法
1.3.1 目的基因的扩增与纯化
采用CTAB法提取铜绿假单胞菌的基因组DNA。以提取的基因组为模板,以上、下游引物对oprD基因进行PCR扩增。PCR反应体系含ddH2O 9.5μL、Taq Mix DNA聚合酶12.5μL、模板DNA 1μL、10μmol/L的上下游引物各1μL。反应程序为94℃预变性5 min;94℃变性30 s、67℃退火30 s、72℃延伸1 min,循环30次;72℃终延伸10 min,4℃保温。PCR结束后进行琼脂糖凝胶电泳以检测PCR扩增片段的大小,以胶回收试剂盒进行回收纯化,送至生工生物工程(上海)股份有限公司进行测序。
1.3.2 重组表达载体的构建
以T4 DNA连接酶将上述回收纯化后的oprD基因的PCR产物与T-Vector pMD™19共同在16℃下连接过夜,转化大肠杆菌DH5α感受态,涂布于含氨苄青霉素的LB培养平板中,37℃培养过夜,挑取菌落,抽提质粒,以BamH I/Xho I双酶切鉴定。取阳性重组质粒以BamH I/Xho I双酶切获得oprD基因片段,与同样经BamH I/Xho I双酶切处理的原核表达载体pET32a以T4 DNA连接酶进行连接,再次转化入大肠杆菌DH5α感受态,涂布于含氨苄青霉素的LB平板中,挑菌提质粒,再次以上述两种限制性内切酶进行酶切鉴定,阳性质粒命名为pET32a-oprD。
1.3.3 重组蛋白的诱导表达
制备大肠杆菌BL21(DE3)感受态细胞,取1μL pET32a-oprD质粒转化入该感受态细胞中,涂布于含氨苄青霉素的LB培养平板中,37℃培养过夜。挑取单菌落,移入含50 mg/L氨苄青霉素的5 mL LB液体培养基中,37℃、220 r/min培养过夜。次日取50μL菌液移入5 mL新鲜的含50 mg/L氨苄青霉素的LB液体培养基中,摇床37℃、220 r/min增菌,每隔1 h检测1次OD600nm值,当OD600nm值达0.6~0.8时,加入1 mmol/L的IPTG继续振荡培养5 h。取诱导后的菌液1 mL,6 000 r/min离心5 min,弃掉上清,使用pH值7.2的1×PBS漂洗,重悬沉淀,加入2×蛋白电泳上样缓冲液振荡混匀,煮沸10 min,12 000 r/min离心5 min,取上清进行SDS-PAGE电泳,电泳结束,经考马斯亮蓝染色,脱色,观察结果。
1.3.4 OPRD重组蛋白最佳表达条件的优化
为优化OPRD重组蛋白的最佳表达条件,将含pET32a-oprD质粒的BL21(DE3)菌液按上述方法进行诱导,分别探索诱导前的培养时间、IPTG浓度以及诱导时间对重组蛋白表达效果的影响,具体优化参数见表1。诱导结束后进行SDS-PAGE分析,以Image Lab软件分析不同泳道的相对表达量,确定最佳表达条件。

表1 OPRD重组蛋白的最佳表达条件的优化Tab.1 Optimization of the optimal expression of oprD recombinant protein
1.3.5 重组蛋白的分离纯化
按照上述最佳表达条件对工程菌诱导,离心收集沉淀,加入tritonx-100缓冲液进行重悬后以超声波破碎仪进行破碎处理,离心获得上清液,利用Ni-IDA蛋白纯化试剂盒对目的蛋白进行纯化,纯化产物进行SDS-PAGE分析。
2 结果与分析
2.1 目的基因oprD的PCR扩增结果(见图1)

图1铜绿假单胞菌oprD基因的PCR扩增Fig.1 PCR product of oprD gene of Pseudomonasaeruginosa
由图1可知,扩增获得约1 340 bp的特异性片段,与预期大小一致。
2.2 重组表达载体pET32a-oprD酶切鉴定结果(见图2)
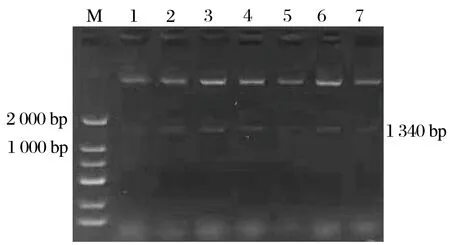
图2 重组表达载体的双酶切验证Fig.2 Electrophoresis of double digestion of pET32a-oprD
由图2可知,双酶切后获得约1 340 bp的条带,与目的基因大小一致,表明重组质粒pET32a-oprD构建成功。
2.3 重组蛋白诱导表达结果(见图3)
由图3可知,电泳图谱中可以发现重组目的蛋白的表达,分子量约65 kD,与预期大小一致,表明成功实现了OPRD重组蛋白在大肠杆菌中的正确表达。

图3 重组蛋白诱导表达结果Fig.3 SDS-PAGE of OPRD recombinant protein
2.4 最佳培养时间优化实验结果(见图4)
将含pET32a-oprD质粒的BL21(DE3)菌液分别培养2.5~6.0 h,加入1.0 mmol/L的IPTG诱导表达4 h,进行SDS-PAGE电泳分析。由图4可知,经Image Lab分析显示,菌液培养5 h后进行诱导,目的蛋白的表达量最高。

图4 不同培养时间诱导重组蛋白表达的结果Fig.4 SDS-PAGE of recombinant protein induced by different incubation time
2.5 IPTG浓度优化结果(见图5)
将含pET32a-oprD质粒的BL21(DE3)菌液培养5 h,分别加入终浓度为0.4~1.0 mmol/L的IPTG诱导表达4 h,进行SDS-PAGE电泳分析。由图5可知,Image Lab分析表明,加入IPTG至终浓度为0.7 mmol/L时,目的蛋白的表达量最高。

图5 不同IPTG浓度下诱导重组蛋白的表达结果Fig.5 SDS-PAGE of expression of recombinant protein induced by different IPTG concentrations
2.6 最佳诱导时间优化结果(见图6)
将含pET32a-oprD质粒的BL21(DE3)菌液培养5 h,加入终浓度0.7 mmol/L的IPTG诱导表达,分别诱导3~6 h,进行SDS-PAGE电泳分析。由图6可知,Image Lab分析显示,诱导时间为4.5 h时,目的蛋白的表达量最高。

图6 不同诱导时间下重组蛋白诱导的表达结果Fig.6 SDS-PAGE of expression of recombinant protein was induced by different induction time
2.7 重组蛋白分离纯化结果(见图7)

图7 重组蛋白的分离纯化结果Fig.7 SDS-PAGE of separation and purification of recombinant protein
按照最佳表达条件对工程菌进行诱导,对纯化产物进行SDS-PAGE分析。由图7可知,获得分子量约65 kD的较纯的特异性目的蛋白。
3 讨论
铜绿假单胞菌在所有耐抗生素革兰阴性菌中居于首位。对铜绿假单胞菌疫苗的研究报道不少,包括传统疫苗,如灭活疫苗、结合疫苗、重组亚单位疫苗等新型疫苗[7-9]。外膜蛋白是铜绿假单胞菌重要的保护性抗原。外膜蛋白对该病原菌的生长繁殖、环境适应、致病性及耐药性均起到至关重要的作用。由于不同血清型铜绿假单胞菌的外膜蛋白具有高度的一致性,因此外膜蛋白是理想的铜绿假单胞菌疫苗候选分子。在铜绿假单胞菌的外膜中至少存在D、E、F、G、H等16种外膜蛋白[10]。其中,OPRD是铜绿假单胞菌对碳青霉烯类抗生素耐药的主要介质,与细菌的耐药性关系密切[11-13]。Epp等[14]使用MalE-OprD融合蛋白制剂免疫新西兰大白兔,发现动物机体能产生针对OPRD蛋白的特异性抗体,表明该蛋白具有免疫原性。
本试验结果表明,菌液培养5 h后添加IPTG诱导剂,重组蛋白的表达量最高,可能因为培养5 h时,菌体处于对数生长期,浓度较高,生长代谢能力强,蛋白合成旺盛,加入诱导剂利于菌体大量表达获得OPRD蛋白,而继续培养时菌体活力下降,目的蛋白表达量降低[15]。IPTG对细菌有一定的毒性,高浓度的IPTG抑制细菌的生长,影响蛋白的表达,与本试验发现的较低浓度IPTG利于蛋白的表达相符[16]。本试验成功对目的蛋白进行纯化,获得较纯的OPRD重组蛋白。本试验为铜绿假单胞菌OPRD蛋白功能的研究及其相关诊断试剂和疫苗的研制提供参考。
4 结论
本试验成功扩增铜绿假单胞菌1 340 bp的oprD基因片段,成功表达了65 kD的OPRD重组蛋白。探索出该蛋白的最佳表达条件为诱导前工程菌培养5 h、IPTG终浓度0.7 mmol/L、诱导时间4.5 h。经镍柱蛋白纯化试剂盒获得了纯度较高的OPRD重组蛋白。

