苦参碱介导上皮间质转化逆转肺癌A549顺铂耐药株活性研究*
吴军,莫绍雄,韦懿桐,冯志强,梁俐
(1.广西中医药大学第一附属医院胸心血管外科,南宁 530023;2.广西医科大学第二附属医院肿瘤内科,南宁 530021)
肺癌是人类最常见的恶性肿瘤,以顺铂(cisplatin,DDP)为代表的铂类是肺癌化学治疗(化疗)最主要的药物之一。然而部分患者对顺铂耐药是肺癌化疗失败的主要原因。因此,寻求解决肿瘤化疗耐药的有效途径,是目前肿瘤治疗研究领域的热点之一。苦参碱(matrine,MT)是豆科属植物苦参的主要有效成分,能促进肿瘤细胞凋亡、抑制肿瘤细胞增殖和侵袭转移[1]。研究显示MT具有肿瘤多药耐药逆转作用[2],然而MT逆转肿瘤细胞多药耐药的作用机制目前仍未完全阐明。研究发现肿瘤细胞发生上皮间质转化(epithelial-mesenchymal transition,EMT)在肿瘤细胞耐药过程中起到非常关键作用,是肿瘤耐药的一个新的重要机制[3]。本课题组已证实MT可以抑制肿瘤细胞 EMT[4]。然而,MT逆转肺癌的耐药性是否与其抑制肺癌细胞 EMT 相关,笔者目前尚未见相关报道。本研究旨在探讨MT能否逆转对DDP耐药的肺癌A549/DDP细胞的耐药性,以及是否通过抑制肺癌细胞EMT发挥作用,以期为肺癌治疗提供新的理论依据。
1 材料与方法
1.1主要试剂 苦参碱(成都普思生物科技有限公司,批号:PS000536,含量≥98%);1640 培养基(美国 Gibco 公司,批号:31800-014);胎牛血清(美国 Hyclone公司,批号:SH30084.03);胰蛋白酶(上海碧云天公司,批号:C0203);细胞凋亡检测试剂盒(万类生物公司,批号:WLa001);全蛋白提取试剂盒(万类生物公司,批号:WLA019);BCA 蛋白浓度测定试剂盒(万类生物公司,批号:WLA004);十二烷基硫酸钠-聚丙烯酰胺凝胶电泳 (sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)蛋白上样缓冲液(万类生物公司,批号:WLA005);p-65 抗体、p-p65抗体、Slug 抗体、β-actin 抗体(万类生物公司,批号:WL01273b,WL02169,WL01508,WL01372);噻唑蓝(MTT,美国凯基公司,批号:KGA311);Transwell 小室(美国 Corning 公司,批号:3422);Cy3 标记山羊抗兔 IgG(上海碧云天公司,批号:A0516);FITC 标记山羊抗小鼠 IgG(上海碧云天公司,批号:A0568);E-钙粘蛋白(E-cadherin)、波形蛋白(vimentin)(英国 abcam 公司,批号:Ab1416,Ab92547)。
1.2主要仪器 倒置显微镜(厦门麦克奥迪公司,型号:AE31);荧光显微镜(日本OLUMPUS公司,型号:DP73);流式细胞仪(美国艾森生物公司,型号:NovoCyte);全自动酶标仪(美国 BIOTEK 公司,型号:ELX-800);电热恒温培养箱(天津泰斯特公司,型号:DH36001B);凝胶成像系统(北京六一公司,型号:WD-9413B);双垂直蛋白电泳仪(北京六一公司,型号:DYCZ-24DN);电泳仪(北京六一公司,型号:DYY-7C);转移槽(北京六一公司,型号:DYCZ-40D);超速冷冻离心机(湖南湘仪公司,型号:H-2050R)。
1.3细胞培养及分组人肺腺癌耐顺铂细胞株 A549/DDP(中南大学细胞库),A549/DDP细胞培养于含10%胎牛血清的细胞培养液中,于37 ℃、5%二氧化碳(CO2)恒温培养箱中培养。当细胞生长至 70%时进行传代。取对数生长期A549/DDP细胞,分为对照组、MT组、DDP组、MT+DDP组。对照组不做处理,MT组加入16 μmol·L-1MT,DDP组加入3×10-3μmol·L-1DDP,MT+DDP 组加入16 μmol·L-1MT及3×10-3μmol·L-1DDP,诱导 24 h 后用于后续实验。
1.4MTT 法检测细胞活性 将处于对数生长期的 A549/DDP 细胞接种至 96孔培养板中,每孔约5×10-3个细胞,分为空白对照组、MT 组。空白对照组不做处理,MT 组分别加入1,4,16,32 μmol·L-1不同浓度 MT,于 5%CO2、37 ℃条件下培养。培养24 h后,去除培养基,细胞加入 MTT 50 μL,置于37 ℃培养箱中孵育 4 h,去除上清液,加入二甲亚砜(DMSO)150 μL,以溶解细胞形成的紫色结晶,在酶标仪上测定其在570 nm处吸光度(A)值,进行数据分析。细胞抑制率(%)=(1-实验组A值/对照组A值)×100%。
1.5细胞免疫荧光观察EMT 标志物E-cadherin及vimentin 表达变化 取对数生长期的A549/DDP细胞,分为空白对照组及MT组。空白对照组不做处理,MT组加入16 μmol·L-1的MT干预 24 h。细胞爬片后固定于4%多聚甲醛15 min,磷酸盐缓冲液(PBS) 冲洗,滴加0.1% tritonX-100 至完全覆盖细胞室温孵育30 min,PBS冲洗,山羊血清孵育15 min后一抗孵育20 h,PBS冲洗,荧光二抗孵育60 min后 PBS 冲洗,滴加4',6-二脒基-2-苯基吲哚(DAPI)以复染核,PBS 冲洗,滴加抗荧光淬灭剂于载玻片上,将爬片倒扣在滴有抗荧光淬灭剂的载玻片上封片,于荧光显微镜下观察染色结果。
1.6倒置显微镜观察MT 干预A549/DDP 前后的细胞形态变化 取对数生长期A549/DDP 细胞,分为空白对照组及 MT 组。空白对照组不做处理,MT 组加入16 μmol·L-1的 MT 干预 24 h。倒置显微镜下观察各组细胞的形态变化并摄像。
1.7Transwell小室检测MT干预A549/DDP前后的细胞侵袭能力变化 取对数生长期的 A549/DDP 细胞,分组同“1.6”项。取稀释好Matrigel 基质胶加入预冷的Transwell 小室中,37 ℃孵育 2 h,使其凝固。取各组细胞制成悬液,调整细胞密度后在 Transwell 小室上室加入用含0.1%胎牛血清的 DMEM 高糖培养液稀释的细胞悬液,下室加入含 20%胎牛血清的 DMEM 高糖完全培养基。稀释好的Matrigel 基质胶在小室中间,肿瘤细胞在含低营养液的上室,为了获得更多营养,肿瘤细胞会穿过 Matrigel 基质胶进入含高营养液的下室。37 ℃继续培养 24 h 后,以穿入下室的细胞为侵袭细胞。甲醇固定,0.1%结晶紫室温下染色,在倒置显微镜摄像,计数移至微孔膜下层的细胞,每张膜随机选取 5 个视野,每个视野细胞计数 3 次,求平均值,具体方法同文献[5]。
1.8Western blotting检测EMT表型相关标记物蛋白表达变化 取对数生长期的 A549/DDP 细胞,分为空白对照组、MT 组、DDP 组、MT+DDP 组。空白对照组不做处理,MT 组加入16 μmol·L-1MT,DDP 组加入3×10-3μmol·L-1DDP,MT+DDP 组加入16 μmol·L-1MT及3×10-3μmol·L-1DDP,诱导 24 h 后用 Western blotting法进行蛋白检测。裂解细胞,4 ℃离心,取上清液,收集蛋白样品。用 BCA 蛋白定量试剂盒定量后,每孔加入总蛋白 35 μg进行SDS-PAGE。在 12% SDS-PAGE上分离后转至聚偏氟乙烯(Polyvinylidene fluoride,PVDF) 膜,5% 脱脂牛奶孵育 2 h,加E-cadherin(1:1000)、vimentin(1:1000),Slug(1:500)、p-p65(1:500)、p65 (1:500)及β-actin(1:1000)一抗 4 ℃ 过夜,洗膜后加荧光二抗(1:5000 稀释)室温孵育 2h,洗膜 3 次后,与电致化学发光(electrochemiluminescence,ECL) 底物加强蛋白反应,将胶片进行扫描,用凝胶图像处理系统(Gel-Pro-Analyzer 软件)分析目标条带的吸光度(A)值。
1.9流式细胞仪检测细胞凋亡 取对数生长期的 A549/DDP 细胞,分组同 “1.8”。将细胞离心后收集,去除上清液,用PBS洗涤细胞,离心5 min 收集细胞,去除上清液,缓冲液500 μL重悬细胞。加入Annexin V-FITC 5 μL混匀后,加入碘化丙啶(propidium iodide,PI)10 μL,混匀。室温避光孵育15 min 后进行流式检测。真正意义上凋亡细胞应该是AnnexinV 表达,PI不表达,即图片中右下象限这个数据,这是早期凋亡,也是真正的凋亡;但实际情况中,通常把 AnnexinV 表达,PI 表达这一区域(即图中右上象限这个数据)也计算进去,此部分属于晚期凋亡,细胞膜已经开始破裂。因此,检测数据图中右上象限及右下象限细胞率总和来计算凋亡率。
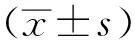
2 结果
2.1MT对A549/DDP 细胞增殖的抑制作用 MTT 实验结果见图 1。MT 能明显抑制 A549/DDP 细胞的增殖。与空白对照组比较,在 MT 作用于 A549/DDP 细胞24 h 后,MT 可呈浓度依赖性明显抑制肺癌 A549/DDP 细胞生长。在 1,4,16,32 μmol·L-1MT 浓度,随着 MT 浓度升高,细胞生长抑制率依次增高,呈浓度依赖性(P<0.05);而 32 μmol·L-1MT 的细胞生长抑制率与 16 μmol·L-1MT相比差异无统计学意义(P>0.05)。
①与空白对照组比较,P<0.05。
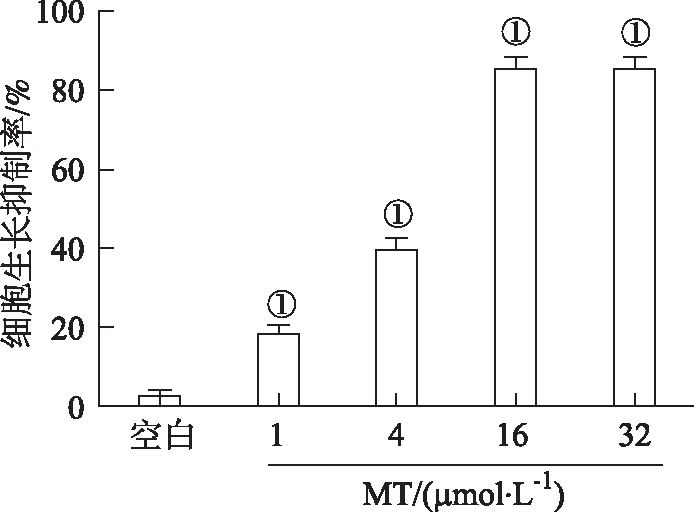
2.2MT对A549/DDP细胞形态及细胞侵袭能力的影响 结果见图2。空白对照组A549/DDP细胞形态呈长梭形、细胞松散、有丝状伪足的间质样细胞形态。MT干预处理后,A549/DDP细胞形态呈现卵圆形、排列紧密、丝状伪足消失的上皮样细胞形态。Transwell 小室实验显示,经 MT 作用后显微镜下每个视野细胞侵袭数目为(33±9),与空白对照组(55±19)比较,A549/DDP 细胞侵袭能力下降,差异有统计学意义(F=1.257,P<0.05)。
A.空白对照组;B.MT 组。
2.3MT对A549/DDP细胞EMT相关表型标记物的影响 细胞免疫荧光显微镜下观察MT对A549/DDP细胞EMT上皮表型标记物E-cadherin及间质表型标记物vimentin 的影响,结果见图3。空白对照组A549/DDP细胞免疫荧光 E-cadherin(绿色荧光)减弱,vimentin(红色荧光)增强,呈现EMT 表型。经MT作用24 h 后,E-cadherin增强,vimentin 减弱,抑制 EMT 相关表型。

A.E-cadherin;B.Vimentin;C.DAPI;D.Merge.
2.4MT与DDP联合作用对A549/DDP细胞E-cadherin、Vimentin、锌指转录因子Slug、NF-κB p-p65蛋白表达的影响 Western blotting实验结果见图 4。与空白对照组比较,MT组和MT+DDP组中E-cadherin蛋白表达明显升高,而Vimentin、Slug及p-p65蛋白表达明显降低,差异有统计学意义(P<0.05)。与MT组比较,MT+DDP组中E-cadherin蛋白表达明显升高,而vimentin、Slug及p-p65蛋白表达明显降低,差异有统计学意义(P<0.05)。而DDP组与空白对照组比较,E-cadherin、vimentin、Slug及p-p65蛋白表达差异无统计学意义(P>0.05)。

A.空白对照组;B.DDP 组;C.MT 组;D.MT+DDP 组;①与空白对照组比较,P<0.05;②与MT组比较,P<0.05。
2.5MT与DDP联合作用对A549/DDP细胞凋亡的影响 结果见图 5。流式细胞实验显示,与空白对照组比较,MT 单独作用于A549/DDP 24 h后诱导细胞凋亡,凋亡率明显升高(F=3.77,P<0.05)。与空白对照组比较,MT联合DDP作用于 A549/DDP细胞24 h后,凋亡率明显升高(F=7.664,P<0.05)。与MT组比较,MT+DDP组细胞凋亡率升高,差异有统计学意义(F=0.398,P<0.05)。而DDP组与空白对照组比较,细胞凋亡率差异无统计学意义(P>0.05)。
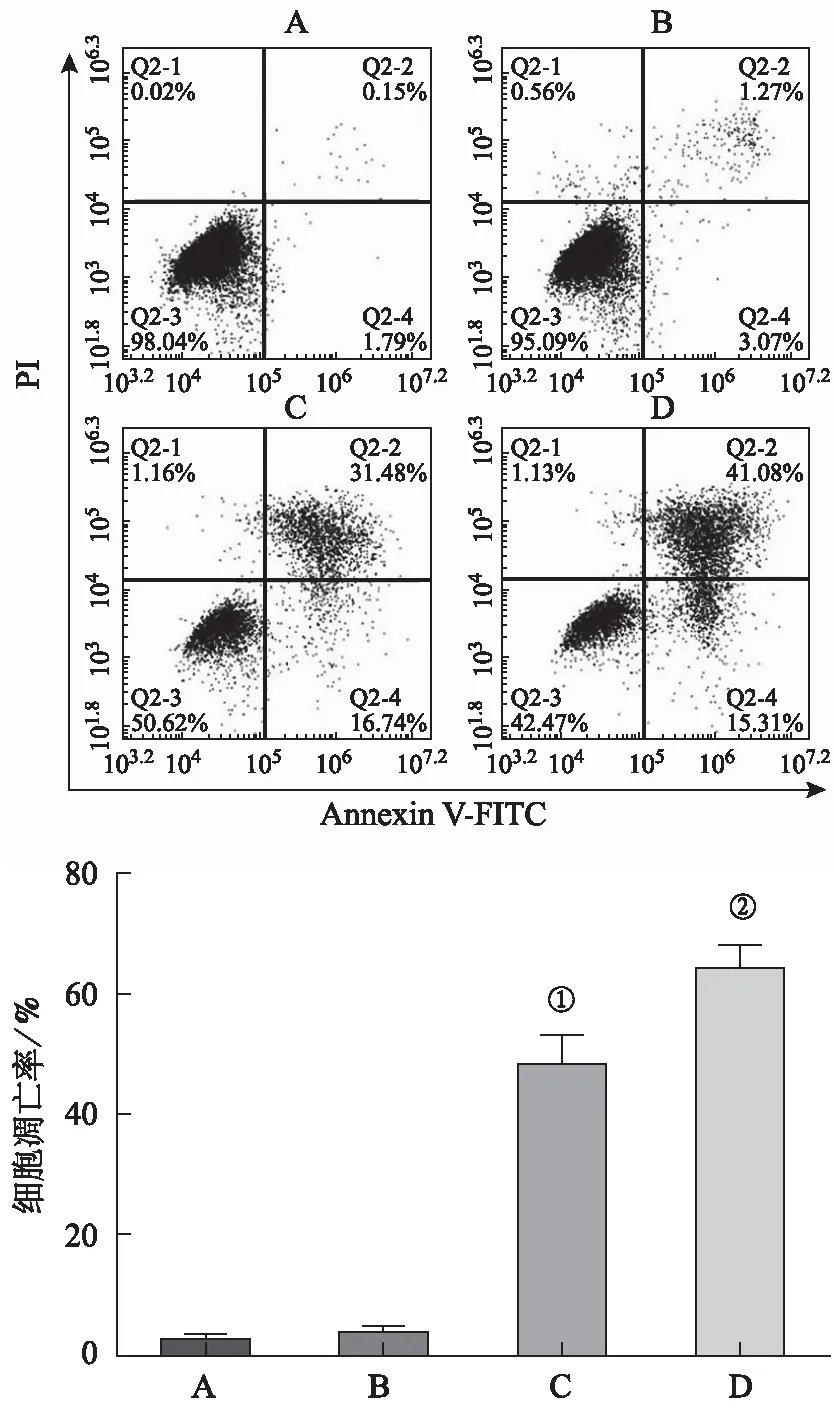
A.空白对照组;B.DDP 组;C.MT 组;D.MT+DDP组;①与空白对照组比较,P<0.05;②与MT组比较,P<0.05。
3 讨论
肺癌是全球发病率及病死率最高的恶性肿瘤,手术及化疗是临床治疗肺癌的主要手段,而肿瘤多药耐药(multidrug resistance,MDR)是化疗失败的主要原因。因此,低毒有效的耐药逆转剂具有重要临床意义。MT是一种传统中药苦参提取物,可促进肿瘤细胞凋亡、抑制肿瘤细胞增殖和侵袭转移[6-7]。研究证实 MT 是有效的MDR逆转剂,然而其作用机制目前仍未完全阐明。目前有关MT 对肺癌A549/DDP耐药性的影响,笔者尚未见报道。本研究旨在探讨 MT 逆转A549/DDP细胞耐药性的作用及其可能机制。
笔者先前研究结果发现苦参碱可以抑制结肠癌细胞上皮间质转化[4],最近REN等[8]在乳腺癌细胞研究中也得到证实。EMT是指上皮细胞失去极性及基膜连接等上皮表型转化成具有间质表型的生物学过程。EMT发生后,排列紧密的上皮细胞失去极性,变成长梭形、排列分散的间质细胞。上皮表型标志物E-钙粘蛋白表达下调,而间质表型标志物N-cadherin、vimentin及转录因子slug、twist等表达上调[9]。肿瘤细胞在获得性耐药过程中产生间质化的特征,而本身具有间质化特征的肿瘤细胞也常具有原发性耐药特征。在耐药肿瘤细胞中可观察到EMT 现象[10]。因此,对于化疗耐药的肺癌患者,EMT可能成为一种新的标记物和有效的治疗靶点。
本实验发现MT可呈浓度依赖性提高细胞增殖抑制率,证实MT可逆转A549/DDP细胞的耐药性。MT抑制细胞侵袭能力,并上调A549/DDP细胞上皮细胞表型标志物E-cadherin蛋白表达,及下调间质表型标志物vimentin和slug表达,这表明MT可逆转A549/DDP细胞的EMT。进一步研究发现,MT单药或与DDP联用可明显提高A549/DDP细胞凋亡率,证明MT
可逆转A549/DDP耐药性且协同增强DDP的化疗敏感性。哺乳动物的NF-κB信号通路是由 p65、p50/p105、p52/p100、c-Rel 及 RelB 5个成员组成的蛋白家族。NF-κB在静息状态下以非活化的二聚体形式(主要为p65/p50)与抑制蛋白-κB(inhibitor protein-κB,IκB)结合于胞质中。当受到细胞外信号刺激时,IκB 被 Iκκ复合体磷酸化、泛素化,最后迅速降解,使 NF-κB二聚体中的 p65 亚基释放并进入胞核磷酸化,从而发挥各种生物学功能[11-12]。因此,p65是否磷酸化是NF-κB信号通路是否活化的关键分子。激活NF-κB信号通路对于调节细胞增殖、分化、存活、迁移、侵袭和EMT过程非常重要[13]。该信号通路参与转化生长因子β诱导的 EMT和癌细胞的化疗抵抗[14]。目前研究中,笔者还发现 MT显著抑制p-p65蛋白表达,逆转A549/DDP细胞对 DDP的抵抗。通过本研究,不仅有助于进一步理解肺癌细胞对DDP耐药的分子机制,而且为临床提高DDP耐药的肺癌患者疗效,提供新的治疗策略和理论依据。
综上所述,MT可以抑制肺癌耐顺铂细胞株A549/DDP的活性,其机制可能与抑制 EMT 及抑制NF-κB信号通路相关。但是,MT是否与其他EMT相关蛋白或耐药相关分子之间存在直接的相互作用,还有待进一步研究。

