Pax-8在腹膜恶性间皮瘤及高分化乳头状间皮瘤中异常表达的免疫组织化学分析
李杜娟,康红 ,董新敏,黄珊珊,连立飞*
(1河南省人民医院病理科,郑州450003;2华中科技大学同济医学院附属同济医院神经内科,武汉430030)
卵巢浆液性肿瘤(ovarian serous tumors, OST),尤其浆液性癌及交界性浆液性肿瘤,常广泛累及腹膜,临床表现与腹膜恶性间皮瘤(malignant peritoneal mesothelioma, MPM)及腹膜高分化乳头状间皮瘤(well-differentiated papillary mesothelioma, WDPM)非常相似。在组织形态学上,浆液性癌及交界性浆液性肿瘤与MPM组织结构及细胞形态具有较大的重叠交叉,浆液性囊腺瘤与交界性浆液性肿瘤与腹膜WDPM组织学也不易鉴别。这些肿瘤的准确诊断对临床治疗及患者预后尤为重要。因此,免疫组织化学成为OST与MPM、WDPM鉴别诊断必不可少的辅助手段。常用的间皮标记如钙视网膜蛋白(calretinin,CR)、Wilm’ s 瘤基因-1(Wilm’s tumour gene-1, WT-1)、细胞角蛋白5/6(cytokeratin5/6, CK5/6)和D2-40等特异性差,在浆液性肿瘤中也有较高的表达,不易于OST与MPM、WDPM的鉴别。既往普遍认为配对盒基因8抗原(paired box gene 8, Pax-8)是OST的高度敏感和特异性标记,可在90%~100%的OST中呈弥漫强阳性表达,仅偶尔在间皮肿瘤中呈灶性弱阳性表达[1-3],成为OST与MPM及WDPM鉴别中最重要的标记之一。然而我们在日常病理诊断及会诊中,发现Pax-8在间皮肿瘤中表达并不少见,且部分呈弥漫强阳性表达,单纯依靠Pax-8鉴别上述肿瘤很容易产生误诊。目前国内尚未见关于间皮肿瘤中Pax-8异常表达的研究报道。本文检测Pax-8在MPM、WDPM及其他良性间皮病变中的表达,并总结相应临床特点,旨在探讨Pax-8用于MPM、WDPM与OST鉴别的诊断价值。
材料与方法
1 临床资料
收集河南省人民医院病理科2013年1月至2021年1月诊断为MPM病例32例,WDPM 12例,良性多囊性间皮瘤6例,腺瘤样瘤15例,反应性间皮12例。收集所有患者临床及病理资料。所有患者均签署诊治知情同意书。其中MPM及WDPM病例的临床资料如下:32例MPM中女性26例,男性6例,中位年龄56岁(33岁~74岁);多以腹胀(24例)、腹痛(7例)、腹部肿物(4例)、肠梗阻(2例),伴食欲不振、呕吐及发热就诊;30例出现腹水,均为血性腹水;影像学显示30例腹膜和(或)大网膜呈不同程度弥漫性增厚伴大小不等结节,2例为局限型肿块伴腹膜增厚及结节;17例血清CA-125升高,临床诊断考虑卵巢癌伴腹膜转移;7例有石棉接触史。12例WDPM中女性10例,男性2例,中位年龄41岁(14岁~66岁);8例手术或腹腔镜检查时偶然发现,其中6例为妇科恶性肿瘤(卵巢浆液性癌、子宫内膜癌及宫颈癌)发现,2例为胃癌及大肠癌发现。
2 方法
所用标本经4%中性甲醛固定、脱水、石蜡包埋、切片(4µm)后,行HE染色和EnVision两步法免疫组织化学染色。免疫组织化学染色采用罗氏BenchMark XT全自动免疫组织化学检测仪进行,抗Pax-8、MOC-31、Ber-Ep4抗体购于迈新公司,雌激素受体(estrogen receptor, ER)和孕激素受体(progesterone receptor, PR)抗体购于DAKO公司,所有抗体均为小鼠抗人单克隆抗体。每一种免疫组织化学染色均以已知阳性表达的组织作为阳性对照,以已知不表达的组织作为阴性对照,用PBS代替一抗作为空白对照。所有病例均经3位高年资病理诊断医师重新阅片确诊。
3 结果判定
Pax-8阳性表达定位于细胞核,其阳性细胞数量及阳性表达强度采用半定量评估。阳性细胞数量分为阴性、局灶阳性及弥漫阳性3个等级,评判标准为:肿瘤细胞核完全无染色为阴性,1%至50%肿瘤细胞核染色为局灶阳性,大于50%肿瘤细胞核染色为弥漫阳性。阳性表达强度分为弱阳性、中等强度阳性及强阳性3个等级,评判标准为:染色强度淡黄色为弱阳性,棕黄色为中等强度阳性,棕褐色为强阳性。
4 统计学分析
采用GraphPad Prism 5.0软件进行统计学分析,分类变量的比较用χ2及Fisher精确检验,以P<0.05为差异有统计学意义。
结 果
1 腹膜恶性间皮瘤及腹膜高分化乳头状间皮瘤呈似浆液性肿瘤的组织病理学
32例MPM中29例(90.6%,29/32)为上皮样型,由管状乳头状和实性结构排列的上皮样细胞组成,细胞呈立方或多边形,胞质丰富嗜酸性,核空泡状,核仁明显,核分裂像易见(图1A1),坏死常见,4例瘤组织内见砂粒体;3例MPM(9.4%,3/32)呈上皮样和肉瘤样特征,为双相型间皮瘤,上皮样细胞同上皮样型,肉瘤样细胞呈梭形、多边形,胞质嗜酸性,核空泡状,核仁明显,核分裂像易见。其中,上皮样型MPM占绝大多数,组织病理学形态与高级别浆液性癌极其类似。12例WDPM具有典型乳头状结构,被覆单层扁平、立方上皮样细胞(图1B1),3病例局灶呈管状乳头状、腺瘤样或实性生长,细胞具有轻度异型,核分裂像罕见,坏死未见。其组织学形态与浆液性囊腺瘤和交界性浆液性肿瘤类似,常规病理鉴别困难。
2 部分腹膜恶性间皮瘤及腹膜高分化乳头状间皮瘤呈弥漫性中至强阳性表达Pax-8
5例MPM(15.6%,5/32)表达Pax-8,其中3例呈弥漫中至强阳性(图1A2,表1),2例呈局灶弱至中度阳性。7例WDPM(58.3%,7/12)表达Pax-8,其中5例呈弥漫中至强阳性(图1B2,表1),2例呈局灶弱至中度阳性。1例良性多囊性间皮瘤(16.7%,1/6)表达Pax-8,呈局灶弱至中度阳性(图1C2,表1)。15例腺瘤样瘤均不表达Pax-8。6例反应性间皮(50%,6/12)表达Pax-8,其中3例呈弥漫中至强阳性,3例呈局灶弱至中度阳性(图1D2,表1)。Pax-8在少数MPM呈弥漫中至强阳性表达,在WDPM中的阳性表达率显著高于MPM(P=0.03),因此,依靠Pax-8阳性而与浆液性癌、浆液性囊腺瘤或交界性浆液性肿瘤鉴别时需谨慎。
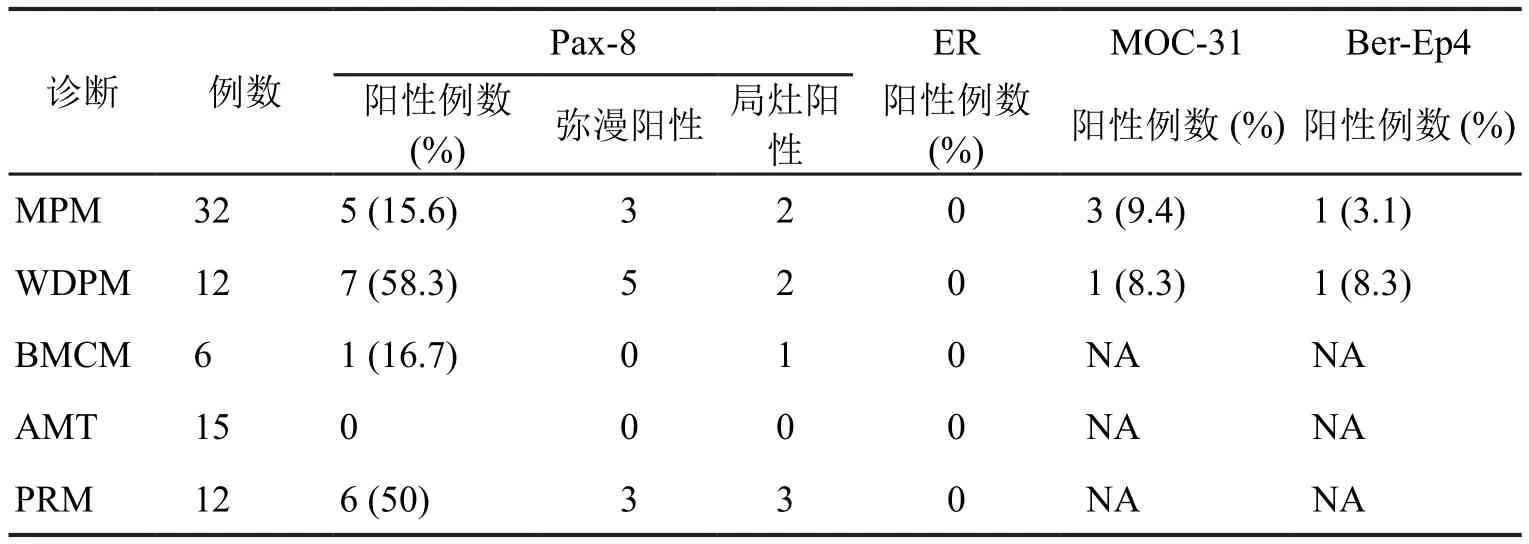
表1 腹膜上皮样型恶性间皮瘤、高分化乳头状间皮瘤、良性多囊性间皮瘤、腺瘤样瘤与反应性间皮中Pax-8、ER、MOC-31及Ber-Ep4免疫组织化学表达比较Tab.1 Comparison of the expression of Pax-8, ER, MOC-31 and Ber-Ep4 in malignant peritoneal epithelioid mesothelioma,peritoneal well-differentiated papillary mesothelioma, peritoneal benign multicystic mesothelioma, adenomatoid tumor and peritoneal reactive mesothelium
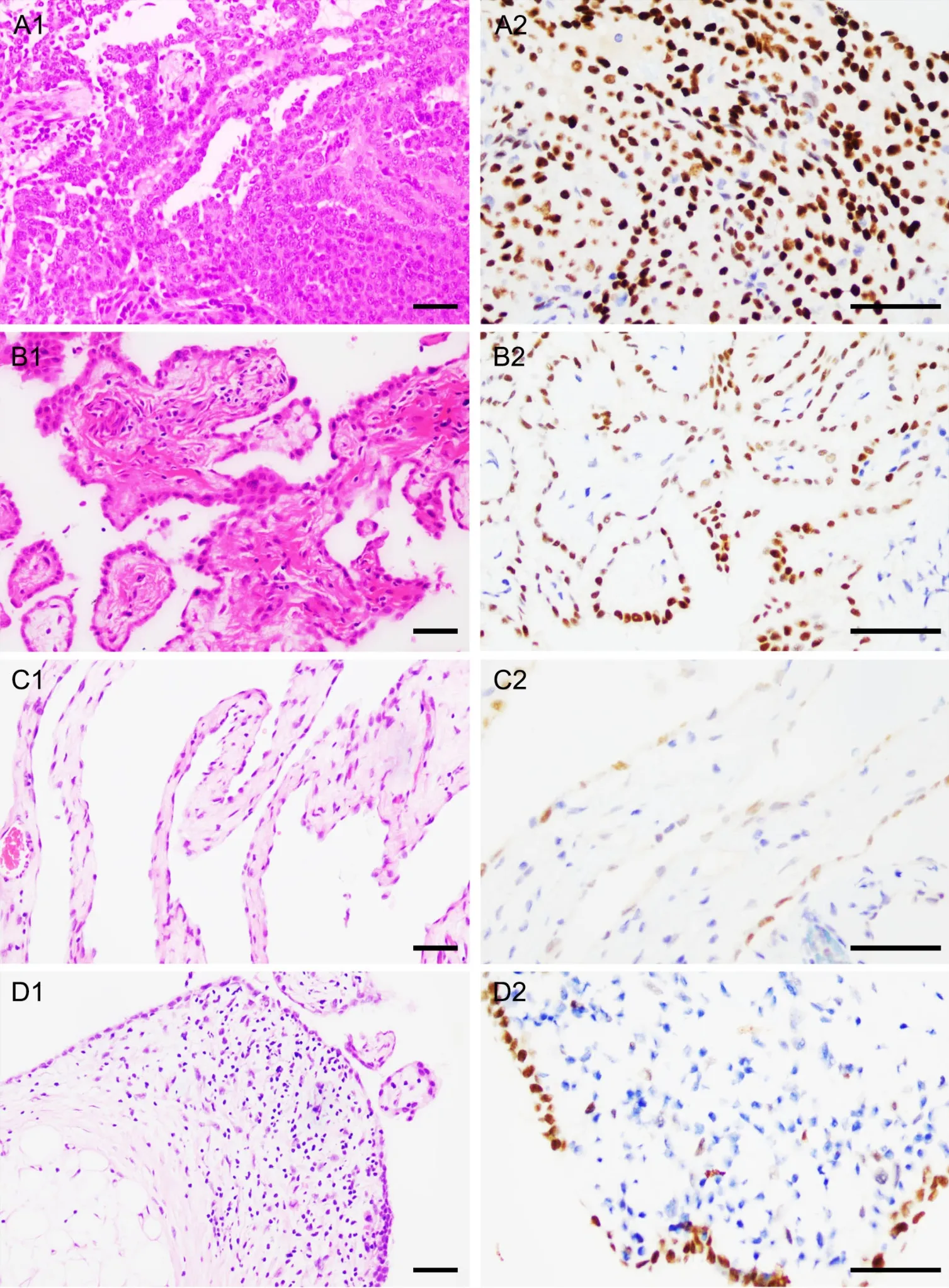
图1 腹膜上皮样型恶性间皮瘤、高分化乳头状间皮瘤、良性多囊性间皮瘤与反应性间皮组织病理学(A1,B1,C1,D1,HE染色)与Pax-8表达(A2,B2,C2,D2,EnVision两步法免疫组织化学染色)比较。A1,上皮样型恶性间皮瘤,立方、多边形上皮样细胞呈管状乳头状和实性排列,细胞异型明显;B1,高分化乳头状间皮瘤,被覆单层扁平、立方细胞的乳头状结构,细胞轻度异型;C1,良性多囊性间皮瘤,疏松纤维囊壁衬覆单层扁平细胞,细胞无异型;D1,反应性间皮,扁平间皮细胞细胞排列密集。A2,上皮样型恶性间皮瘤肿瘤细胞核弥漫强表达Pax-8;B2,腹膜高分化乳头状间皮瘤肿瘤细胞核弥漫强表达Pax-8;C2,良性多囊性间皮瘤中局灶肿瘤细胞核弱—中等强度表达Pax-8;D2,反应性间皮组织中间皮细胞核弥漫强表达Pax-8。比例尺,50μmFig. 1 Histopathological characteristics (A1, B1, C1, D1, HE staining) and Pax-8 expression (A2, B2, C2, D2, EnVision immunohistochemical staining)of malignant peritoneal epithelioid mesothelioma, peritoneal well-differentiated papillary mesothelioma, peritoneal benign multicystic mesothelioma and peritoneal reactive mesothelium. A1, cuboidal and polygonal epithelioid cells arranged in tubulopapillary and solid patterns with obvious cell atypia in the malignant peritoneal epithelioid mesothelioma; B1, papillary architecture with a single layer of flat or cuboidal cells with mild cell atypia in the peritoneal well-differentiated papillary mesothelioma; C1, loose fibrous capsule wall lined with a layer of flat cells without cell atypia in the peritoneal benign multicystic mesothelioma; D1, flat mesothelial cells lined densely in the peritoneal reactive mesothelium. A2 and B2, tumor cells exhibited diffuse and strong nuclear Pax-8 expression in the malignant peritoneal epithelioid mesothelioma (A2) and peritoneal well-differentiated papillary mesothelioma (B2); C2, tumor cells exhibited focal and weak to moderate nuclear Pax-8 expression in the peritoneal benign multicystic mesothelioma; D2,peritoneal reactive mesothelial cells exhibited diffuse and strong nuclear Pax-8 expression. Scale bar, 50μm
3 表达Pax-8的MPM及部分WDPM可同时表达其他腺上皮标记
Pax-8阳性的MPM及WDPM,均女性明显多于男性(男女比分别为1:4及1:6),其中弥漫表达的病例均为女性。80%的Pax-8阳性MPM(4/5)为腹膜弥漫型肿块且伴血清CA-125升高,57.1% 的Pax-8阳性WDPM伴发于妇科恶性肿瘤(3例卵巢浆液性癌、1例子宫内膜癌)。此外,80% Pax-8阳性的MPM(4/5)及28.6% Pax-8阳性的WDPM(2/7)可同时局灶表达腺上皮标记MOC-31或Ber-Ep4,但所有病例ER、PR均为阴性。
讨 论
恶性间皮瘤约90%发生于胸膜,约10%发生于腹膜(MPM)。MPM临床上相对少见,且缺乏特异的临床表现。卵巢浆液性肿瘤常广泛累及腹膜,临床上常与MPM不易鉴别。本组32例MPM影像学均显示腹膜、大网膜增厚伴大小不等结节,17例(53.1%)血清CA-125升高,临床考虑卵巢癌伴腹膜转移。MPM组织形态学分为上皮样型、肉瘤样型及双相型,其中上皮样型约占90%。正如本组29例上皮样型MPM结果显示,由管状乳头状和实性结构排列的上皮样细胞组成,细胞异型性明显,常呈立方或多边形,核空泡状、多形性,核仁明显,核分裂像易见,常伴砂粒体。上皮样型MPM组织结构及细胞形态与伴腹膜广泛转移的高级别浆液性癌极其相似。因此,MPM与浆液性癌的鉴别困难,纵使有临床及影像学资料等情况下,尤其对于小活检及细胞学样本,其正确诊断必须借助免疫组织化学进行鉴别。
恶性间皮瘤与癌鉴别相关免疫组织化学标记的研究,大多集中于胸膜恶性间皮瘤与肺腺癌的鉴别,而MPM与卵巢或腹膜浆液性癌鉴别的研究较少。Pax-8被认为是浆液性肿瘤高度敏感和特异性的标记,灵敏性达90%~100%,通常呈弥漫强阳性[1-3];既往文献报道Pax-8仅局灶或弱阳性表达于MPM,因此,可与呈弥漫强阳性的浆液性癌进行鉴别[1-2]。然而,本研究显示,15.6%的MPM可表达Pax-8,9.4%呈弥漫表达,且弥漫表达的病例均为女性,表明Pax-8在MPM中表达并不少见,且弥漫表达也不罕见,尤其女性患者,极易误诊为浆液性癌。这与Chapel DB等报道结果一致[4]。事实上,所有Pax-8阳性表达的MPM、WDPM及良性间皮病例中,女性占84.2%,在与浆液性肿瘤的鉴别诊断中,一定要提高警惕,避免误诊。此外,本研究显示9.4%及3.1%的MPM,除了表达Pax-8,同时也表达其它腺上皮标记MOC-31或Ber-Ep4,但均不表达ER及PR,因浆液性肿瘤PR敏感性相对低,ER敏感性高,因此,ER可作为MPM与浆液性肿瘤鉴别特异可靠的标记[5]。
除了Pax-8在MPM中表达,常用的间皮标记在浆液性癌中也有表达,这进一步加大了二者鉴别的难度。众所周知,WT-1在浆液性肿瘤中广泛表达,CK5/6在大多数浆液性癌中表达[6-7]。间皮特异标记D2-40及CR在13%-58%及31%浆液性癌中表达[8]。HBME-1在少数浆液性肿瘤中也可表达[9]。有报道显示claudin-4是浆液性癌的敏感和特异的新标记[1]。由此可见,MPM和浆液性肿瘤免疫组织化学标记具有较大的交叉,因此,二者鉴别时,建议多个标记联合使用,以降低误诊的风险。
WDPM主要发生于腹膜,也可发生于胸膜和睾丸旁区。WDPM患者绝大多数为育龄期妇女,呈惰性的临床过程。病变通常是多个,也可单个,灰白实性乳头状或结节状,常累及网膜和盆腹腔腹膜。本研究显示,WDPM大多为偶然发现,且在妇科、消化道肿瘤手术及临床分期评估时经常发现。镜下多呈典型的乳头状结构,被覆异型扁平、立方上皮样细胞,本组病例约25%的WDPM局部区域具有较复杂的结构,表现为具有轻度至中度异型的管状乳头状、腺瘤样或实性生长模式,组织学形态与交界性浆液性肿瘤及低级别浆液性癌,存在交叉重叠,且58.3%的病例Pax-8阳性表达,为鉴别诊断带来难度,尤其对于原发卵巢的浆液性肿瘤伴WDPM,易误诊为卵巢浆液性肿瘤伴腹膜播散,从而导致错误的临床分期。
与浆液性肿瘤的鉴别中,WDPM通常表达间皮标记如CR、D2-40、CK5/6及HBME-1,不表达Ber-EP4、MOC-31、ER和PR等浆液性上皮标记。本组12例WDPM均表达CR、WT-1、CK5/6、D2-40、HBME-1,各有1例局灶表达MOC-31或Ber-EP4,12例均不表达ER及PR,与文献报道结果相符合[10]。值得注意的是,本组58.3% WDPM表达Pax-8,且41.7%呈弥漫阳性表达。由此可见,对于WDPM与浆液性肿瘤的鉴别,Pax-8的可靠性欠佳,甚至会带来诊断的陷阱,而ER、PR有助于二者的鉴别。
关于间皮肿瘤及良性病变阳性表达Pax-8的研究较少,其临床病理特点及意义尚不清楚。总结本组Pax-8阳性间皮肿瘤及良性间皮病变的临床病理特点如下:①反应性间皮、良性多囊性间皮瘤、腺瘤样瘤、WDPM、MPM的良恶性间皮病变谱中,Pax-8阳性表达的检出率依次为50%、16.7%、0%、58.3%、15.6%,提示反应性间皮及WDPM中Pax-8的表达率最高,其次为良性多囊性间皮瘤及MPM;②所有Pax-8阳性病例中女性占绝大多数(84.2%,16/19),其中弥漫阳性表达的病例(11/19)均为女性;③Pax-8阳性MPM多呈腹膜弥漫型肿块,常伴血清CA-125升高,临床更易误诊为晚期卵巢癌伴腹膜播散;④ Pax-8阳性的MPM及WDPM病例中,同时表达腺上皮标记MOC-31、Ber-EP4也较为常见,但均未见ER、PR的表达。
本研究发现,盆腹腔反应性间皮、良性多囊性间皮瘤、WDPM及MPM均可出现Pax-8的阳性表达,且Pax-8阳性病例中女性占绝大多数。Pax-8作为一种转录因子,对盆腹腔苗勒管的发生发育具有重要的调控作用,也是苗勒管分化发育组织器官的特异性标记。本组病例显示80% Pax-8阳性的MPM及28.6% Pax-8阳性的WDPM同时表达其它苗勒管相关的腺上皮标记(如:MOC-31、Ber-EP4)。这些结果提示Pax-8在良恶性间皮病变中阳性表达与苗勒上皮关系密切。我们推测可能的机制:①腹膜间皮具有向苗勒管上皮分化的潜能,当腹膜受到增殖性或致瘤性刺激时,间皮细胞可向苗勒管上皮分化或化生,从而具有苗勒管上皮的免疫表型及特性。不同刺激及信号通路的激活可能导致在不同间皮病变中苗勒上皮Pax-8阳性表达的程度不同;②盆腔和下腹腔的间皮也有可能是由苗勒管分化而来,Pax-8阳性的间皮肿瘤可能是由苗勒管分化过程的间皮肿瘤性转化。有报道从输卵管伞端的苗勒上皮到卵巢表面及腹膜的间皮,正常情况下可检测到由苗勒上皮表型逐渐向间皮表型的转变,尤其卵巢表面的间皮可检测到Pax-8与CR免疫表型的共表达[11],该结果也支持上述推测。此外,57.1% Pax-8阳性的WDPM(4/7)伴发于恶性苗勒上皮肿瘤(3例卵巢浆液性癌、1例子宫内膜样癌),提示WDPM Pax-8阳性表达可能与苗勒管上皮肿瘤性转化相关。良恶性间皮病变中Pax-8阳性表达的机制有待进一步研究。
总之,本研究检测了MPM、WDPM、反应性间皮、良性多囊性间皮瘤等良恶性间皮病变谱系中Pax-8的表达,Pax-8在WDPM及反应性间皮中表达较常见,也可表达于MPM及良性多囊性间皮瘤,部分呈弥漫性表达。因此,Pax-8用于鉴别MPM、WDPM和浆液性肿瘤的价值有限,尤其对于WDPM与浆液性肿瘤的鉴别不可靠,需要联合使用多个标记,以降低误诊风险。

