血清Activin-A联合肺部超声评分对急性呼吸窘迫综合征严重程度及预后的评估价值
舒姣洁,张 妍,郭玉梅,刘国梁
(辽宁省大连市中心医院,辽宁 大连 116033)
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是一种非静水压性肺水肿,为临床常见危重症,尽管其诊断和治疗理念及呼吸策略不断更新,但仍未显著改善患者预后[1,2]。早期评估ARDS患者病情程度和预后,对尽早采取合适治疗措施,改善预后具有重要意义。研究表明,炎症反应失控与ARDS发生及发展密切相关[3]。C反应蛋白、白介素-6、降钙素原等炎症指标虽然能一定程度上评估ARDS病情,但影响因素较多,各队列研究结果不一致,有必要寻找其他有效指标。激活素-A(Activin-A)是一种细胞间信号传递分子,可根据细胞成熟、激活、空间环境发挥促炎或抗炎作用,已有研究报道ARDS患者血清Activin-A表达显著上调[4],但关于其对患者病情和预后的影响尚不明确。肺部通气功能丧失为ARDS早期病理改变之一[5]。目前急危重症中已广泛使用肺部超声,研究表明,肺部超声评分(lung ultrasound score,LUS)可评估肺部通气功能[6]。本研究旨在分析ARDS患者血清Activin-A和LUS变化,探讨其与病情严重程度和预后的关系,以期为ARDS救治提供参考。
1 资料与方法
1.1研究对象:选取我院2018年1月至2020年12月重症加强护理病房(intensive care unit,ICU)收治的160例ARDS患者为ARDS组,其中男113例,女47例;年龄30~78(55.80±10.45)岁;体质指数19~26(23.31±2.11)kg/m2;病史:29例高血压史,15例糖尿病史,7例冠心病史;病因:6例手术,11例肺挫伤,19例多发伤,35例重症肺炎,89例严重感染。纳入标准:①符合《急性肺损伤/急性呼吸窘迫综合征诊断和治疗指南(2006)》[7]诊断标准;②年龄18~80岁;③患者及家属均知情研究;④病历资料完整者;排除标准:①妊娠及哺乳期妇女;②自身免疫性疾病者;③血液系统疾病者;④恶性肿瘤者;⑤合并心源性肺水肿、慢性阻塞性肺疾病、肺结核等肺部疾病者。另选取同期60名体检健康者为对照组,其中男42例,女18例;年龄19~75(55.53±10.28)岁;体质指数18~26(23.17±2.06)kg/m2。两组性别、年龄、体质指数比较无差异(P>0.05),本研究经伦理委员会批准。
1.2方 法
1.2.1基础资料收集:收集患者基础资料,包括性别、年龄、体质指数[体重(kg)/身高(cm2)]、病史、病因、心率、呼吸频率、平均动脉压(mean arterial pressure,MAP)、呼气末正压(positive end-expiratory pressure,PEEP),丹麦雷度ABL80动脉血气分析仪测定动脉血氧分压、吸氧浓度、动脉血二氧化碳分压(partial pressure of carbon dioxide in artery,PaCO2)、计算氧合指数(oxygenation index,OI)=动脉血氧分压/吸氧浓度。
1.2.2血清Activin-A水平测定:采集患者入ICU后6h内和对照组体检时静脉血,3000r/min离心10min,半径8cm,取上清液,置于-80℃冰箱中保存,酶联免疫吸附法(上海广锐生物科技有限公司,货号:elisa2013-10050)测定血清Activin-A水平。
1.2.3肺部超声检查:ARDS患者入ICU后6h内和对照组体检时进行肺部超声评估,选择迈瑞DP-10便携式彩色多普勒超声诊断仪,使用相控阵凸面探头(频率3.5~10.0MHz),指导患者选择仰卧位,分别检查双侧前胸壁、后胸壁、侧胸壁的上、下部共12个肺区,见图1:1、2为前胸壁上、下部,3、4为侧胸壁上、下部,5、6为后胸壁上、下部。保存视频资料,进行LUS评估:2A为正常肺通气区(0分):肺滑动征伴A线或1个单独B线;2B为中度肺通气减少区(1分):多发、典型B线;2C为重度肺通气减少区(2分):多发融合B线;2D为肺实变区(3分):典型支气管充气征。由两名经过专门肺部超声影像训练的观察组进行评估,以一致意见为结果,选择各区域最严重表现进行评分,总分值为12个肺区评分之和(0~36分)。

图1 肺部超声检查的12个肺区
1.3病情和预后评估:患者入组后12h内根据2012年柏林标准[8]分为重度组(n=80,OI≤100mmHg)、中度组(n=52,OI>100~200mmHg)、轻度组(n=28,OI>200mmHg);根据患者28d后预后情况分为死亡组(n=40)和存活组(n=120)。
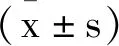
2 结 果
2.1ARDS组与对照组血清Activin-A水平和LUS比较:ARDS组血清Activin-A水平和LUS明显高于对照组(P<0.05)。见表1。
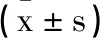
表1 ARDS组与对照组血清Activin-A水平和LUS比较
2.2不同病情严重程度患者血清Activin-A水平和LUS比较:度组血清Activin-A水平和LUS明显高于轻、中度组,中度组血清Activin-A水平和LUS明显高于轻度组(P<0.05)。见表2。
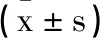
表2 不同病情严重程度患者血清Activin-A水平和LUS比较
2.3血清Activin-A水平和LUS与OI的相关性:Pearson相关性分析显示,血清Activin-A水平和LUS与OI呈负相关(r=-0.667、-0.608,P<0.001)。见图2。

图2 血清Activin-A水平和LUS与OI的线性散点
2.4ARDS预后不良影响因素的单因素分析:单因素分析显示,死亡组年龄、PEEP、Activin-A、LUS明显高于存活组,MAP、OI明显低于存活组(P<0.05),死亡组与存活组性别、体质指数、病史、病因、心率、呼吸频率、PaCO2比较无差异(P>0.05)。见表3。
2.5ARDS预后不良影响因素的多因素Logistics回归分析:以年龄、PEEP、MAP、OI、Activin-A、LUS为自变量,预后为因变量(死亡=1,存活=0),多因素Logistics回归分析显示,OI为ARDS预后不良独立保护因素,Activin-A、LUS为独立危险因素(P<0.05)。见表4。
2.6血清Activin-A联合LUS对ARDS患者预后不良的评估价值:ROC曲线显示,Activin-A和LUS分别为836.01pg/mL、16分时,预测ARDS患者预后不良的AUC为0.841(95%CI:0.775~0.894)、0.792(95%CI:0.721~0.852),敏感度、特异度、准确度为85.19%、72.64%、75.78%和64.81%、76.42%、73.52%。Activin-A+LUS预测ARDS患者预后不良的AUC为0.922(95%CI:0.869~0.958),明显大于Activin-A和LUS评估(Z=3.321、4.111,均P<0.001),敏感度、特异度、准确度为87.04%、89.62%、88.98%。见图3。

表3 ARDS预后不良影响因素的单因素分析
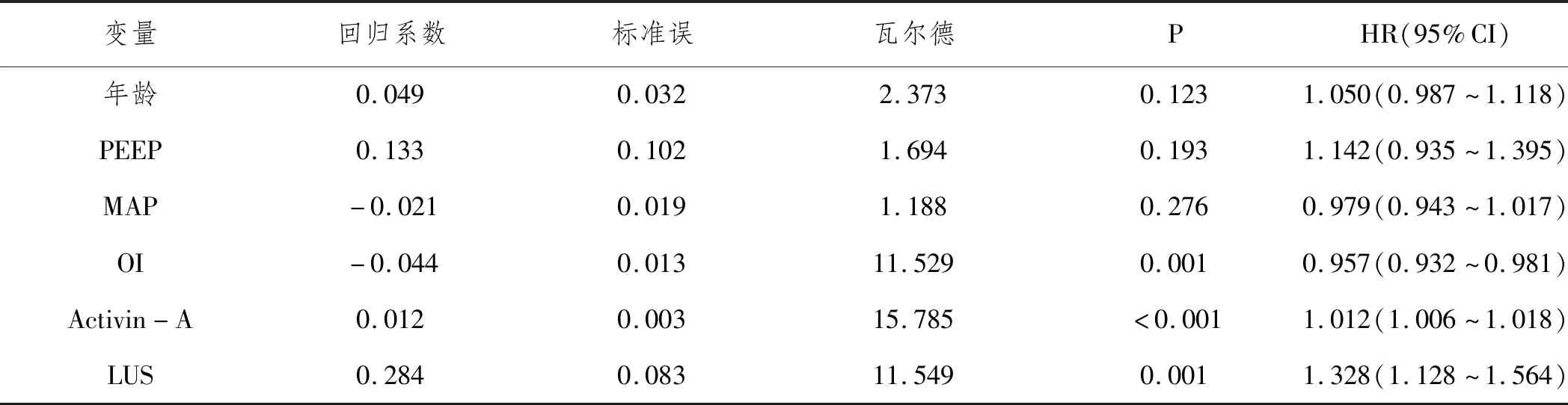
表4 ARDS预后不良影响因素的多因素Logistics回归分析
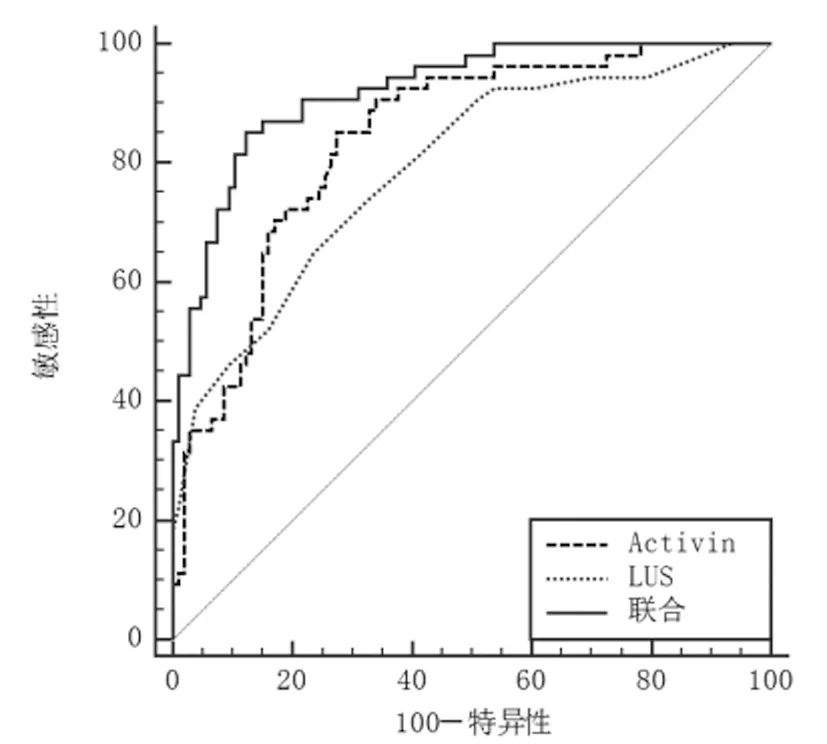
图3 血清Activin-A联合LUS评估ARDS患者预后不良的ROC曲线
3 讨 论
炎症反应失控和肺泡毛细血管屏障功能障碍为ARDS发病两大关键因素,各种致病因素引起的急性失控性炎症反应可直接侵袭肺组织引起肺水肿,同时还可通过增加血管内皮通透性,使各种富含蛋白、炎性细胞的水肿液进入肺泡腔和肺间质,引起肺损伤,最终导致呼吸衰竭[3]。Activin-A为转化生长因子-β超家族一员,可由多种细胞产生和分泌,具备广泛生物学活性,包括调节炎症、免疫等[4]。Apostolou等[9]用腺病毒诱导发现Activin-A过度表达引起小鼠持续急性肺损伤,最终引起ARDS。巨噬细胞在ARDS炎症进展中具有重要作用,也是机体产生Activin-A主要细胞之一,研究刺激腹腔巨噬细胞发现,肿瘤坏死因子-α、白介素-1β水平上调的同时,Activin-A表达也明显提升,进一步发现Activin-A可增强炎症反应。Westall等[10]研究也报道,Activin-A参与了肺移植后肺移植物再灌注导致的炎症反应,与肺部炎症反应和肺损伤相关。本研究结果显示,ARDS组血清Activin-A水平明显高于对照组,且轻、中、重度组血清Activin-A水平随着病情加重而提升,说明Activin-A参与ARDS发生发展,考虑与Activin-A参与了巨噬细胞介导的肺部炎症反应有关。进一步分析显示,高血清Activin-A水平为预后不良独立危险因素,说明Activin-A参与了ARDS预后不良,推测是死亡组患者病情更为严重,炎症反应刺激肺部Activin-A大量表达,加剧肺部炎症反应损伤。
2012年柏林定义根据OI为ARDS病情分级[8],以指导早期正确处理,但截止目前早期评估ARDS病情的参数仍然十分有限,肺部超声具有简便、床旁操作、辐射少、价廉、可重复性强等优点,在急危重症的诊治中广泛使用。研究表明,肺部超声在诊断支气管肺发育不良中、急性呼吸衰竭等肺部疾病中具有较强优势[11]。LUS则是通过肺部超声征象进行评分的方法,能较好评估肺内局灶性病变和肺实变后再通气面积变化[6]。研究发现,床旁LUS能准确评估ARDS肺部通气面积改变,且这种改变发生早于OI改变[12]。本研究结果显示,ARDS组LUS明显高于对照组,且轻、中、重度组LUS随着病情加重而提升,提示LUS分值越高肺组织存在更严重的肺不张、肺水肿及肺实变。进一步分析显示,高LUS为ARDS预后不良独立危险因素,说明LUS有助于评估ARDS预后,推测是死亡组者肺水肿状态无改善或恶化,肺通气面积逐步缩小甚至丧失,降低LUS分值。ROC曲线显示,Activin-A、LUS均对ARDS不良预后具有一定评估价值,联合评估可显著提升AUC,说明联合Activin-A、LUS可提升ARDS预后评估价值。

