复方青风藤巴布剂对佐剂性关节炎大鼠的药效学研究
刘梦丽,林欣媛,闫超双,王方园,舒子璇,贾晓益,桂双英,2,3,4
(1.安徽中医药大学;2.安徽省中医药科学院药物制剂研究所;3.现代药物制剂安徽省教育厅工程技术研究中心;4.药物制剂技术与应用安徽省重点实验室,安徽 合肥 230012)
类风湿关节炎(Rheumatoid Arthritis,RA)是一种系统性、自身免疫性疾病,主要病理表现为滑膜增生,血管翳形成,关节软骨破坏等[1]。目前对RA的治疗主要以药物治疗为主,治疗药物主要有非甾体抗炎药、慢作用抗风湿药物、糖皮质激素、生物制剂等[2]。上述药物对于缓解临床症状、控制病情进展具有显著优势,但尚不能完全治愈和降低RA的致残率[3-4]。近年来,传统中医药治疗RA愈来愈受到人们的重视。复方青风藤巴布剂由青风藤和桂枝经提取制备而成[5],青风藤具有祛风湿,通经络,利小便的功效[6]。桂枝具有发汗解肌,温通经脉,助阳化气,平冲降气的功效[7]。二者配伍共奏祛风除湿、温通经脉、散寒止痛之功效。巴布剂具有载药量大、使用方便、无污染等特点。因此,本实验采用完全弗氏佐剂(Complete Freund’s Adjuvant,CFA)左后跖皮内注射诱导大鼠佐剂型关节炎(Adjuvant Arthritis,AA)模型,观察复方青风藤巴布剂对AA大鼠的保护作用,为复方青风藤巴布剂的进一步研究与开发提供实验依据。
1 材料与方法
1.1 实验动物成年SD大鼠48只,SPF级,雄性,体质量160~200 g,购自安徽医科大学实验动物中心,合格证号:SCXK(皖)2017-001,动物伦理号:AHUCM-rats-2020016。动物均饲养于温度(25±2)℃和湿度(50±10)%的屏障环境内,标准颗粒饲养并自由饮水,每日光照12 h。实验前,适应性饲养4 d以上。
1.2 主要试剂完全弗氏佐剂(Sigma,批号:SLBD0736);戊巴比妥钠(北京化学试剂有限公司,批号:061222);青藤碱(纯度≥98%,上海煦朗实业有限公司,批号SS105956);氢氧化钠(江苏强盛功能化学股份有限公司,批号:20141025);多聚甲醛(国药集团化学试剂有限公司,批号20140206);无水乙醇(国药集团化学试剂有限公司,批号:20140102);二甲苯(上海苏懿化学试剂,批号:20140806);苏木精-伊红染料(自制);青风藤和桂枝饮片均购于安徽亳州药材市场,经安徽中医药大学杨青山副教授鉴定均为合格饮片;聚丙烯酸钠NP-700(日本昭和公司,批号:0005488791);甘油(国药集团化学试剂有限公司,批号:20160721);酒石酸(汕头市达濠化工厂,批号:920128);交联聚维酮(PVPP,安徽山河药用辅料股份有限公司,批号:141006);甘氨酸铝(上海麦克林生化科技有限公司,批号:10042001);卡波姆(南京威尔化工有限公司,批号:20110702);三乙醇胺(上海试剂三厂,批号:0815);氮酮(郑州津北化工有限公司,批号:20140326);丙二醇(江西益普生药业有限公司,批号:20150501);聚维酮K-90(PVPK-90,广东粤美化工有限公司,批号:20160215);生理盐水(开开援生制药有限公司,批号:14071734)。
1.3 仪器设备自动脱水机(湖北孝感,型号:亚光ZT-12M);石蜡包埋机(湖北孝感,型号:亚光YB-7B):切片机(德国,型号:Leica RM2135);切片漂烘仪(安徽合肥电子研究所科,型号:力飞QP-B);显微镜(德国,型号:Olympus BXS1);数码照相装置(德国,型号:Olympus DP70)。
1.4 方法
1.4.1 复方青风藤巴布剂的制备 分别称取青风藤360 g,桂枝90 g,加入6倍量90%乙醇,回流提取3次,每次1.5 h。合并提取液,减压浓缩,干燥得干浸膏[5]。取聚丙烯酸钠NP-700 2.5 g、甘氨酸铝0.08 g、PVPP 0.5 g、中药干浸膏4.2 g和氮酮1.21 g加入11 g甘油中,搅拌均匀,作为A相;另取PVP-K90 0.8 g加20 g水溶解,加入酒石酸0.08 g充分溶解,作为B相;将B相加入到A相中,搅拌均匀,取适量滩涂于无纺布上,盖上防黏层,压制,即得[6]。
1.4.2 青藤碱凝胶的制备 取4 g卡波姆940于纯水中溶胀过夜,精密称取4 g青藤碱,用乙醇和丙二醇充分溶解后加入卡波姆溶液中,不断搅拌至均匀,用三乙醇胺调pH至7.0,加纯水至200 g,即得2%的青藤碱凝胶[8]。
1.4.3 AA模型建立 雄性SD大鼠48只,按体重大小编号后,随机数表法抽取40只大鼠于左后跖皮内注射CFA 0.1 mL制作AA模型[9],余下8只作为空白对照组,同法注射0.1 mL生理盐水。
1.4.4 分组与给药 造模后第18天,用足趾容积测量仪测定大鼠非致炎侧足爪容积,计算非致炎侧足肿胀度(肿胀度=致炎后的足容积-致炎前的足容积[10]),根据大鼠足跖肿胀度将40只AA大鼠随机分为5组,每组8只,即模型组,复方青风藤巴布剂高、中、低剂量组12.0、6.0、3.0 g/(kg·d)和阳性药组。给药前24 h,用剃毛机剃去大鼠腹部3 cm×3 cm长毛,从造模后第19天在腹部给药,复方青风藤巴布剂高、中、低剂量组分别贴敷不同剂量的巴布剂[11],阳性药组涂抹青藤碱凝胶,模型组和空白对照组均贴敷空白基质巴布剂,给药1次/d,每次贴敷24 h,连续给药7 d。
1.5 观察指标
1.5.1 一般情况 观察大鼠体毛色泽,神志及活动状态,饮食变化等情况。
1.5.2 体重 分别于造模前(0 d)和造模后第7天、10天、13天、16天、19天、22天、25天称取各组大鼠的体重并记录。
1.5.3 继发侧足爪肿胀度 分别于造模前(0 d)和造模后第7天、10天、13天、16天、19天、22天、25天用足趾容积测量仪测定大鼠非致炎侧足爪容积。
1.5.4 细胞因子IL-1β和TNF-α 于末次给药后12 h,腹腔3%戊巴比妥钠麻醉,进行腹主动脉取血,静置30 min后,离心10 min,转速为3500 r/min,分离血清,-20 ℃冷冻保存,待测。IL-1β和TNF-α测定采用酶联免疫吸附实验(ELISA)法,操作严格按照试剂盒说明书方法进行。
1.5.5 病理组织学检测 于末次给药12 h后,处死大鼠,取踝关节置于4%多聚甲醛固定,5%硝酸脱钙,至用针刺入组织无阻力感为止。脱水、透明、石蜡包埋、切片及苏木精-伊红(HE)染色,显微镜下观察踝关节组织滑膜细胞增殖情况、细胞侵蚀程度、血管翳形成以及软骨表面光滑与否。
HE染色法:石蜡切片经二甲苯脱蜡→水化→苏木素染色10 min(染细胞核)→盐酸酒精分化→伊红染色(染细胞浆)→梯度酒精脱水→二甲苯透明→树脂胶封片→光学显微镜下观察大鼠踝关节的病理表现。
1.6 统计学分析采用SPSS 23.0软件进行统计学分析,计量资料结果以“均数±标准差”表示,多组间均数比较采用单因素方差分析[6]或重复测量方差分析方法,P<0.05表示差异具有统计学意义。
2 结果
2.1 一般情况造模成功的大鼠毛色较粗糙,精神倦怠,食量下降,大小便未见异常,注射佐剂部位的皮肤无溃烂,少许红肿,大鼠行动较困难,急性炎症出现时以爬行为主,有舔足、抖动的现象出现。待继发侧炎症出现时,右足红肿,但程度轻于致炎侧;通过给予复方青风藤巴布剂和青藤碱凝胶治疗后,上述症状有所缓解。
2.2 体重在前10 d各组大鼠的体重均一致增加,从第10天开始,除空白对照组外,其他致炎组体重均有所下降,至第16天,各致炎组大鼠体重明显下降;自第19天开始治疗后,除模型组外,各治疗组大鼠体重均有所增加,至第25天,各治疗组大鼠体重明显增加,见表1。

表1 大鼠体重变化情况
2.3 继发侧足爪肿胀度与空白对照组相比,在第7天和第10天,各致炎组的继发侧足肿胀度无显著性差异(P>0.05),第16天,各造模组继发侧的足肿胀度显著增加,差异具有统计学意义(P<0.05),表明AA大鼠模型造模成功。从第19天测完继发侧足容积后开始给药,与模型组相比,给药后第4天,复方青风藤巴布剂高剂量组和中剂量组大鼠继发侧足肿胀度明显减轻(P<0.05);给药后第7天,复方青风藤巴布剂各剂量组、阳性药组大鼠足肿胀度均显著减轻(P<0.05,P<0.01),且复方青风藤巴布剂高剂量组的治疗效果最好,优于阳性药组,见表2。

表2 大鼠继发侧足肿胀度变化情况
2.4 细胞因子IL-1β和TNF-α表达水平比较与空白对照组相比,模型组大鼠血清中细胞因子IL-1β、TNF-α水平显著升高,差异具有统计学意义(P<0.05);与模型组相比,复方青风藤巴布剂高、中、低剂量组IL-1β、TNF-α水平显著降低,差异有统计学意义(P<0.05)。其中复方青风藤巴布剂高剂量组血清中细胞因子IL-1β和TNF-α的水平和空白对照组没有显著性差异(P>0.05),说明高剂量组可以有效降低炎症大鼠血清中细胞因子IL-1β和TNF-α的浓度至正常大鼠水平,且治疗效果优于中、低剂量组,见表3。

表3 大鼠血清中IL-1β和TNF-α表达水平比较
2.5 病理组织学检测由HE染色结果可知,空白对照组大鼠均踝关节软骨表面光滑,滑膜细胞排列平整,滑膜组织未见增生,无细胞侵蚀,无血管翳形成;模型组大鼠均出现大量血管翳,大量炎症细胞浸润,关节软骨受损严重;复方青风藤巴布剂高剂量组大鼠均少见炎症细胞浸润和血管翳,关节软骨表面较光滑;复方青风藤巴布剂中、低剂量组和阳性药组大鼠均可见炎症细胞浸润和血管翳,关节软骨表面出现中度和轻度不等的受损,见图1。
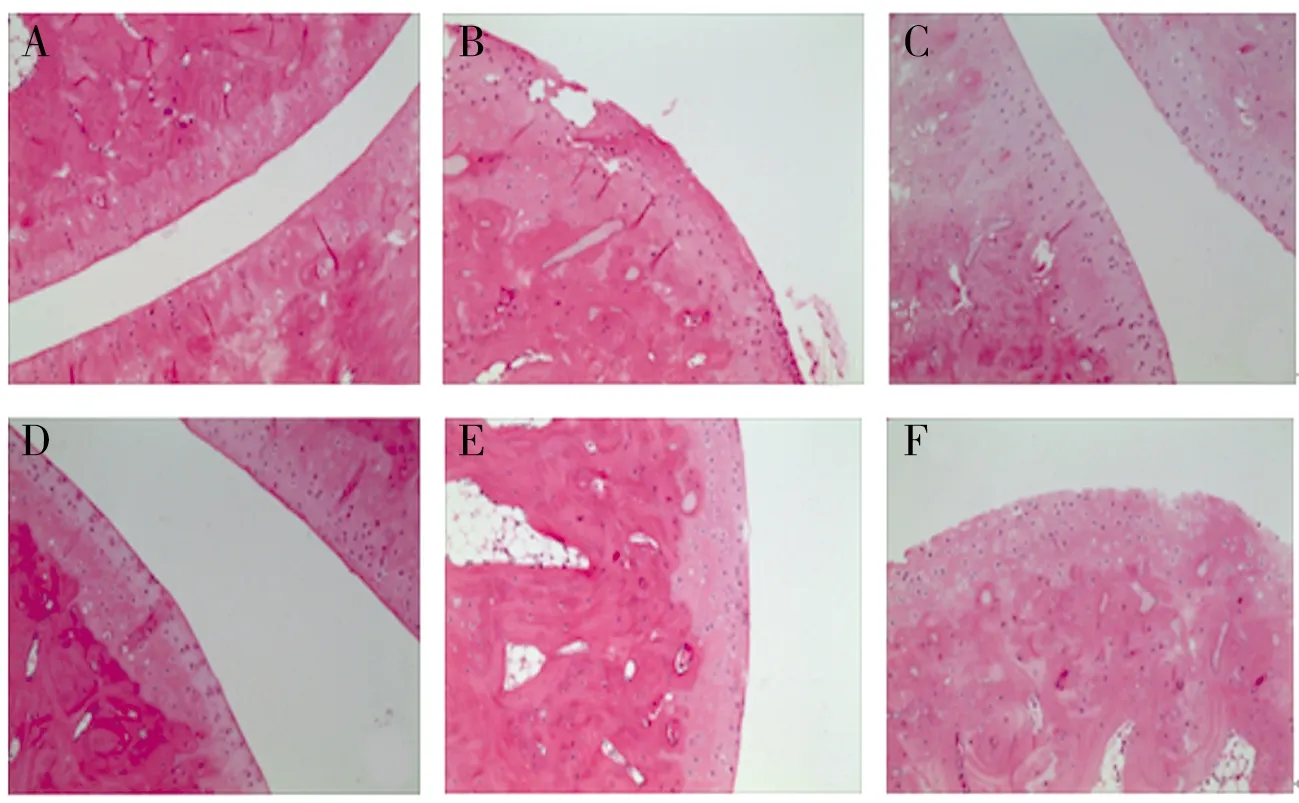
图1 各组大鼠踝关节病理切片图(HE,×200)
3 讨论
AA大鼠模型现已广泛应用于RA发病机制及其相关药物防治作用的研究中,是一种经典的免疫性炎症模型[12-13]。CFA是一种强大而有效的致炎剂,注射后能够引起局部明显且持续时间较长的炎症痛,表现为红、肿、热、痛等基本炎症反应特征,是建立慢性炎症痛模型最常用的药物[14-15]。本实验中,大鼠左后跖皮内注射完全弗氏佐剂后,大鼠毛色较粗糙,精神倦怠,行动出现困难,并且可观察到明显的红、肿症状,提示CFA成功诱导AA大鼠模型,为开展复方青风藤巴布剂对AA大鼠的药效学研究提供了保障。
青藤碱是从传统中药青风藤中提取分离的一种生物碱单体,具有抗炎、镇痛、免疫抑制等药理作用[16-17]。目前,青藤碱作为有效成分治疗风湿和类风湿关节炎,临床上主要剂型有片剂、肠溶胶囊剂、缓释片、静脉注射剂等制剂[18]。青藤碱凝胶贴剂是将青藤碱制成经皮给药制剂,可避免口服吸收制剂的首过效应及静脉给药易发生的不良反应,增加药物在给药部位的浓度积累并起到持续释药的作用。本实验前期选择腹部、踝关节两个部位进行考察,由于大鼠足部病变部位面积小,无法满足给药需求,并且大鼠活动性强,无自觉意识,容易撕咬、挣脱巴布剂,给药时间不能达到要求最终选择腹部进行贴敷给药。在腹部贴敷不仅有充足的给药面积,同时加以胶带固定还可以有效地减少大鼠撕咬、挣脱等情况出现,保证有效给药时间。此外,本实验选择与青风藤巴布剂具有相同给药方式的青藤碱凝胶贴剂作为阳性药物所得实验结果更能直观、科学的反映青风藤巴布剂的治疗优势,为该剂型的后续研发工作提供实验依据。慢性炎症疼痛涉及外周和中枢神经系统病变,具有复杂的病理过程。大量研究表明TNF-α和IL-1β在RA发病期间发挥着不可替代的作用,TNF-α可促进PEG、IL-1等释放,使炎症细胞进入关节腔,损伤关节滑膜和关节软骨[19];单核和巨噬细胞可以分泌IL-1β,其可诱导炎症的发生,导致滑膜增殖,侵蚀软骨,大量白细胞浸润[20-21]。本实验在前期课题组优选出复方青风藤巴布剂药材的最佳提取工艺和复方青风藤巴布剂的最佳基质处方和制备工艺相关研究基础上,在AA大鼠模型中考察了复方青风藤巴布剂的抗炎作用。结果表明复方青风藤巴布剂高剂量组可以有效地降低AA大鼠血清中TNF-α和IL-1β的浓度,并且疗效优于青藤碱凝胶(P<0.05,P<0.01),说明本实验制备的复方青风藤巴布剂在治疗RA方面具有一定的疗效。
综上,本研究采用CFA诱导AA大鼠模型证实复方青风藤巴布剂对RA有治疗作用,且可能与其抑制TNF-α和IL-1β有关,这将为复方青风藤巴布剂的进一步开发奠定基础。

