NO2硝化正己烷及其理论计算
李星彦,王墨,戴璇,彭新华,唐双凌
(1 南京理工大学化学与化工学院,江苏 南京 210094;2 南京理工大学环境与生物工程学院,江苏 南京 210094)
核燃料组件在反应堆中受到中子辐射,发生裂变并达到规定的卸料比燃耗后从反应堆中卸出,后处理厂通常采用PUREX 流程提取核燃料中的铀、钚和其他裂变元素[1]。PUREX流程用硝酸将核燃料溶解,然后用一定配比的磷酸三丁酯(TBP)和稀释剂组成的萃取剂进行液-液萃取,稀释剂通常选用无臭煤油,其主要成分是正十二烷[2]。
迄今为止,乏燃料后处理发生了多起事故,对设备和建筑物造成了不同程度的破坏,同时也对环境造成了严重的污染[3-8]。在高温和强辐射的情况下,TBP、正十二烷以及它们的水解、辐解的降解产物长时间与硝酸接触发生了硝化、氧化等反应,生成红色的油状物质,即“红油”,当“红油”的温度高于130℃时会发生热失控而导致爆炸[9]。
关于“红油”的研究主要集中在TBP与HNO3的热分解,而正十二烷作为稀释剂在此体系中的反应却少有研究[10-16]。烷烃中只有C—C 键和C—H键,在辐照下γ 射线能量为1.24×106eV,而C—C键和C—H键的能量分别为3.61eV和4.28eV,因此正十二烷容易受到硝酸诱导的辐射分解生成短链烷烃,研究表明短链烷烃比正十二烷更容易发生硝化反应[17],这可能是“红油”不稳定的原因之一,且HNO3在高温和强辐射条件下极易分解出棕红色的NO2气体[18-20],而NO2也因其较强的硝化能力和原子经济性而广泛应用于硝化反应的研究[21-25]。
本文旨在研究“红油”体系中可能发生的反应,对反应条件和机理等进行探索,以期增加对“红油”体系的认识和了解。同时,系统研究了正己烷在NO2体系中的硝化行为,这种硝化方法为脂肪烃特别是低碳烷烃的硝化制备硝基烷烃提供了全新的思路和线索,为以后的工业应用奠定了良好的实验基础。基于此,本研究以正己烷为底物、NO2为硝化剂对正己烷硝化反应进行了研究,探究了不同反应条件对硝化反应的影响,并采用密度泛函理论(DFT)研究了NO2硝化正己烷的反应机理,求得各可能反应机理的过渡态及其活化能Ea,从而确定NO2硝化正己烷较优的反应机理,通过分析反应过程中体系的分子结构、原子电荷和IR 振动频率的变化规律,揭示了硝化反应的实质。
1 实验部分
1.1 主要试剂与仪器
正己烷、碳酸氢钠,分析纯,麦克林试剂有限公司;二氧化氮(NO2),纯度为99.9%,南京特种气体有限公司;无水硫酸钠,分析纯,国药化学试剂有限公司。
TZPR-50 型高压反应釜,上海岩征仪器有限公司; GC-2014C 型气相色谱仪、 GCMSQP2020NX 型气相色谱-质谱联用仪,日本岛津公司。
1.2 正己烷NO2硝化反应
称 取 0.86g (10mmol) 正 己 烷 和 0.92g(20mmol)冷的NO2液体加入50mL 智能反应釜中,密封后设置温度、时间及转速。反应完成后冷却至室温后取出反应液,加入5% NaHCO3水溶液吸收过量的二氧化氮,并将有机相洗至中性,用去离子水洗涤多次后使用无水硫酸钠干燥,通过气相色谱内标法(氯苯为内标)分析正己烷的转化率。色谱柱条件:色谱柱为WondaCAP (30m×0.25mm×0.25µm);进样口温度为250℃;柱温,60℃下保持1min,以8℃/min 的速率升至150℃,再保持12min;分流比为16∶1;溶剂为二氯甲烷。通过气质联用仪对产物进行定性分析,采用面积归一法计算各产物选择性。色谱分析条件:溶剂为二氯甲烷;色谱柱型号为SH-Rxi-5Sil MS(30m×0.25mm×0.25µm);以氦气作为载气,流量为14.0mL/min;程序升温法,50℃保持3min,以15℃/min 升温至280℃保持5min;不分流;进样口温度为250℃。质谱条件(EI):离子源温度为200℃;电子能量为70eV;扫描范围m/z=33~600。
2 结果与讨论
2.1 反应温度的影响
反应温度对NO2硝化剂的硝化能力有较大的影响,于是首先考察了温度对于正己烷硝化反应的转化率以及各产物的选择性的影响。表1为不同温度对正己烷-NO2体系转化率的影响,结果表明:当温度从100℃升高到120℃时,正己烷的转化率不断升高,而继续提高反应温度,正己烷的转化率几乎不变。在反应温度上升过程中,各个反应产物的选择性并没有发生明显的变化,1-硝基己烷的选择性较低,保持在2%左右,2-硝基己烷和3-硝基己烷的选择性分别保持在60%和40%左右。因此,最终确定120℃为较适宜的反应温度,故而在实际蒸发浓缩过程中应及时通入冷却水降温,将温度控制在120℃以下,以保证后处理过程的安全。
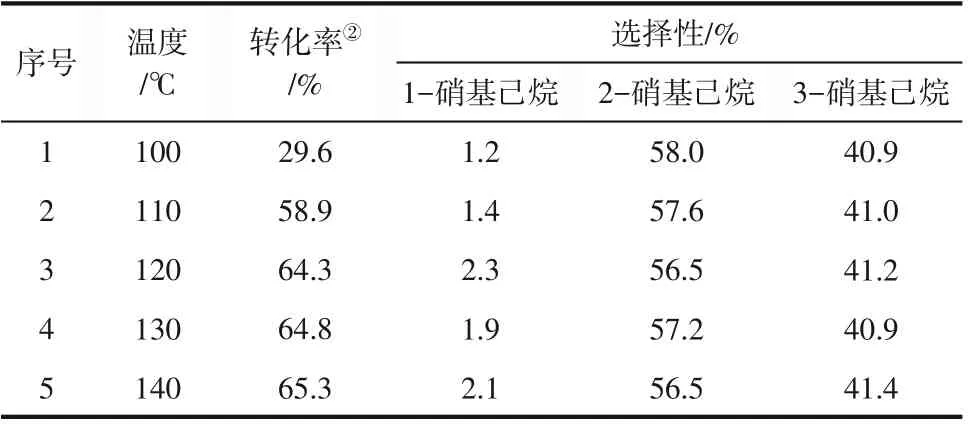
表1 不同反应温度对正己烷硝化反应①的影响
2.2 物料配比对反应的影响
二氧化氮的沸点为21℃且溶于正己烷,随着反应温度的升高,正己烷中的二氧化氮会发生气化,与正己烷发生硝化反应,于是探究二氧化氮的用量对正己烷硝化反应的影响。表2为不同摩尔比对正己烷-NO2体系转化率和选择性的影响,当摩尔比为1∶0.5时转化率只有32.0%;随着正己烷-NO2摩尔比不断升高,正己烷的转化率显著提高;当摩尔比大于1∶2 时,转化率有了显著的提高,达到了85.9%,然而继续增大NO2的用量转化率并没有显著地升高;从各产物的选择性来看,1-硝基己烷的选择性仍较低,保持在2%左右,2-硝基己烷和3-硝基己烷的选择性相当,但是摩尔比对于选择性并没有什么影响。选用摩尔比为1∶2 时的二氧化氮用量比较适宜,过高的NO2浓度对后处理工艺有不利的影响,因此在后处理的过程中因设计合理的排风口,降低反应容器内NO2的浓度,从而避免事故的发生。
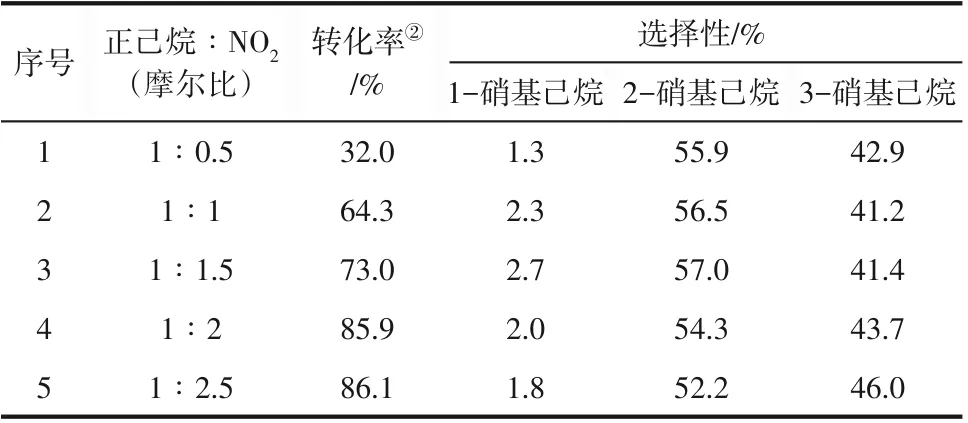
表2 不同摩尔比对正己烷硝化反应①的影响
2.3 反应时间的影响
图1为不同反应时间对正己烷-NO2体系转化率的影响,当反应时间仅发生到30min时,转化率达到了65.7%;随着反应时间的延长转化率不断提高,当反应时间为4h时,转化率为85.9%,继续延长反应时间,转化率没有明显提高。综上所述,NO2硝化正己烷的较优反应条件为:反应温度为120℃,正己烷与NO2摩尔比为1∶2,反应时间为4h。在该反应条件下,正己烷转化率可达85.9%,在后处理过程中应及时更换稀释剂,避免硝化产物的累积,导致其对后处理的工艺效率有不利的影响。
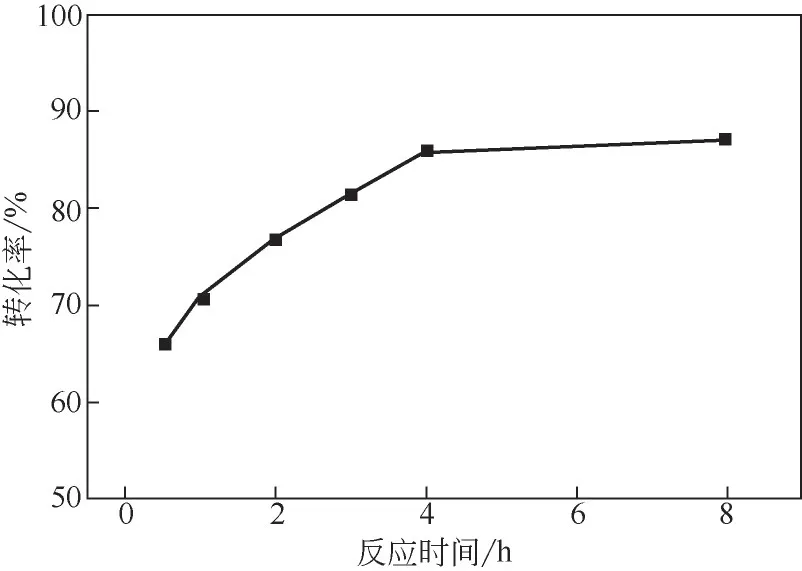
图1 不同反应时间对正己烷-NO2体系转化率的影响
2.4 反应机理计算
2.4.1 反应机理分析
烷烃的硝化反应大多是自由基反应,且NO2与正己烷的硝化反应可能发生在1-位、2-位、3-位上,每个位置均有三种可能的反应途径。图2 为2-位上的硝化反应途径,其他发生在1-位、3-位的反应途径与之类似。在途径(1)中,NO2中的N原子进攻2-位上的H 原子,经过渡态TS1 得到中间体HNO2和正己烷自由基,正己烷自由基与NO2反应得到2-硝基己烷或者2-亚硝酸己烷酯;同理在途径(2)中,NO2中的O原子进攻2-位上的H原子,经过过渡态HONO和正己烷自由基,随后正己烷自由基和NO2反应得到2-硝基己烷或者2-亚硝酸己烷酯;途径(3)中,NO2中的N原子直接进攻2-位,经过过渡态TS3得到2-硝基己烷并且脱去一个氢原子。
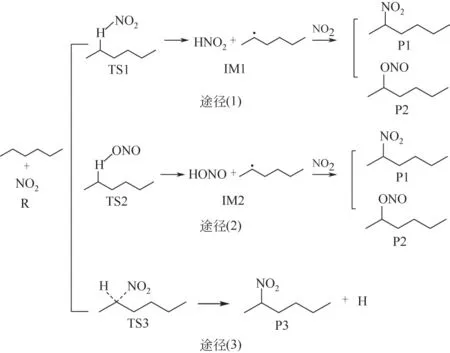
图2 NO2硝化正己烷2-位的3个可能的反应途径
2.4.2 计算方法
在B3LYP/6-311++G(3df,2pd)//B3LYP/6-31G*[26]水平下对途径(1)、(2)和(3)各驻点进行分子几何优化和频率计算。结果与分析中各驻点的能量均包含了B3LYP/6-31G*水平的零点能校正。所有过渡态有且只有一个虚频,通过内禀反应坐标(IRC)计算证实了各个过渡态确实连接了反应物和中间体。由于NO2和正己烷自由基都具有自由基的性质,所以计算一律采用非限制性模式。所有计算均通过Gaussian09W 程序进行,在B3LYP/6-31G*计算水平下优化出各个反应途径中各驻点的平衡几何,并且通过振动分析没有虚频。随后在B3LYP/6-311++G(3df,2pd)较高的计算水平下完成单点能的计算,收敛精度取程序内定值。
2.4.3 反应过程各驻点的能量
正己烷自由基与NO2反应得到2-硝基己烷和2-亚硝酸己烷酯属于双自由基无垒反应,通过比较同分异构体的总能量确定最终产物,采用B3LYP/6-31G*计算水平分别计算同分异构体的总能量,结果表明:2-硝基己烷总能量为-1159388.252kJ/mol,2-亚硝酸己烷酯总能量为-1159382.398kJ/mol,2-硝基己烷的能量比2-亚硝酸己烷酯的能量低5.854kJ/mol,这表明2-硝基己烷为硝化反应的主要产物。
表3为 B3LYP/6-311++G(3df, 2pd)//B3LYP/6-31G*计算水平下的NO2硝化正己烷各反应物、过渡态能量及其活化能(Ea),进一步判断硝化反应机理,可以明显看出NO2中N原子直接进攻C原子发生在各个位置上需要的反应活化能都在267~273kJ/mol 之间,远远高于途径(1)和途径(2)的活化能Ea,这表明途径(3)从反应机理上很难发生。对比途径(1)和途径(2),发生在2-位和3-位的活化能Ea仅相差1~2kJ/mol,而发生在1-位的活化能Ea要高出16~18kJ/mol,这表明该硝化反应主要发生在2-位和3-位且这两个位置可能存在竞争反应,计算结果与实验结果保持一致。
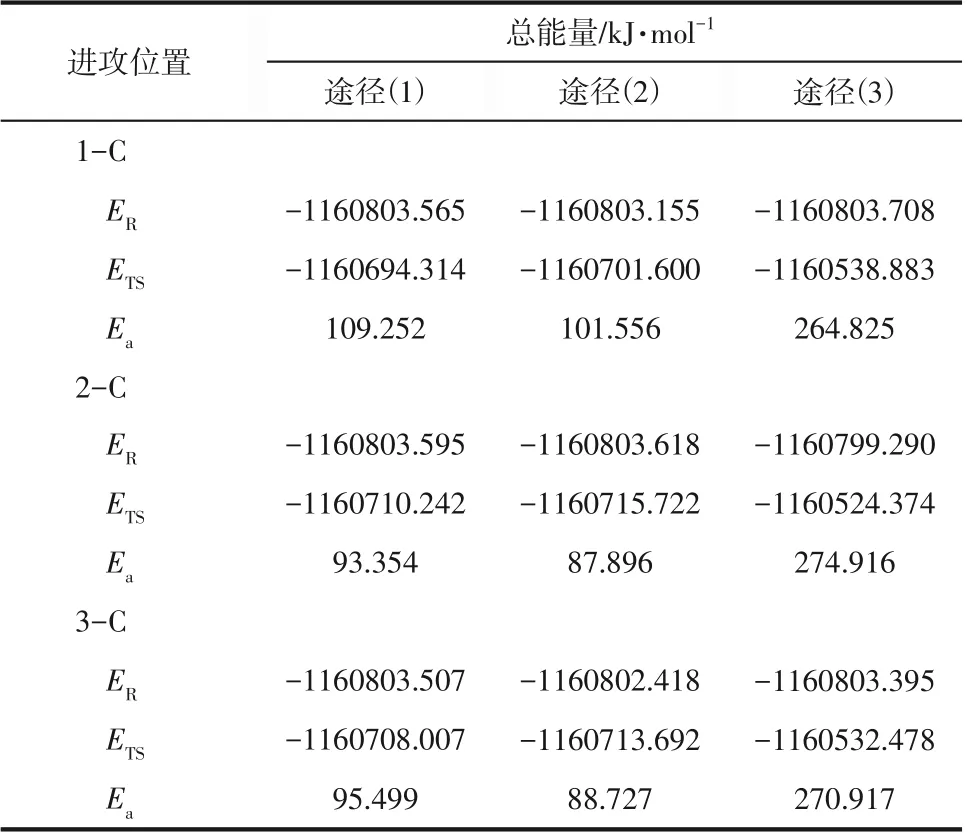
表3 B3LYP/6-311++G(3df,2pd)//B3LYP/6-31G*方法计算各可能反应路径中NO2硝化正己烷各反应物、过渡态能量(E)和活化能(Ea)
图3为NO2中O原子进攻2-位H原子的决速步骤的内禀反应坐标(IRC)分析示意图,该图进一步表明,过渡态确实连接着反应物(R)和中间体(IM2),因此上述计算求得的过渡态(TSx)和反应活化能(Ea)是可信的。
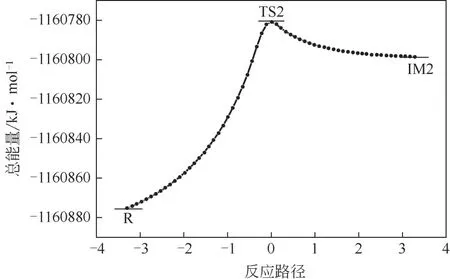
图3 NO2中O进攻正己烷2-位H原子的决速步骤的内禀、反应坐标(IRC)
2.4.4 分子结构
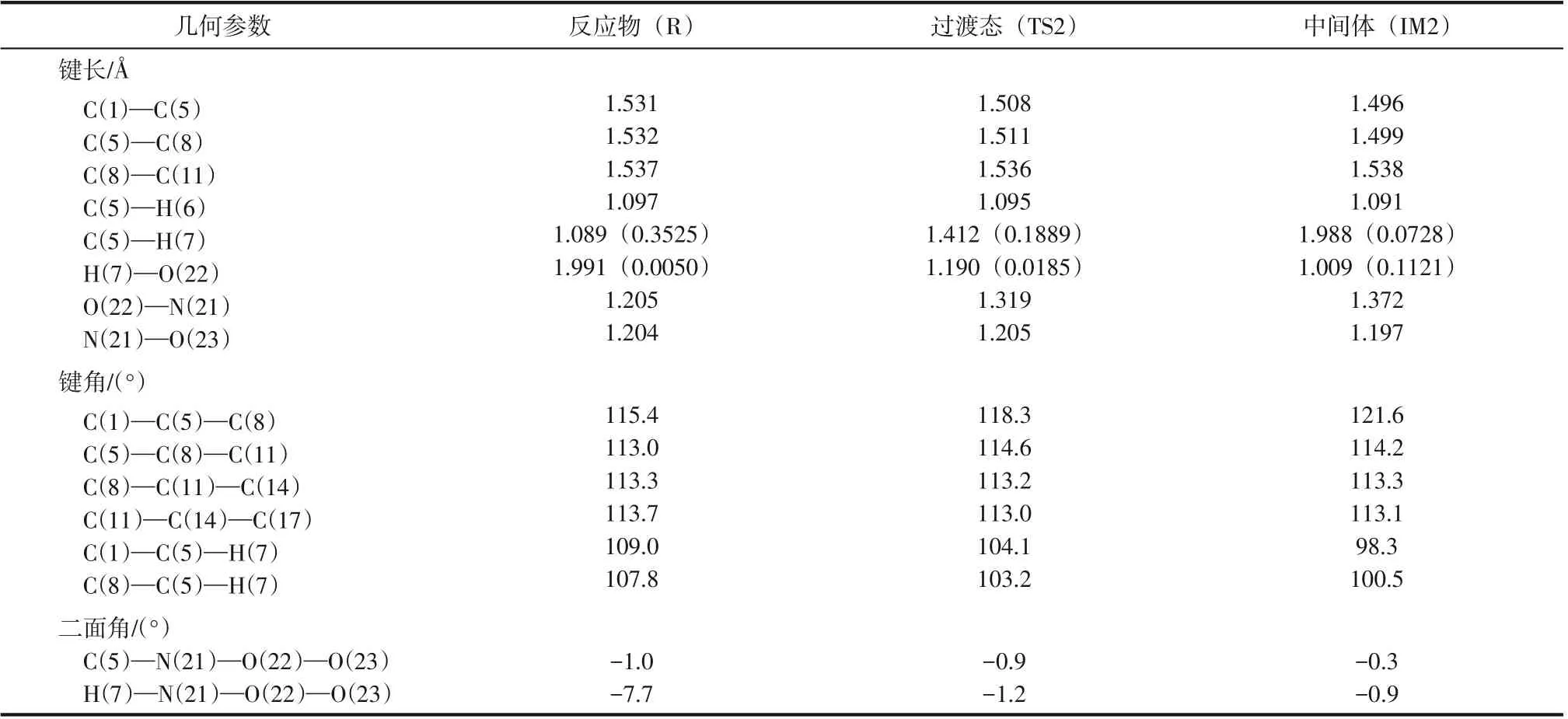
表4 NO2中O原子进攻正己烷2-位H反应的部分分子几何参数(键长、键角和二面角)的变化
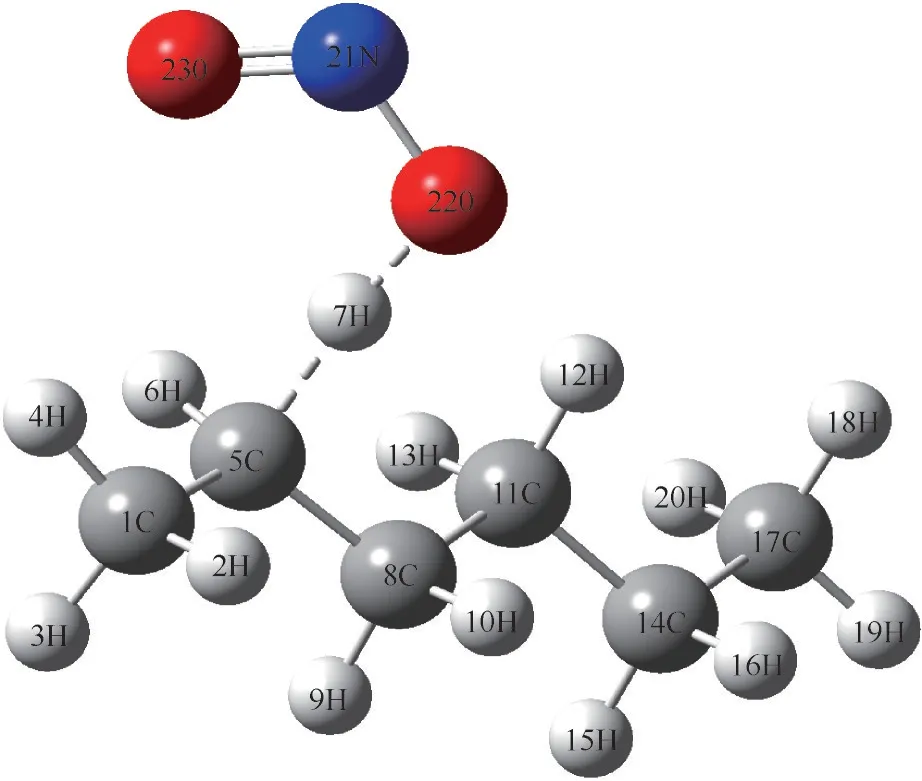
图4 NO2中O原子进攻2-位H时的过渡态TS2的结构及对应的原子序号
2.4.5 原子电荷
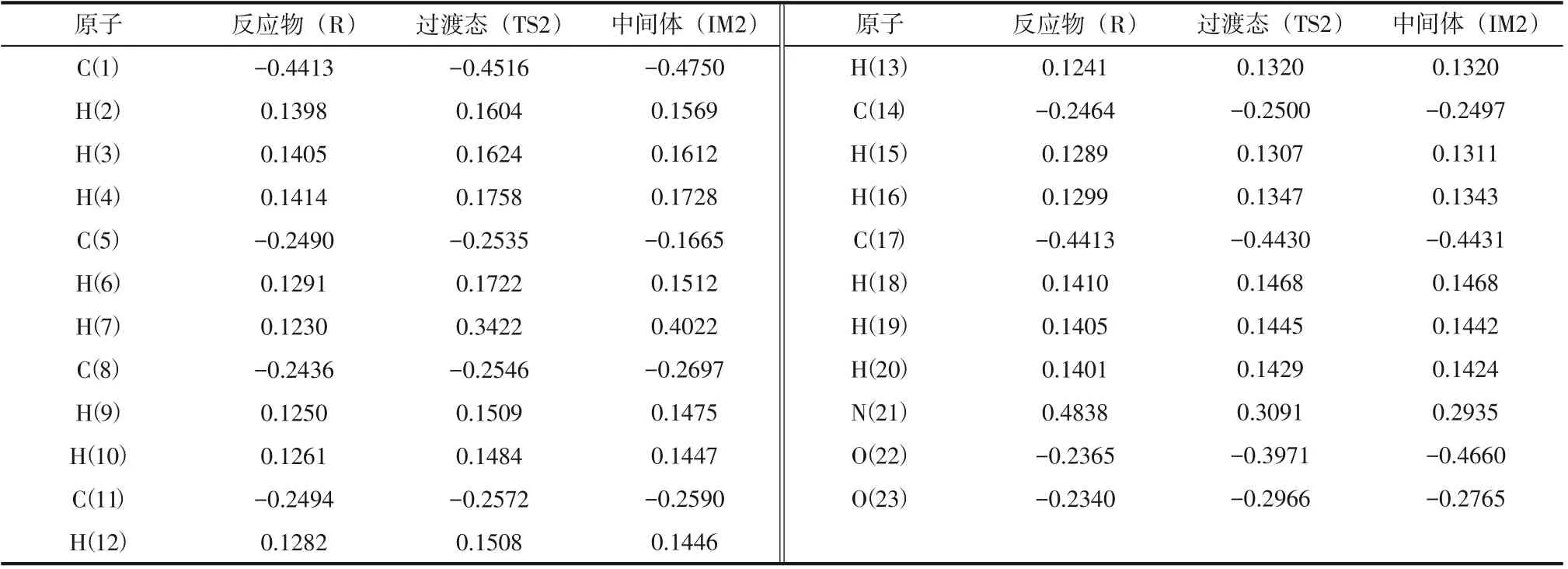
表5 NO2中O原子进攻正己烷2-位H原子反应中原子自然电荷的变化 单位:e
2.4.6 IR谱
红外光谱能提供许多官能团的信息,表6 为NO2中O进攻正己烷2-位H反应过程中反应物、过渡态和中间体振动频率的变化。可以看出,反应物在1654cm-1处有强特征峰,对应—NO2弯曲振动;2907~2986cm-1处的几个中等强度的吸收峰对应烷烃的C—H 的伸缩振动峰。过渡态TS2 有且只有唯一的虚频-1417cm-1,保证了过渡态结构的准确性;在1571cm-1有强吸收峰,表明趋向于反应物R或中间体IM2。从中间体的振动频率来看,IM2 在1634cm-1有强吸收峰,对应于HONO分子的面内弯曲振动,尤其在3024cm-1处,其峰强度达到了381km/mol,这是由于中间体中O-H 键的伸缩振动引起的,这同样也表明了O—H键的形成。
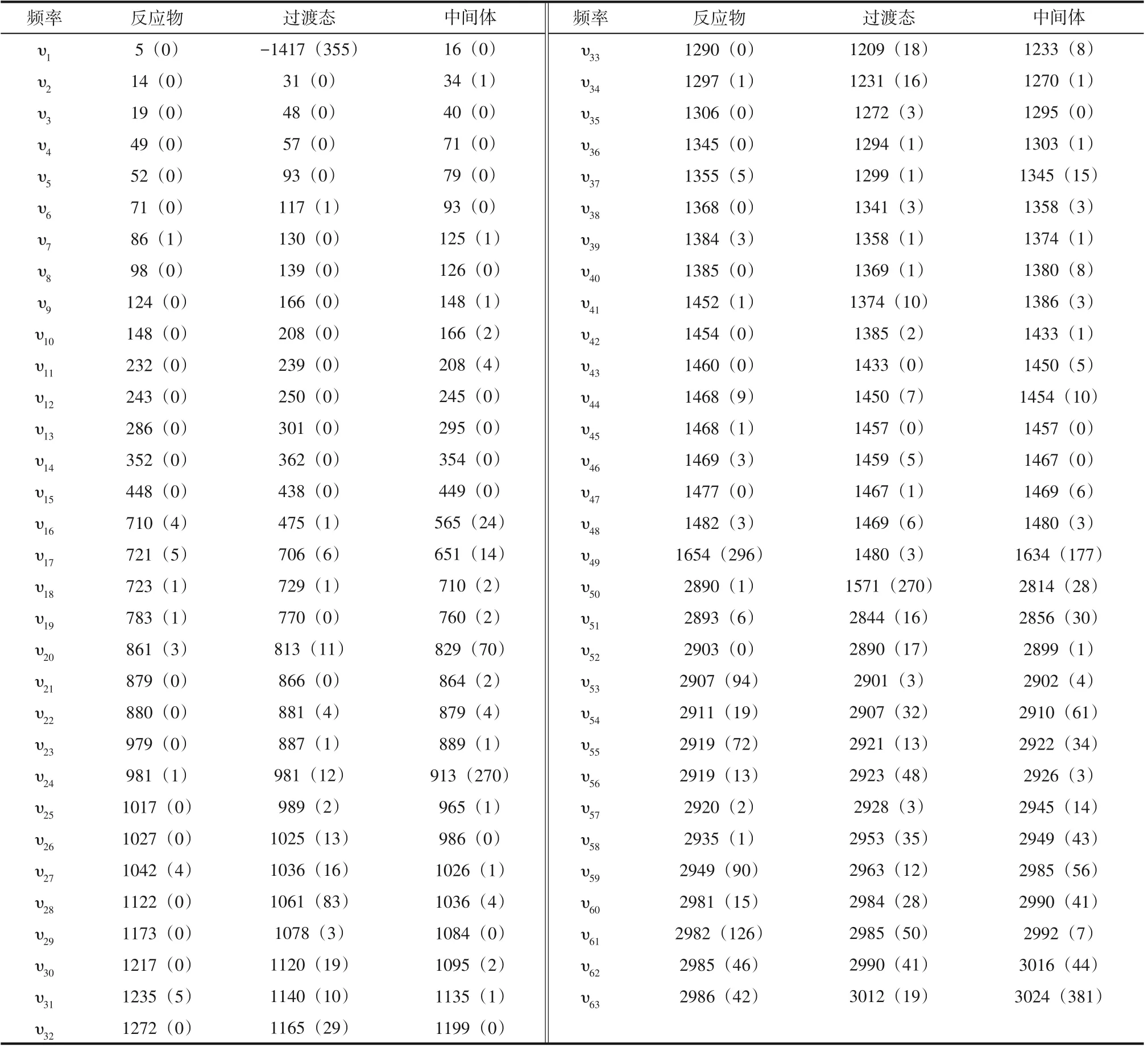
表6 NO2中O原子进攻正己烷2-位H原子反应过程中振动频率的变化 单位:cm-1
3 结论
(1)考察了反应温度、摩尔比和反应时间对正己烷NO2硝化反应的影响,结果表明:反应温度为120℃,正己烷与NO2摩尔比为1∶2,反应时间为4h时硝化正己烷转化率可达85.9%,1-硝基己烷的选择性远低于2-硝基己烷和3-硝基己烷,且2-硝基己烷和3-硝基己烷的选择性相当,改变反应条件对各产物的选择性并没有影响。
(2)采用B3LYP/6-311++G(3df,2pd)//B3LYP/6-31G*计算方法计算NO2硝化正己烷的反应机理,结果表明:决速步骤为NO2中O原子进攻正己烷中H原子的可能性更大。
(3)硝化反应发生在1-位的活化能远大于2-位和3-位,且发生在2-位的活化能仅小于3-位1kJ/mol,这表明1-位的选择性较低,2-位的选择性与3-位的选择性相当,与实验结果保持一致。从分子几何结构、原子电荷、IR 振动频率数据表明C—H键的断裂和O—H的形成是一个协同过程,只有与主要参与硝化反应相连或相近的分子几何参数及其原子电荷有明显的变化。

