曲妥珠单抗联合替吉奥治疗HER2阳性ⅢB-Ⅳ期老年胃癌的临床观察及对PI3K/AKT/mTOR信号通路的影响
谢耀莹,杨帆,李淑云,汪文娟
1.内蒙古民族大学附属呼伦贝市人民医院消化内科,内蒙古呼伦贝尔021008;2.内蒙古民族大学附属医院健康管理中心内分泌科,内蒙古通辽028007;3.上海交通大学医学院附属第九人民医院消化内科,上海200011
作为临床中常见恶性肿瘤病,胃癌发病率居所有恶性肿瘤疾病的第2 位,病死率居第3 位,其在全球范围内的年发病率约13.86/10 万[1],发病因素涉及饮食结构、感染幽门螺杆菌(Helicobacter pylori,Hp)、遗传因素、地域环境等[2]。由于胃癌早期无典型的症状体征,大部分患者在确诊时已发展至疾病中晚期,手术机会已丧失[3]。化疗是晚期胃癌的主要治疗手段,能够改善患者生存情况,但晚期胃癌老年患者多合并基础病,生理机能不佳,且化疗药物具有不同程度的毒性,随着化疗时间的增加,容易出现严重不良反应或耐药而造成治疗失败[4]。由此分子靶向治疗逐渐受到众多学者的关注并广泛应用于胃癌的临床治疗[5]。人类表皮生长因子受体2(Human epidermal growth factor receptor 2,HER2) 是一种酪氨酸激酶受体,能够参与调节细胞增殖、细胞分化和细胞凋亡等众多行为过程,胃癌中HER2 蛋白阳性比例处于12%~20%之间[6]。曲妥珠单抗是针对HER2 靶点的单克隆抗体,具有抑制肿瘤生长的作用,能够用于治疗表达HER2蛋白的实体瘤,胃癌为实体瘤之一,且能与替吉奥联合用于胃癌治疗[7]。磷脂酰肌醇3 激酶(Phosphatidylinositol-3 kinase,PI3K)/丝苏氨酸蛋白激酶(serinethreonine kinase,AKT)/哺乳动物雷帕霉素靶体蛋白(Mammalian target rapamycin,mTOR)为与恶性肿瘤生物学过程关系甚密的通路之一,与胃癌发生、发展及预后显著相关[8]。鉴于以往研究数据结果不够全面,信度不高且相关指导意见尚不具体,本文就曲妥珠单抗联合氟尿嘧啶类口服化疗药替吉奥治疗HER2 阳性ⅢB-Ⅳ期老年胃癌的疗效及对PI3K/AKT/mTOR 通路的影响展开了研究,以期为临床应用提供参考。
1 资料与方法
1.1 一般资料 经内蒙古民族大学附属呼伦贝尔市人民医院医学伦理委员会批准(批准号为ZCC201309019)。选择2014年6月-2019年6月在内蒙古民族大学附属呼伦贝尔市人民医院确诊并收治的HER2 阳性ⅢB-Ⅳ期胃癌患者404 例,采用数字表法随机分成观察组202 例与对照组202 例。观察组男性患者125 例;年龄60~84 岁,平均年龄(72.5±4.7)岁;平均体质量指数(22.42±2.31)kg/m2;TNM 分期ⅢB 期87 例,Ⅳ期115 例;肿瘤分化程度中高分化128 例,低分化74例。对照组男性患者130 例;年龄60~86 岁,平均年龄(71.8±4.5)岁;平均体质量指数(22.38±2.27)kg/m2;TNM 分期ⅢB 期85 例,Ⅳ期117 例;肿瘤分化程度中高分化130 例,低分化72 例。2 组一般资料差异无统计学意义(>0.05),具备可比性。
1.2 纳入和排除标准 纳入标准(1)病理诊断明确为胃癌;(2)TNM 分期处于ⅢB~Ⅳ期;(3)HER2 免疫组化结果呈阳性(2+);(4)患者卡氏评分超过60分;(5)患者未出现全身广泛性转移或(和)全身衰竭症状;(6)患者年龄≥60 岁;(7)预计患者的生存时间大于3 个月;(8)无感染性疾病或心脏受损;(9)已签署知情同意书。凡符合上述所有标准的病例纳入本研究。排除标准(1)拒绝随访或随访期间失访;(2)病历资料不完整;(3)合并其他肿瘤病;(4)严重肝脏、肾脏功能障碍;(5)合并精神疾病或过敏性疾病;(6)合并血液系统疾病或无法正常地沟通交流;(7)左心室射血分数(Left ventricular ejection fraction,LEVF)小于50%;(8)入组前接受过与胃癌有关的治疗;(9)对于本次研究药物过敏。凡具有以上任何1 项标准的病例不纳入本研究。
1.3 治疗方法 对照组患者接受顺铂联合替吉奥治疗,顺铂(齐鲁制药有限公司、国药准字H37021356、规格为6 mL:30 mg)60 mg/m2,第l~4 天静脉滴注,21 d 为1 个周期,总共4~6 个周期。替吉奥(江苏恒瑞医药股份有限公司、国药准字H20113281、规格为20 mg),40 mg/m2,每天2 次,早晚餐后口服,第l~14天给药,休息7 d,21 d 为1 个周期,总共8 个周期。观察组患者接受曲妥珠单抗联合替吉奥治疗,替吉奥用法用量和对照组相同,曲妥珠单抗(美国Genentech Inc,国药准字J20110020,规格为440 mg/20 mL/瓶),首剂8 g/kg 予静脉注射,之后以6 g/kg 剂量每间隔21 d 给药,21 d 为1 个周期,总共治疗8 个周期。
1.4 疗效评定与方法 治疗结束,参照《实体瘤的疗效评价标准》[9]分为患者完全缓解(complete remission,CR)、患者病情稳定(Stable condition,SD)、患者病情进展(progressive disease,PD)及患者部分缓解(Partial remission,PR),RR 率= (CR 患者例数+PR患者例数) /总患者例数×100%,DCR 率= (CR 患者例数+PR 患者例数+SD 患者例数) /总患者例数×100%。
1.5 观察指标与方法(1)血清癌胚抗原(Carcinoembryonic antigen,CEA)、糖类抗原72-4(Carbohydrate antigen 72-4,CA72-4) 和糖类抗原19-9 (Carbohydrate antigen 19-9,CA19-9) 水平检测,抽取患者治疗前后的空腹静脉血5 mL,以3 000 r/min 为离心转速,20 cm 为离心半径,10 min 为离心时间,进行离心操作,操作结束后取血清,用化学发光法[10]、PUZS-300 全自动生化分析仪(上海帝博思生物科技有限公司)分别测定血清CA72-4、CEA 和CA19-9 水平。(2)血中PI3K、AKT 和mTOR mRNA 水平检测,治疗前和治疗后,采用实时荧光定量逆转录聚合酶链反应(Real time fluorescence quantitative-Polymerase Chain Reaction,RT-PCR)[11]检测,方法如下为采用总RNA 提取试剂盒(上海羽哚生物科技有限公司)提取血液总RNA,然后逆转录成cDNA,以此cDNA 为模板进行PCR 扩增,反应条件为95 ℃/120 s,95 ℃/30 s,72℃/15 s,35 次循环。根据扩增曲线读取循环阈值(Cycle threshold,Ct),基因的相对表达量=2-△△Ct,以-actin为内参照,计算PI3K、AKT 和mTOR mRNA 水平。(3)生存统计,治疗结束后进行电话随访,每3 个月1 次,总随访时间为24 个月,记录存活状态。(4)不良反应评估,依据美国国家癌症中心(National Cancer Institute,NCI) 毒性分级标准[12],对乏力、骨髓抑制、消化道反应和肝功异常等治疗期间的不良反应发生率进行记录。0 级,无不良反应;I 级,不良反应轻微,不需要借助药物干预;Ⅱ级,不良反应中度,患者需要通过药物干预;Ⅲ级,不良反应重度,患者需药物干预,且需要中断或者终止治疗;Ⅳ级,不良反应引起不可逆的致死性损伤。
1.6 统计学分析 采用SPSS 22.0 处理数据。计量资料以均数±标准差(±s)表示,采用独立样本t 检验;计数资料以例数和百分率表示,采用2检验;通过Kaplan-Meier 法绘制生存曲线。<0.05 表示差异有统计学意义。
2 结果
2.1 2 组患者临床疗效比较 观察组患者的RR 率及DCR 率高于对照组(2=38.950、33.653,=0.001、0.001)。见表1。

表1 2 组患者临床疗效比较
2.2 2 组患者血清CA72-4、CEA 和CA19-9 水平比较治疗前,2 组血清CA72-4、CEA 和CA19-9 水平差异无统计学意义(>0.05);治疗后,2 组血清CA72-4、CEA 和CA19-9 水平较治疗前降低(<0.05),观察组血清 CA72-4、CEA 和 CA19-9 水平低于对照组(<0.05)。见图1。
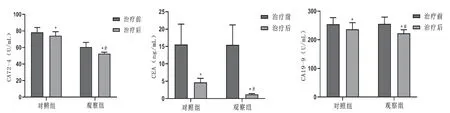
图1 2 组患者治疗前后血清CA72-4、CEA 和CA19-9 水平比较(±s,=202)
2.3 2 组患者血中PI3K、AKT 和mTOR mRNA 水平比较 治疗前,2 组血中PI3K、AKT 和mTOR mRNA 水平差异无统计学意义(>0.05);治疗后,2 组血中I3K、AKT 和mTOR mRNA 水平较治疗前显著减少(<0.05),观察组血中PI3K、AKT 和mTOR mRNA水平低于对照组(<0.05)。见图2。
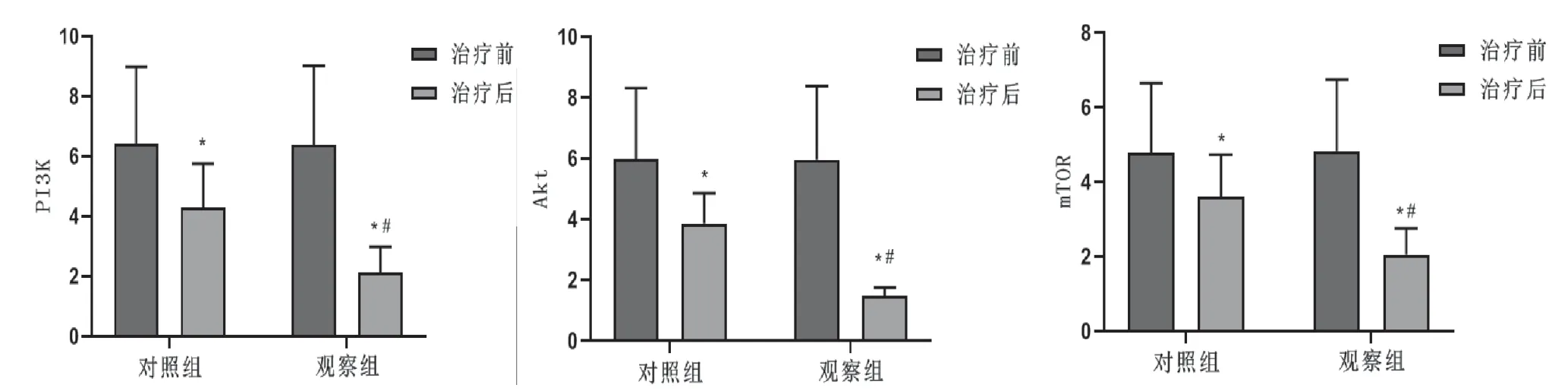
图2 2 组患者治疗前后血中PI3K、AKT 和mTOR mRNA 水平比较(±s,=202)
2.4 2 组患者生存情况比较 观察组患者2年总生存率[51.49%(104/202)]高于对照组[22.77%(46/202)](Log Rank ()2=36.046,<0.001),见图3。

图3 Kaplan-Meier 法绘制2 组生存曲线
2.5 2 组患者不良反应比较 观察组患者乏力、消化道反应、骨髓抑制、肝功异常发生率依次低于对照组,差异具有统计学意义(2=34.242、29.011、27.331、32.959,=0.001、0.001、0.001、0.001)。见表2。
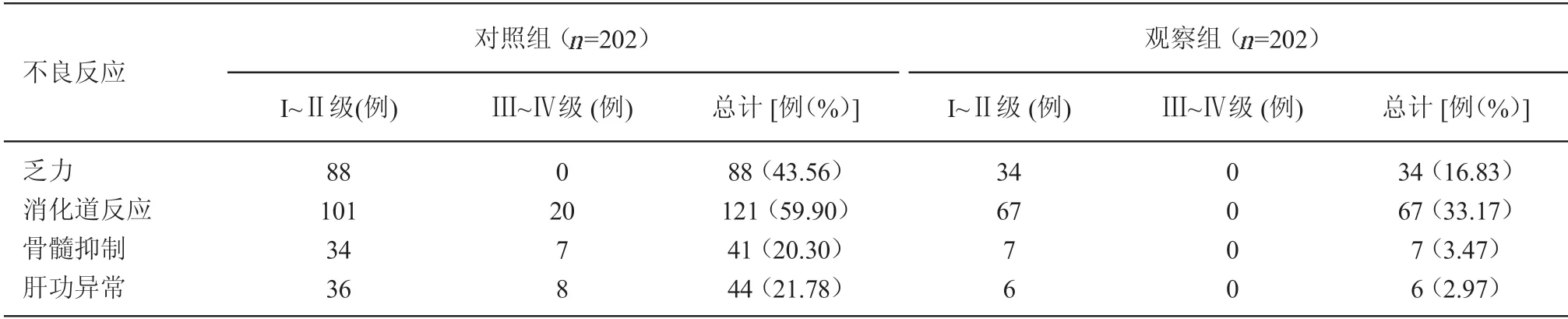
表2 2 组患者的不良反应比较(例,率)
3 讨论
随着医学技术的不断更新与发展,胃癌的靶向治疗技术逐渐应用于临床。HER2 是一种酪氨酸激酶受体,该基因位于17 号染色体q21 上,全长为28515 bp。正常情况下HER2 为非激活状态,当受到刺激后其结构发生异常从而被激活,处于激活状态的HER2 有着肿瘤转化活性,能够在机体细胞信号转导过程中产生重要效应,从多个途径干扰肿瘤细胞的生长和侵袭、转移等生物学行为,参与肿瘤形成及发展[13]。HER2在胃癌患者中呈高表达水平,过表达HER2 的胃癌肿瘤有着高侵袭性特点,患者预后通常较差,HER2 能作为胃癌预后的预测指标之一,亦为理想的胃癌靶向治疗干预靶点[14]。曲妥珠单抗为人源化单克隆抗体之一,能够拮抗HER2 分子所介导的生物学功能,于1986年获得批准正式上市,能够和HER2 蛋白分子发生特异性结合,阻止肿瘤血管生长,提高化疗药物治疗效果。曲妥珠单抗为HER2 阳性胃癌患者的靶向药物,研究显示[15]曲妥珠单抗与化疗药物联合治疗HER2 阳性胃癌患者的中位生存时间为13.8 个月,但单独化疗患者的中位生存时间为11.1 个月,联合组对生存期的改善效果显著优于单独化疗组。替吉奥为氟尿嘧啶类口服化疗药,其主要成分为吉美嘧啶和替加氟,应用于临床时患者的耐受性较好[16]。据统计数据显示[17],日本晚期胃癌患者的化疗,超过80%的患者使用替吉奥,能够获得较高的治疗有效率。
本次研究曲妥珠单抗联合替吉奥应用得出的数据结果显示,观察组患者的RR 率及DCR 率高于对照组,说明该联合方案对于HER2 阳性ⅢB-Ⅳ期胃癌患者有着较好的疗效,这与既往研究一致[5]。此外,曲妥珠单抗联合替吉奥治疗组患者2年总生存率高于顺铂联合替吉奥治疗组,且乏力、消化道反应、骨髓抑制、肝功异常发生率均低于对照组,提示该联合方案有助于提高患者生存率,且不良反应较少。肿瘤标记物血清水平检测不仅有着低创伤和方便快捷的优点,还具有高灵敏度、高特异度的特点,有助于了解恶性肿瘤形成和发展进程,并在胃癌疗效评估、随访阶段中有重要意义。CA72-4、CEA 和CA19-9 为常见胃癌肿瘤标记物,其水平检测能够反映患者预后转归情况[18]。研究报道[19],胃癌患者中CA72-4、CEA 和CA19-9水平上调明显,其高表达水平预示着患者有较差的预后及较高的临床分期。本研究中,治疗后观察组血清CA72-4、CEA 和CA19-9 水平低于对照组,提示曲妥珠单抗联合替吉奥能够减少患者肿瘤标志物血清水平,从而改善患者预后情况。PI3K/AKT/mTOR 通路被诸多学者认为是与胃癌肿瘤过程最为密切的通路,该通路可介导抗细胞凋亡效应及促细胞存活效应,从而参与调控肿瘤增殖和迁移[20]。动物实验发现[21],PI3K抑制剂LY294002 可缩小胃癌移植瘤小鼠瘤体体积,促使肿瘤微血管密度降低。临床报道显示[22],PI3K/Akt/mTOR 通路相关蛋白表达量与胃癌患者肿瘤分化程度、TNM 分期相关,PI3K/AKT/mTOR 信号通路的关键信号分子异常活化与过度表达对胃癌发生、发展起促进作用。临床研究发现[23],循环热灌注化疗有助于杀灭胃癌细胞,抑制PI3K/Akt/mTOR 通路,降低血清中PI3K、AKT、mTOR 分子水平。笔者分析了本研究联合治疗方案对患者PI3K/AKT/mTOR 通路的影响,发现治疗后观察组外周血mRNA 水平低于对照组,说明曲妥珠单抗联合氟尿嘧啶类口服化疗药有助于阻止PI3K/AKT/mTOR 通路的激活,抑制由该通路引起的胃癌肿瘤血管生成及癌细胞增殖。
综上所述,曲妥珠单抗联合替吉奥在HER2 阳性ⅢB-Ⅳ期胃癌中有较好的应用价值,能够降低肿瘤标志物血清水平,提高患者生存率,下调PI3K/AKT/mTOR 信号传导通路水平,不良反应较少,具有一定的临床应用价值。

