胆汁酸代谢调节胆汁淤积性肝病的作用机制及药物研发
李 静, 郑葵阳, 张蓓蓓
徐州医科大学病原生物学与免疫学教研室, 徐州医科大学感染与免疫实验室,江苏省免疫与代谢重点实验室, 江苏 徐州 221004
胆汁淤积性肝病(cholestatic liver disease,CLD)是各种原因导致肝脏内外胆汁的生成、分泌排泄发生障碍,使得胆汁流无法正常流入十二指肠而进入血液的一类肝胆疾病的统称[1-2]。通常将其分为肝内胆汁淤积和肝外胆汁淤积。引起胆汁淤积的原因主要包括遗传因素、药物损伤、酒精刺激、肿瘤、病毒、微生物、寄生虫感染等[3-4]。目前对该病的发病机制、诊断、治疗手段的认识尚不够完善,因此该病的预防及治疗存在一定挑战。
CLD最重要的病理学表现是胆汁淤积,胆汁淤积必然伴随肝脏中胆汁酸浓度及成分的变化。越来越多的研究显示,胆汁酸不仅可以作为清洁剂促进组织营养吸收,还可作为重要的信号分子作用于胆汁酸受体,通过调节相关信号通路,最终影响CLD的疾病发展过程。本文将重点论述胆汁酸代谢在CLD中的作用及机制,以及用于治疗该病的胆汁酸及其相关衍生物药物的研发进展,以期提高人们对此类疾病的认识和理解,为今后CLD预防及治疗的研究提供参考。
1 胆汁酸代谢与CLD
1.1 胆汁酸代谢生理功能 胆汁酸是胆固醇代谢的终末产物,分为初级胆汁酸和次级胆汁酸两大类,主要存储于肝脏、胆囊、肠道中。胆汁酸合成是促进胆固醇分解代谢重要的生物学过程,负责机体大约90%的胆固醇输出。初级胆汁酸主要在肝脏中合成,存储于胆囊,经过十二指肠进入到肠道,肠道中95%的胆汁酸经过肠肝循环重吸收至肝脏中。胆汁酸除了调节肝肠营养吸收,其还可作为信号分子激活胆汁酸受体调节宿主免疫应答,糖、脂和能量代谢及肠道菌群稳态等生理活动[3,5-6]。
胆汁酸的生物活性与其在组织内的浓度密切相关。一般情况下,15~25 μmol/L的胆汁酸可作为信号分子,浓度达到50~200 μmol/L则可以引起细胞凋亡,浓度高于200 μmol/L则作为炎症因子引起炎症反应,而浓度在200~2000 μmol/L甚至高于2000 μmol/L时可造成细胞坏死[7]。研究[8]证实胆汁酸浓度的变化严重影响肝脏生理功能,高浓度的胆汁酸具有细胞毒性作用。另一方面胆汁酸代谢发生改变后,打破肝脏代谢的稳态,可诱发肝脏炎症,促进非酒精性脂肪性肝病的发生发展,促进肥胖、糖尿病、炎症性肠病等疾病进展。
1.2 胆汁酸代谢在CLD中的作用
1.2.1 调节自身代谢 肝脏胆汁酸流的正常转运依赖多种转运蛋白及酶的参与。如肝细胞合成胆汁酸后,胆汁酸输出泵是胆汁酸分泌到胆小管内的主要流出通道,肝血窦转运蛋白Na+依赖牛磺胆酸钠协同转运蛋白(sodium taurocholate cotransporting polypeptide,NTCP)、有机阴离子转运蛋白是介导胆汁酸进入肝细胞的主要转运蛋白[9]。正常的肠肝循环在肝脏胆汁酸流稳态中发挥重要的作用。病理状态下,胆汁酸流肠肝循环受阻,肝脏中胆汁酸大量聚集使得肝细胞中胆汁酸浓度过高,肝细胞完整性被破坏,从而引起细胞凋亡、坏死、促炎基因的表达等,即引起CLD。此时肝细胞基底膜表达的多药耐药相关蛋白4以及有机溶质转运体α/β表达上调,代偿性促进肝细胞胆汁酸的分泌[10]。另外,高浓度的胆汁酸通过活化核受体法尼醇X受体(farnesoid X receptor,FXR)、孕烷X受体、组成性雄烷受体及小异二聚体伴侣受体应激性抑制肝脏胆汁酸流[11],其中FXR起主导作用,其主要通过以下途径缓解肝脏胆汁酸沉积造成的肝毒性作用:(1)抑制胆汁酸合成限速酶胆固醇7α-羟化酶(mitochondrial sterol 7-hydroxylase,CYP7A1)的表达,抑制肝细胞胆汁酸合成能力;(2)肠道中FXR活化后上调纤维母细胞生长因子15/19(fibro-blast growth factor 15/19,FGF15/19)的表达并转移至肝脏中与肝细胞表面的FGFR4受体结合也可以抑制CYP7A1的表达;(3)通过下调NTCP的表达抑制肝细胞吸收胆汁酸的能力;(4)直接作用于胆汁酸输出泵,促进胆汁酸分泌到胆汁中[8,12]。因此,胆汁酸受体和胆汁酸相关转运蛋白成为CLD药物研发的关键作用靶点。
1.2.2 细胞毒性作用 病理状态下,炎症反应会破坏胆-血屏障,肝细胞和胆管上皮细胞的基底外侧质膜暴露在毒性胆汁酸盐中,导致细胞凋亡或坏死[13]。胆汁酸还可通过激活NF-κB通路来介导细胞因子如IL-6、TNFα的产生促进炎症反应[2]。也有研究发现,在过表达肝再生增强因子的细胞中,由于死亡受体DR5的表达减少,甘氨鹅脱氧胆酸诱导的凋亡减少。这一结果在人的样本中亦得到验证。在胆汁淤积患者的肝脏中发现,肝再生增强因子和肝再生增强因子表达的诱导物FOXA2下调,胆汁酸诱导的细胞凋亡显著增加。研究[14]认为不同胆汁酸对组织细胞的增殖和炎症有不同的作用,亲水性胆汁酸对组织细胞具有一定的保护作用,而疏水性胆汁酸则会引起肝细胞凋亡和肝损伤。当胆汁酸引起细胞毒性损伤后,胆汁酸核受体FXR和膜受体G蛋白耦联胆汁酸受体5(takeda G protein-coupled receptor 5,TGR5)可通过负性调节发挥肝保护作用。FXR通过控制胆汁酸的合成和分泌维护肝脏胆汁酸的稳态,进而抑制高浓度胆汁酸造成的细胞氧化应激和损伤,其可通过胆汁酸激动剂增加FXR基因的表达来抑制细胞凋亡和肿瘤的发生[15]; TGR5不同于FXR,其可通过Gs蛋白将细胞外的信号转移到胞内,在磷脂酰肌醇3-羟激酶的催化下,激活第二信使AKT,AKT蛋白磷酸化后能够抑制凋亡蛋白Bcl-2的表达。有研究发现石胆酸刺激MCF-7细胞后,TGR5表达的升高可促进促凋亡P53蛋白的表达,而抑制抗凋亡蛋白Bcl-2细胞的表达,所以石胆酸能够促进MCF-7细胞凋亡[16]。因此,胆汁酸产生细胞毒性作用的同时,又可通过相关受体以负反馈的方式抑制胆汁酸的过度累积或直接调节细胞损伤过程。
1.2.3 调节炎症反应 肝脏中高浓度胆汁酸可杀伤肝细胞和胆管上皮细胞,是造成肝脏炎症反应的启动因素。另外,胆汁酸可以作为炎性因子促进多种炎症因子分泌,包括细胞因子、趋化因子、黏附分子以及花生四烯酸通路相关限速酶的产生和分泌[17]。在小鼠胆管结扎模型中研究显示,疏水性胆汁酸鹅去氧胆酸和胆酸可通过促进肝细胞分泌中性粒细胞细胞间黏附分子1和CXC趋化因子配体1诱导中性粒细胞大量募集[4],胆汁酸通过促进肝细胞分泌IL-23诱导辅助性T淋巴细胞炎性浸润,在IL-17A的作用下促进肝组织中性粒细胞促炎性细胞因子的释放。而中性粒细胞通过释放反应氧物质引起细胞氧化应激而导致细胞坏死,以正反馈的方式加剧肝细胞损伤[18]。另外胆汁酸还可通过调节耐受性树突状细胞转变成高反应型,进而调节T淋巴细胞分泌炎症细胞因子[17]。在巨噬细胞研究[19]中发现,胆汁酸通过直接作用于巨噬细胞表面TGR5受体,抑制炎症小体的活性,从而诱导巨噬细胞产生抗炎性表型。因此,胆汁酸可通过多细胞、多途径调节炎症反应状态参与CLD的疾病进程。
1.2.4 细胞自噬 自噬是细胞通过降解自身的细胞质或细胞器为生物合成提供可循环利用的原料,从而维持细胞内环境稳定和蛋白代谢平衡的生理过程。当细胞处于饥饿、低氧、损伤等不利环境时,自噬的发生对维持细胞存活、抑制凋亡是非常重要的[20]。有研究[21]表明,鹅去氧胆酸和奥贝胆酸等部分胆汁酸以及胆汁酸受体激动剂可以抑制自噬的发生。胆汁淤积症状态下胆汁酸激活FXR后,通过作用于靶蛋白Rubicon抑制自噬溶酶体的形成,从而使得细胞自噬功能受损[22]。然而,熊去氧胆酸(ursodeoxycholic acid,UDCA)是肝脏细胞自噬的有效诱导剂,其可促进溶酶体和自噬体的融合,同时诱导自噬体形成,降低自噬抑制蛋白Rubicon的表达以增强自噬流,从而抵消胆汁淤积对自噬的负面影响。甘氨鹅去氧胆酸是胆汁淤积患者肝脏主要的胆汁酸分子,可促进胆管结扎小鼠肝细胞自噬的发生,当抑制细胞自噬后,胆管结扎引起的肝损伤加重[23]。最新的研究[24]显示,甘氨鹅去氧胆酸可通过促进肝癌细胞的自噬提高细胞的侵袭能力。但是这些研究均缺乏对细胞自噬流的细致研究。而最近有研究[20]揭示胆汁酸诱导细胞LC3自噬小体产生后,自噬小体与溶酶体融合能力下降,自噬流产生受阻。
2 胆汁酸代谢调节CLD的分子机制
2.1 FXR 核受体FXR广泛表达于肝脏、肠道等富含胆汁酸的组织中,胆汁酸如鹅去氧胆酸、去氧胆酸、石胆酸是其内源性配体。研究[16]显示,FXR信号通路是调节肝脏胆汁酸合成及分泌的重要途径,其主要通过调节胆汁酸代谢相关限速酶以及转运蛋白抑制肝细胞胆汁酸合成、吸收以及促进胆汁酸分泌到胆汁中缓解胆汁浓度过高造成的毒性损伤。如FXR活化后通过抑制CYP7A1和CYP27A1的表达,减少胆汁酸合成,上调胆汁酸输出泵、多药耐药相关蛋白2以及NTCP促进肝脏胆汁酸的转运分泌[25]。
原发性硬化性胆管炎(primary sclerosing cholangitis,PSC)患者肝脏中FGF-Src-FXR信号是显著缺失的,研究[26]发现通过上调FGF19介导FXR Y67位点磷酸化可促进FXR核转移,从而调节胆汁酸水平,缓解肝胆汁淤积性病理损伤。而β-catenin通过抑制FXR的核转移,阻止FXR/RXRα复合体的形成,从而降低FXR抑制胆汁合成的能力[27]。肠道菌群在CLD中的作用日益受到关注,最新研究[28]发现,乳杆菌GG移植通过活化小鼠FXR-FGF-15轴抑制胆汁酸合成及促进胆汁酸分泌。因此,在基础研究以及临床药物研发工作中,FXR已成为治疗CLD重要的作用靶点。
2.2 TGR5 TGR5是G蛋白偶联受体超家族成员之一,主要表达于胆囊、肝、肠等组织,参与体内多种代谢性疾病的发生和发展[29]。在肝脏中,TGR5主要表达在髓窦内皮细胞、巨噬细胞、胆管上皮细胞以及活化的肝星状细胞中,而在肝细胞、静息状态下的肝星状细胞中几乎不表达[30]。TGR5与胆汁酸结合后活化,通过激活下游信号通路如CAMP/PKA、AKT信号通路,调节细胞因子、炎症小体的形成,发挥抗炎、抗胆汁淤积和抗细胞凋亡的作用[29]。CLD致病机制研究[31]发现,CA和结合性石胆酸刺激TGR5-/-小鼠引起的胆汁淤积性肝损伤较野生型小鼠严重。同时,研究发现在PSC患者体内TGR5 mRNA水平显著下调。胆管上皮细胞TGR5表达下降后,其更容易遭受胆汁酸引起的细胞毒性作用,并促进PSC以及原发性胆汁性胆管炎(primary biliary cholangitis,PBC)的疾病进展[32],但TGR5表达下调是PSC的疾病起因还是结果目前是不明确的。而在肝内胆管细胞癌中,TGR5与癌细胞的增殖及迁移密切相关,抑制TGR5的表达将是胆管细胞癌治疗的又一重要途径[22,33]。
TGR5对胆管疾病的调节作用主要是通过影响胆管上皮细胞状态及功能。研究[32,34]显示,胆汁酸刺激诱导胆管上皮细胞TGR5活化后可促进反应氧物质以及cSrc表达上调,由此介导上皮生长因子的高表达以及ERK1/2磷酸化,最终促进胆管上皮细胞的增殖。另外,TGR5活化后,还可促进下游信号cAMP表达升高,通过囊性纤维化跨膜电导调节因子诱导氯化物大量分泌,从而促进胆管上皮细胞分泌富含碳酸氢盐的胆汁,形成具有保护作用的“碳酸氢盐保护伞”。因此,TGR5除了促进胆管上皮细胞的增殖之外,也可发挥抗凋亡的作用[30]。
2.3 肠道菌群 初级胆汁酸在肝细胞合成后与甘氨酸或牛磺酸结合并分泌到胆管中,大部分结合胆汁酸进入肠道,并在回肠末端被重吸收,在顶端钠离子依赖胆汁酸转运蛋白的作用下再次进入肝脏并分泌到胆汁中,即完成“肠肝循环”,进入到回肠和结肠的结合胆汁酸在肠道菌群的作用下代谢形成次级胆汁酸[35]。正常状态下,二者相互协调维持各自稳态。而在CLD中,肝脏、胆囊和十二指肠胆汁酸过度淤积,异常的胆汁酸通过肠肝循环进一步影响肠道菌群稳态,而肠道菌群通过代谢分解胆汁酸影响胆汁酸的组成和疏水性。在小儿胆汁淤积症[36]、PSC[37]、PBC[38]患者体内肠道菌群的组成及多样性均发生显著改变,并且Rühlemann等[39]指出肠道菌群韦荣球菌的物种丰度可作为PSC的潜在诊断指标。
而肠道菌群的改变又会反过来影响胆汁酸代谢。如在Mdr2-/-引起的PSC小鼠模型中,肠道菌群的失调引起肠道屏障功能障碍和菌群易位,易位的菌群释放的内毒素通过肠肝循环诱发NLRP3介导的固有免疫反应,最终促进疾病的发展和胆汁酸代谢紊乱[40]。同时,外周血中IL-17水平上调,肝脏IL17A+γδTCR+细胞数目增加,并伴随肝脏和肠道中乳酸杆菌Lactobacillusgasseri丰度增加。研究者[41]通过体内外实验进一步证实Lactobacillusgasseri可促进IL-17水平升高以及肝脏IL17A+γδTCR+细胞浸润。因此Lactobacillusgasseri通过IL-17诱导IL17A+γδTCR+细胞活化是CLD另一重要的致病机制。除了Lactobacillusgasseri丰度增加,肝脏中肠球菌Enterococcus的丰度也是上调的, 但其在CLD中的作用目前还未有研究。乳杆菌GG通过抑制胆汁酸的合成和促进胆汁酸的分泌,降低肝脏中胆汁酸淤积引起的毒性损伤作用,从而有效抑制肝脏纤维化病变[28]。巨噬细胞可通过提高炎症小体活化破坏肠道渗透性,因此来影响肠道菌群组成及物种丰度,协同胆汁酸促进肝细胞损伤,促进胆汁淤积病变的发展[42](图1)。
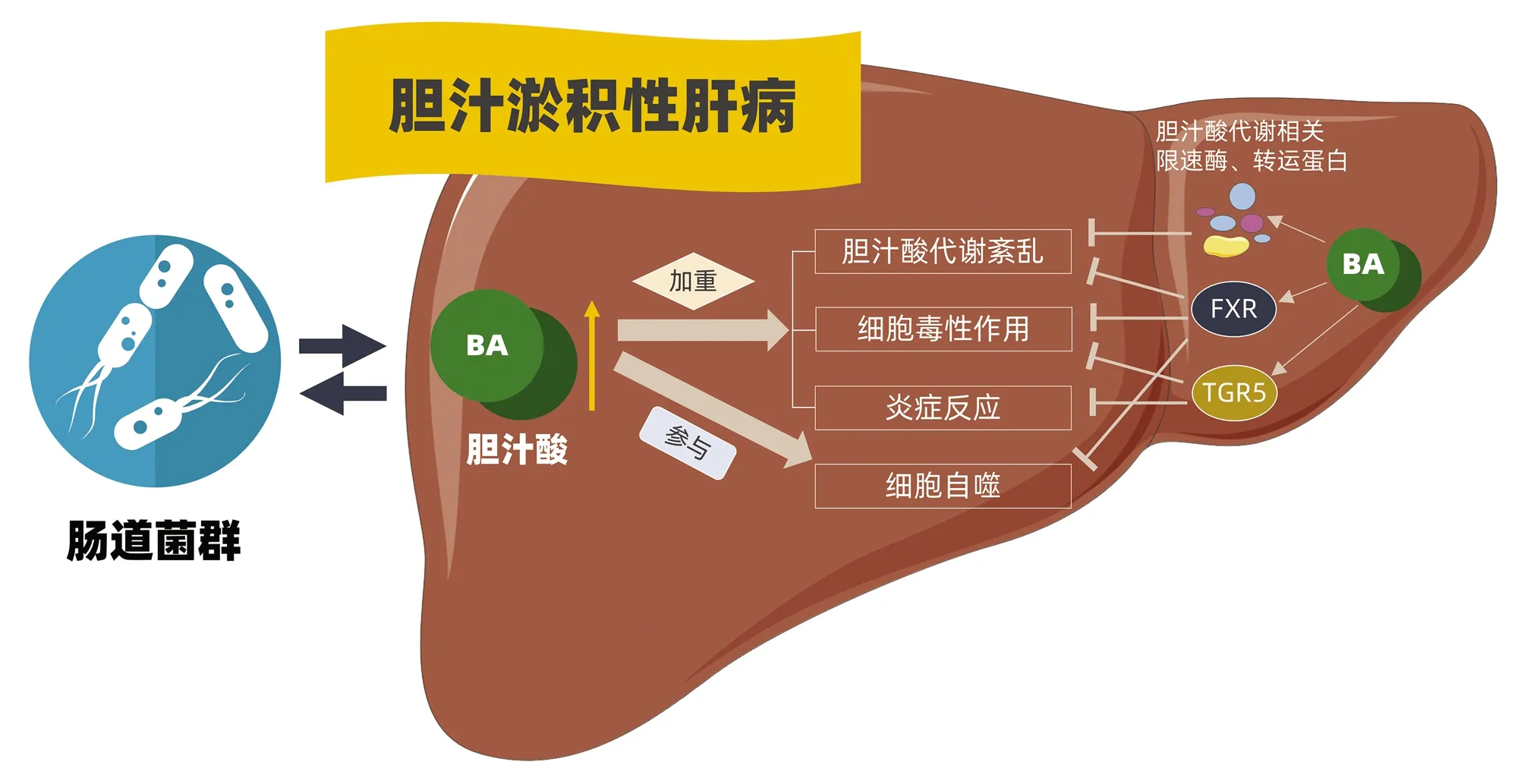
图1 胆汁酸代谢调节CLD的分子机制
胆汁淤积性肝病表现为肝脏胆汁淤积,一方面与肠道菌群相互作用,影响肝脏胆汁酸代谢,参与胆汁酸含量过高引起的肝脏胆汁酸代谢紊乱、肝细胞和胆管上皮细胞细胞毒作用、炎症反应、自噬等现象的发生。肝脏胆汁酸水平过高又可通过胆汁酸代谢相关限速酶和转运蛋白、FXR、TGR5等受体抑制胆汁酸引起的胆汁淤积性病理损伤。
3 基于胆汁酸代谢的CLD治疗靶点和药物研发进展
去除病因和对症治疗是CLD治疗最主要的手段,如病毒感染、酒精、药物引起的急性CLD,一旦去除病因,可以很快恢复。而自身免疫性CLD如PBC和PSC,由于病因无法消除,此类CLD主要依靠药物治疗缓解症状,延缓疾病的发展。而随着胆汁酸代谢在CLD中的作用机制研究的深入,基于胆汁酸代谢的靶向药物的研发成为CLD治疗策略研究领域的热点。其中具有前景的药物如下。

3.2 胆汁酸受体激动剂 目前应用于临床的FXR的激动剂主要有INT7-747、奥贝胆酸和GW4064等。其中奥贝胆酸是鹅去氧胆酸的合成衍生物,也是最早被食品药品监督管理局批准用于治疗PBC患者的临床药物。临床试验[45]证明奥贝胆酸激活FXR后,可以使患者血清ALP、GGT和ALT的活性下降,显著改善PBC患者的肝功能损伤。GW4064是一种选择性非甾体FXR激动剂,其在小鼠体内以FXR依赖的方式降低CYP7A1和胆固醇12α羟化酶(sterol 12alpha-hydroxylase,CYP8B1)转录,并诱导小异二聚体伴侣受体和FGF15的表达控制胆汁酸的过度合成。研究发现,在短肠综合征相关性肝病大鼠模型中中,经FXR激动剂GW4064干预后,肝脏FXR表达水平升高,其靶基因被激活,大鼠的肝脏组织学病变和ALT、AST活性均有改善,同时,肝组织、肠内容物、血清中胆汁酸成分恢复,且与对照组成分接近。与此相一致的是,CYP7A1、CYP8B1、CYP27A1的表达水平下调,最终通过维持胆汁酸稳态来逆转肝损伤[46]。
INT-767(奥贝胆酸的衍生物)是TGR5和FXR的激动剂,其与TGR5的结合能力远高于与FXR的结合能力。研究[47]显示,INT-767通过促进碳酸氢盐的分泌,同时可以通过诱导FGF15和小异二聚体伴侣受体的表达抑制胆汁酸的合成,以及通过抑制NF-κB调节免疫应答反应,有效降低胆汁酸对肝脏的毒性作用,最终改善肝功能损伤、肝脏炎症以及胆管周围纤维化病变 。目前INF-767作为胆汁淤积症的治疗药物已经进入I期临床试验。
3.3 成纤维化生长因子19(FGF19)类似物 FGF19类似物FGF19-M70(NGM282),与野生型FGF19不同之处在于其有5位点氨基酸的缺失以及氨基端3个氨基酸的替换。在肝内外胆汁淤积阻塞性小鼠模型中,M70通过调节FGFR4信号,抑制肝脏CYP7A1的表达,从而降低肝内胆汁酸浓度以及血清肝酶,保护肝脏免受胆汁淤积的损害[48]。除此之外,其亦可以减轻非酒精性脂肪性肝炎小鼠肝损伤。鉴于其在胆汁淤积疾病治疗中的作用,现有大量研究探索FGF19-M70是否也可以用于肝细胞癌的治疗。另外,研究[49]证明,一种新的非致瘤的FGF19类似物FGF19-M52,通过抑制胆汁酸经典合成途径中关键酶基因的表达,减少胆汁酸池中的循环量并将其转变为更亲水的形式,显著降低肝损伤的生化指标,一定程度上抑制肝细胞增殖和炎症基因的表达,使得FXR-/-小鼠免受胆汁酸诱导的自发性肝损伤。临床上,NGM282一般用于对UDCA治疗无效的患者,目前该药已经进入Ⅱ期临床试验。研究[50]发现,与安慰剂组相比,NGM282能够有效降低ALP、ALT、AST水平。
4 小结与展望
综上所述,胆汁酸通过多受体、多信号、多途径形成的复杂的分子调控网络调节其自身代谢、炎症反应、细胞毒性、细胞自噬等生物学过程,从而调节CLD的发生发展。另外,胆汁酸与肠道菌群的相互作用在CLD的发病进程中亦不可被忽视。目前虽有大量令人振奋的药物研发和临床使用成果,但在经济性和高效性上仍有不足。对胆汁酸代谢在CLD中作用机制的研究,以及新而高效的药物靶点和药物的研发,将为临床胆汁淤积患者的治疗提供更全面、更科学有效的方案。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:李静负责文献收集,分析,撰写;郑葵阳负责修改文章;张蓓蓓负责拟定写作思路,指导撰写文章及最后定稿。

