以咯血为主要临床表现的原发性肺动脉肉瘤并肺血栓栓塞症一例报道
康世威,宫小薇,何平,崔江华,袁雅冬
原发性肺动脉肉瘤(primary pulmonary artery sarcoma,PPAS)是一种主要起源于肺动脉内膜或内膜下层并于肺动脉腔内生长的罕见恶性肿瘤,其发病机制目前尚未明确[1]。PPAS患者的临床表现不典型,亦无特异性的影像学特征,较易误诊为急性或慢性肺血栓栓塞症(pulmonary thromboembolism,PTE),常通过手术或尸检确诊。PPAS发病率、确诊率均较低,但病情进展快,对症治疗效果及预后极差。有研究表明,PPAS患者经内科保守治疗后的生存期仅为1.5个月,外科手术治疗后的生存期可延长至10~18个月[2]。因此,早期识别、诊治PPAS至关重要。本文报道了1例以咯血为主要临床表现的PPAS并PTE患者的诊疗经过,以期提高临床医生对该病的诊疗水平。
1 病例简介
患者,男,63岁,汉族,已婚,因“间断咯血11个月,加重1 d”于2018-12-12就诊于河北医科大学第二医院呼吸与危重症医学二科。患者于11个月前无明显诱因出现痰中带血,但未予以重视,后因该症状间断发作并逐渐加重,咯血量约为10 ml/d,遂于2018-09-06就诊于河北医科大学第四医院,行胸部增强CT扫描示:右肺动脉主干及其分支、左下肺分支内动脉栓塞,左肺门增大伴软组织结节,左肺下叶炎症。电子支气管镜检查示:左肺上叶舌段开口处可见黄豆粒大小的新生物,表面可见新鲜渗血,因触之出血,未能成功取得病理组织,采用氩气刀喷凝止血。痰液及支气管肺泡灌洗液均未检测出异常细胞。正电子发射断层显像(positron emission tomography,PET)-CT扫描示:左肺下叶基底段近肺门处见软组织结节影,边缘光滑,考虑良性肺结节可能性大。患者接受止血、抗感染等综合治疗后,病情好转出院。此后,患者因反复咯血入住河北省胸科医院,住院期间患者家属携带患者住院资料前往中国医学科学院阜外医院咨询,考虑PTE可能性大。故患者在入住河北省胸科医院期间接受止血、抗感染等综合治疗,待咯血停止后遵中国医学科学院阜外医院意见予以低分子肝素4 100 U/d,25 d后因患者出现痰中带血停用该药,待出血停止后出院。出院后,患者偶尔咳少量血性痰。2018-11-12,患者于河北省胸科医院复查增强CT示:右肺动脉干、右肺上叶后段肺动脉、左下肺动脉、左肺上叶下舌段动脉栓塞,较2018-09-06检查结果部分减轻,左肺门、左下肺动脉处软组织出现不均匀的轻中度增强,不排除肿瘤的可能。
1 d前患者咯血量增加,最多约150 ml,为求进一步诊治而就诊于河北医科大学第二医院。患者自发病以来无发热、盗汗、乏力、胸痛,饮食、睡眠欠佳,二便及体质量无明显异常,既往体健,无特殊个人史、家族史。入院查体:体温36.5 ℃,脉搏78次/min,呼吸频率20次/min,血压110/80 mm Hg(1 mm Hg=0.133 kPa)。全身浅表淋巴结未触及肿大,无颈静脉怒张;胸廓对称,左侧呼吸动度减低,左下肺触觉语颤减弱,左肺呼吸音低,双肺可闻及散在的湿啰音;心脏听诊P2>A2,未闻及病理性杂音;腹部、四肢及神经系统检查无明显异常。血气分析结果:pH值为7.42,动脉血氧分压(arterial partial pressure of oxygen,PaO2)为 62.60 mm Hg,动脉血二氧化碳分压(arterial partial pressure of carbon dioxide,PaCO2)为40.42 mm Hg,鼻导管吸氧量为3 L/min。D-二聚体为1.29 mg/L,肿瘤标志物、易栓症筛查、自身抗体、血管炎谱及抗心磷脂抗体检查均无明显异常。胸部CT检查示:左肺支气管阻塞,左肺不张,纵隔左移,左侧胸腔积液,右肺上叶后段及下叶背段炎症,见图1A、B。CT肺动脉血管造影(computed tomography pulmonary angiography,CTPA)检查示:左下肺动脉未显影,左肺不张,见图1C、D。心脏彩色多普勒超声检查示:肺动脉压为56 mm Hg,左房室瓣、右房室瓣轻度关闭不全。颅脑及腹部CT检查均未见明显异常,腹部及双下肢静脉彩色超声检查均未见血栓形成。初步诊断为PTE、左肺占位(性质待查)。
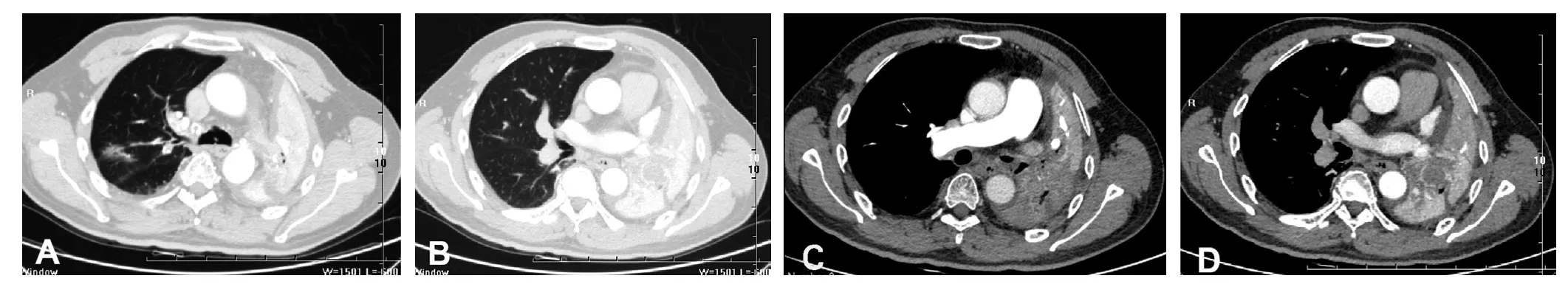
图1 患者胸部CT检查结果Figure 1 Chest CT results of the patient
入院后,给予患者甲磺酸酚妥拉明、酚磺乙胺、氨基己酸、盐酸左氧氟沙星等药物进行止血、抗感染等综合治疗,而后患者咯血症状消失,病情趋于稳定。2018-12-20,患者行电子支气管镜检查显示:镜下可见大量血凝块阻塞左肺主支气管管腔,予以充分吸引及钳夹处理。左肺舌叶开口充血糜烂,因吸引后易出血,故未取得管腔内新生物活检,予以局部止血治疗,见图2。同期行超声支气管镜检查显示:左肺下叶基底段开口处见低回声肿块影,其内见点状血流信号,见图3。行超声支气管镜引导下经支气管针吸活检术(endobronchial ultrasound-guided transbronchial needle aspiration,EBUSTBNA),取出组织条并刷片,发现有恶性肿瘤细胞,免疫表型符合肉瘤,见图4。免疫组化检查示:CD20(-),CD31(+),CD34(-),CD56(-),CD99(+),CgA(-),CKpan(-),cyclin D1(-),LCA(-),NSE(-),P53(-),S100(+),TTF-1(-),Vimentin(+),WT1(-)。患者无不良反应。经支气管镜腔内治疗后,患者咯血症状好转。2018-12-24,复查胸部X线检查提示左肺复张。最终诊断为PPAS伴肺内转移,PTE。建议患者针对肿瘤行手术或放化疗治疗,但患者及家属表示拒绝,并待咯血症状停止后自动出院,3个月后于家中病亡。
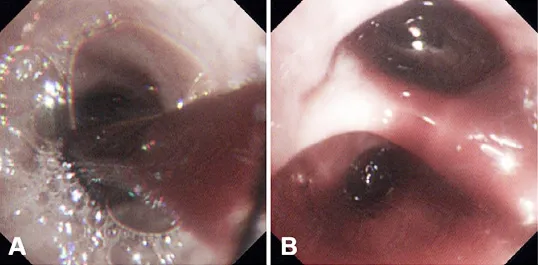
图2 患者电子支气管镜检查结果Figure 2 Results of electronic bronchoscopy of the patient
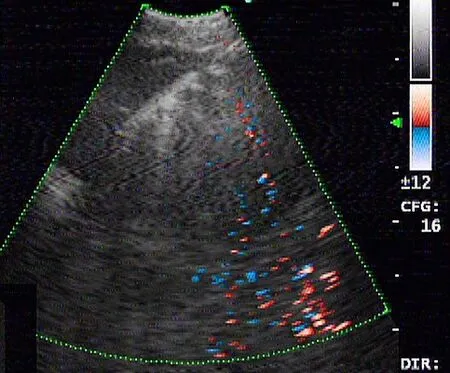
图3 患者超声支气管镜检查结果Figure 3 Results of ultrasonic bronchoscopy of the patient
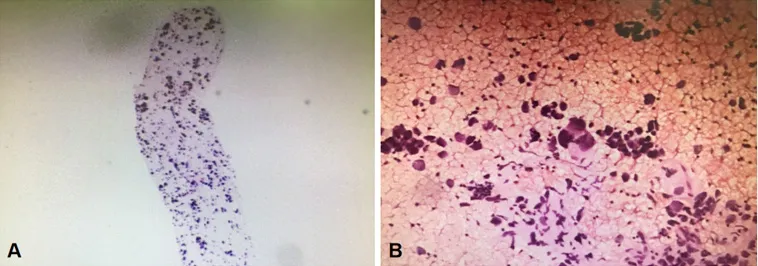
图4 患者超声支气管镜引导下经支气管针吸活检术病理检查结果Figure 4 Pathological examination results of endobronchial ultrasoundguided transbronchial needle aspiration of the patient
2 讨论
PPAS在临床中较罕见,其中以分化不良、侵袭性、致命性较高的肺血管肉瘤较多见。PPAS是起源于肺血管内皮细胞的一种恶性肿瘤,属于深部软组织血管肉瘤,最早于1923年由MANDELSTAMM在尸检中发现并报道[3]。研究表明,PPAS发病率为0.001%~0.030%,平均发病年龄为52岁,男性发病率较高,占确诊患者的55%[4-5]。
PPAS的发病机制目前尚不明确。有研究发现,PPAS患者血小板源生长因子受体α(platelet-derived growth factor receptor alpha,PDGFRα)及鼠双微染色体2(murine double minute 2,MDM2)基因扩增及过度表达,二者可能是PPAS的潜在标志物,但其在PPAS分子遗传学方面的具体机制仍有待研究[6]。WHO将PPAS分为管壁肉瘤(主要为平滑肌肉瘤)和内膜肉瘤,其中内膜肉瘤较常见,且肺动脉起源的内膜肉瘤患病人数约是主动脉起源者的2倍[7]。COX等[8]分析了138例PPAS患者的病理组织结果发现,未分化肉瘤(31.2%)、平滑肌肉瘤(15.9%)、梭状细胞肉瘤(13.8%)、恶性纤维组织肉瘤(7.2%)及纤维肉瘤(5.1%)是临床最常见的5种病理类型。PPAS起病隐匿,早期临床症状并不典型,临床发病率、确诊率均较低,其呈区域性生长,极易转移至邻近肺组织或纵隔淋巴结[9-10],主要临床表现为胸闷、胸痛、咯血、发绀、进行性呼吸困难甚至晕厥,亦可出现体质量下降、发热、乏力、恶病质等恶性肿瘤相关表现。随着疾病进展,可查及颈静脉怒张、剑下心音增强、P2亢进、肝区增大、下肢水肿等肺动脉高压、右心功能失代偿相关体征,实验室检查可发现低氧血症、C反应蛋白水平增高,但D-二聚体水平在参考范围,因此D-二聚体水平可作为PPAS与PTE的鉴别诊断依据,若D-二聚体水平升高则需警惕两种疾病同时存在。
PPAS常可累及主肺动脉干、肺动脉瓣或右心室流出道,并向左、右肺动脉生长、延伸[8]。经胸或食管超声心动图检查可协助诊断PPAS,并有助于了解肉瘤与肺血管瓣膜间的关系,同时可测定肺动脉压,便于综合评估患者心脏扩张或心室流出道梗阻程度。在影像学表现上,PPAS患者的CT平扫主要表现为肺门阴影扩大、单侧或双侧肺动脉近端分支扩张、心影扩大等;CTPA检查主要表现为主肺动脉及左、右肺动脉腔内肿块影,呈息肉状或分叶状膨胀、浸润性生长,病灶连续,肿块内部血供丰富并呈不均匀强化[11]。PTE是由血流冲击及血液纤溶系统综合作用所致,面向血流面常呈“杯口状”改变,血管造影检查表现为密度均匀的充盈缺损[11]。PETCT常用于评估肿瘤的分期、转移、复发和疗效的判定。有研究表明,PET-CT对PPAS具有较高的诊断价值[12]。PPAS可对18-氟脱氧葡萄糖(18-fluorodeoxyglucose,18F-FDG)摄取增加,标准摄取值(standard uptake value,SUV)为(7.63±2.21),而血栓SUV较低,为(2.31±0.41)[13]。MRI具有良好的空间分辨率优势,可较好地显示肺动脉腔内肿块与邻近瓣膜、周围组织的关系。肺动脉肉瘤在T1加权像(T1 weighted image,T1WI)上显示中、低信号,在T2加权像(T2 weighted image,T2WI)上显示高信号,并且表现出异质性增强效果;而血栓多数情况下在T1WI、T2WI上呈高信号,且血栓时期不同,表现出的信号不同[14-15]。肺通气/灌注显像作为一种功能性检查,仅能明确肺血管内有无占位,尚不能明确占位性质。
本例患者为老年男性,以间断咯血为主要临床表现,并呈进行性加重,外院诊断为PTE,给予对症治疗后病情好转出院。但患者出院后仍出现反复咯血,经本院CTPA检查示PTE较前减轻,但左下肺动脉未显影,外加外院增强CT检查示左下肺动脉、左肺门软组织不均匀强化,因此不能排除肺血管肿瘤;鉴于本院超声支气管镜检查下见左肺舌叶开口处有新生物生成,质软易出血,肿瘤转移可能性大;待患者病情平稳后行EBUS-TBNA,病理结果符合肉瘤表现,最终诊断为PPAS伴肺内转移、PTE。
本例患者与既往病例报道不同之处在于其同时合并两种肺栓塞相关性疾病,栓子性质包括瘤栓及血栓。有研究表明,若患者未出现下肢深静脉血栓形成(deep venous thrombosis,DVT),则考虑诊断 PPAS[16-17]。但董帅等[18]报道了 1例PPAS合并下肢DVT患者,与上述结论不符。且本例患者无下肢DVT,但同时存在PPAS与PTE,亦不支持上述结论。考虑本例患者出现血栓、D-二聚体水平升高的原因与肿瘤细胞释放的多种细胞因子增强了血小板活性、直接或间接激活凝血与纤溶过程相关[19],因而PPAS诊断与鉴别诊断仍需根据组织病理学检查而非单纯依赖凝血功能指标或下肢超声检查结果。肿瘤标志物指癌细胞分泌、脱落,或宿主对体内新生物反应而产生并进入到体液或组织中的物质。本例患者虽确诊为PPAS,但肿瘤标志物为阴性,分析原因可能与瘤体中肿瘤细胞数量少、肿瘤生长缓慢等有关,但其具体机制仍有待进一步研究。PET-CT虽对PPAS具有较高的诊断价值[20-21],但仍有部分研究报道了18F-FDG低摄取或无摄取的肺血管肿物经手术证实为肿瘤的案例[22-23],本例患者与之相似。故对于PPAS可能性大但PET-CT检查为阴性结果的患者亦不能排除诊断。
既往临床常采用肺或肺叶切除术、肺动脉内膜剥脱术等外科手术方式取得病理标本,近年经皮血管内活检术及EBUS-TBNA被逐步应用于临床。XIE等[24]研究表明,血管内导管引导钳活检术(catheter guided forceps biopsy,CGFB)对PPAS的确诊率可达75%,但该方法存在肿瘤种植、出血等并发症发生风险[25]。EBUS-TBNA能较好地显示肿瘤位置及其周围血流信号,但考虑PPAS患者常合并肺动脉高压,采用EBUS-TBNA可增加患者肺动脉穿孔、致命性大咯血、窒息等发生风险[26]。BOTANA-RIAL等[27]报道行EBUS-TBNA患者可出现自限性血管壁内血肿及纵隔气肿。而CHAN等[28]报道了1例右肺动脉内非均质性低密度占位并纵隔肿瘤患者,通过EBUS-TBNA直接获取其肺动脉外、纵隔内的病灶组织,最终证实为肺动脉肉瘤,并未出现肺动脉穿刺相关并发症。综上,EBUS-TBNA能否安全、成功地获取病变组织与肿瘤细胞是否发生肺门和纵隔淋巴结转移关系密切。
近年随着EBUS-TBNA日益成熟,目前无绝对禁忌证,但针对肺动脉高压、咯血等肺穿刺相关并发症发生风险较高的肿瘤疑似患者,检查前仍需综合分析其病情,慎重权衡利弊。患者在行EBUS-TBNA前应进行出血风险评估,详细询问患者病史,并进行体格检查,完善血常规、凝血功能等必要的实验室检查,按需调整口服抗凝药及抗血小板药物,备齐抢救设施。术中给予心电监护,密切监测生命体征,动作轻柔,采用支气管腔内超声观察病灶血供情况,并综合影像学检查进一步评估穿刺出血发生风险;另外,在选取穿刺目标时,尽量避免穿刺血供丰富的病灶。针对出血风险较大但需行镜下治疗或镜下穿刺者,可提前建立人工气道如气管插管、硬质支气管镜等,以降低出血、窒息等发生风险,考虑细针活检取到的标本量较少,肿瘤组织的精准取材存在一定难度,故对医师的内镜技术要求较高。此外,EBUS-TBNA风险较大,病情不稳定患者应谨慎使用。
PPAS的肿瘤细胞转移早、患者预后极差,早期症状隐匿,当出现明显症状后生存时间仅为12~18个月[29]。早期诊断、肿瘤完整切除以及合理的辅助治疗是延长患者生存期的关键。外科手术是PPAS首选的治疗手段,可依据肿瘤位置、转移情况及其与周围组织的关系选择不同术式,如肺或肺叶切除术、肺动脉内膜剥脱术、心肺联合移植[30],而姑息性肿瘤减容手术有利于改善患者血流动力学,提高生存质量[31]。目前针对PPAS的放化疗疗效尚不明确,尚无文献证明单纯放化疗能够起到有效治疗。有研究表明,术前辅助放化疗可能缩小肿瘤,使肿瘤更易切除并降低手术相关并发症,同时可延长术后中位生存期至20个月[32]。此外,多靶点酪氨酸激酶抑制剂帕唑帕尼目前已被批准用于软组织肿瘤的二线治疗[33],MDM2抑制剂MI-219及Nutlin-3的抗癌效果正在评估[34],靶向药物在PPAS中的治疗效果还有待进一步研究。
综上所述,PPAS是一种罕见的血管源性恶性肿瘤,无特异性临床表现及影像学表现,极易误诊为PTE,且确诊难度大、预后差,且完整的手术切除和有效的辅助治疗是延长患者生存时间的有效手段。因此,逐步提高对PPAS的认识,尽快明确诊断并给予干预是当前临床医师亟需达到的目标。
作者贡献:康世威、袁雅冬进行文章的构思与设计;康世威进行文章的可行性分析,撰写论文;何平、崔江华进行文献/资料收集,进行英文的修订;宫小薇、何平进行文献/资料整理;宫小薇、袁雅冬进行论文的修订;袁雅冬负责文章的质量控制及审校,并对文章整体负责、监督管理。
本文无利益冲突。

