人主动脉平滑肌细胞体外分离及培养
王 静, 李逸明, 刘 丹, 宋海旭, 闫承慧, 田孝祥
1.北部战区总医院 心血管内科,辽宁 沈阳 110016;2.锦州医科大学研究生院,辽宁 锦州 121001
主动脉疾病包括主动脉夹层和主动脉瘤破裂,急性起病时院内死亡率超过60%[1]。主动脉包括内膜、中膜及外膜三层结构。主动脉平滑肌细胞(smooth muscle cell,SMC)主要位于中膜,是主动脉数量最多的细胞类型之一,对维持主动脉结构和功能完整至关重要[2]。但人主动脉组织难以获得,多数研究采用小鼠或大鼠来源的主动脉SMC替代[3]。这一做法的缺点是忽略了人与啮齿类动物的种属差异,导致很多动物实验结果不能解释人主动脉疾病的发病机制[4]。目前,关于小鼠和大鼠主动脉SMC体外培养的报道较多,而对人主动脉平滑肌细胞(human aortic smooth muscle cell,HAoSMC)的分离及培养的研究较少[5]。本研究旨在探讨HAoSMC的体外分离及培养方法,为阐明主动脉疾病的发病机制奠定基础。现报道如下。
1 材料与方法
1.1 实验材料 人升主动脉组织取自在北部战区总医院接受外科主动脉置换手术的A型主动脉夹层患者。Ⅱ型胶原酶、100×抗生素溶液(每ml含10 000 U青霉素、10 mg链霉素、25 μg两性霉素B)购自美国Sigma Aldrich公司;胎牛血清(fetal bovine serum,FBS)购自浙江天杭生物科技股份有限公司;DMEM高糖培养基、Alexa Fluor 488标记山羊抗小鼠二抗购自美国Thermo Fisher公司;小鼠抗SM α-actin及SM 22α一抗购自美国Abcam公司;一次性细胞培养皿及培养板购自美国Invitrogen公司。本研究方案获得北部战区总医院伦理委员批准,且患者知情同意。
1.2 研究方法
1.2.1 分离人主动脉中膜 将术中得到的人主动脉组织置于含冰的无菌生理盐水50 ml离心管中,然后将其转移至超净台中操作。用无菌镊子夹取主动脉组织至10 mm细胞培养皿中,用含有1×抗生素的冰的无菌磷酸盐缓冲液(phosphate buffer solution,PBS)洗3遍。用弯镊撕掉主动脉内膜,保留中膜。将中膜转移到含有10% FBS的高糖DMEM培养基中,用眼科剪将中膜剪成约2 mm宽的组织条,再将组织条剪成约2 mm长的小块。将组织块转移至50 ml离心管中,静置沉淀。移除培养基。
1.2.2 Ⅱ型胶原酶消化人主动脉中膜并分离SMC 将Ⅱ型胶原酶粉末溶于含10% FBS的DMEM培养基中,使其终浓度为0.15%。用0.2 μm滤器过滤除菌。将沉淀的主动脉中膜组织块重悬于6 ml 0.15% Ⅱ型胶原酶消化液中,并将其转移到10 mm细胞培养皿中。将培养皿置于37℃、5% CO2培养箱中消化。每小时在显微镜下观察消化效果。消化10 h时,终止消化,用1 ml移液枪头反复吹打组织块,直至细胞脱落,组织块明显变小或消失。
1.2.3 培养分离所得SMC 将消化并吹打后的培养液收集至15 ml离心管中,1 000 r/min离心5 min,弃掉上清。重悬于含20% FBS及1×抗生素的高糖DMEM培养基中,并用移液管轻轻吹打,使其成为细胞悬液。将细胞悬疑接种于1个6孔板中,每孔2 ml。1 d后于显微镜下观察细胞生长情况,以后每天观察1次。第3、7、14天时在倒置相差显微镜下拍照记录细胞生长情况。第3天时首次换液,去除未贴壁细胞或组织块。以后根据细胞生长情况每3~5 d换液1次。
1.2.4 HAoSMC免疫荧光染色 将无菌盖玻片置于24孔板中,每孔加入1 ml含20% FBS及1×抗生素的高糖DMEM培养基。取50 μl细胞悬液,加入1 ml培养基中制备细胞爬片。培养第14天吸弃培养基,PBS洗3遍。4%多聚甲醛固定10 min。PBS洗3遍。0.1% Triton X-100通透5 min。PBS洗3遍。5%山羊血清封闭30 min。将小鼠抗SM α-actin及SM 22α一抗(1∶100稀释)分别加到细胞爬片上,4℃孵育过夜。PBS洗3遍。将山羊抗小鼠荧光二抗(1∶100稀释)加到细胞爬片上,室温避光孵育30 min。PBS洗3遍。用0.5 μg/ml DAPI染核1 min。PBS洗3遍。防淬灭荧光封片剂封片。正置荧光显微镜下观察染色情况并拍照。
2 结果
2.1 成功获得人主动脉中膜组织 获得的人主动脉标本中可见内膜、中膜及外膜,且在中膜外侧可见主动脉夹层中形成的血栓(图1a)。主动脉的中膜与内膜贴在一起,用镊子可将内膜完整的剥除,保留中膜(图1b)。通过眼科剪可将主动脉中膜剪成均一的宽度约2 mm的组织条(图1c)。进一步将组织条剪碎,可获得约2 mm×2 mm大小的组织块(图1d)。

图1 人主动脉中膜组织分离及处理
2.2 Ⅱ型胶原酶成功消化人主动脉中膜组织块 0.15%Ⅱ型胶原酶消化到10 h时,镜下可见组织块变疏松,组织块中可分辨出葡萄串样细胞团。此时终止消化,吹打组织,可见消化之前致密均一的白色中膜组织块基本消失,仅剩少量体积较小、较疏松的白色组织块悬浮于胶原酶中。见图2。
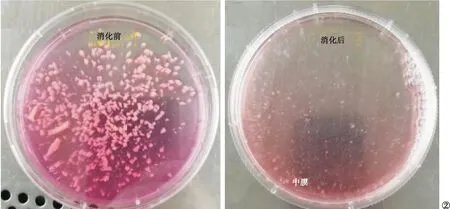
图2 人主动脉中膜组织的胶原酶消化
2.3 HAoSMC培养时的生长特点 在培养1 d时,显微镜下可见贴壁的圆形单个细胞及细胞团;还可见悬浮于培养基中的无细胞基质团块,即SMC从中膜分离之后残留的血管基质骨架。该团块不贴壁,后续可通过更换培养液去除,对细胞生长无影响。在培养3 d时,贴壁细胞展开,从最初的圆形变成梭形。在培养7 d时,大部分贴壁细胞呈长梭形,细胞数量增多。在培养14 d时,细胞数量进一步增加,基本达到融合状态。见图3。
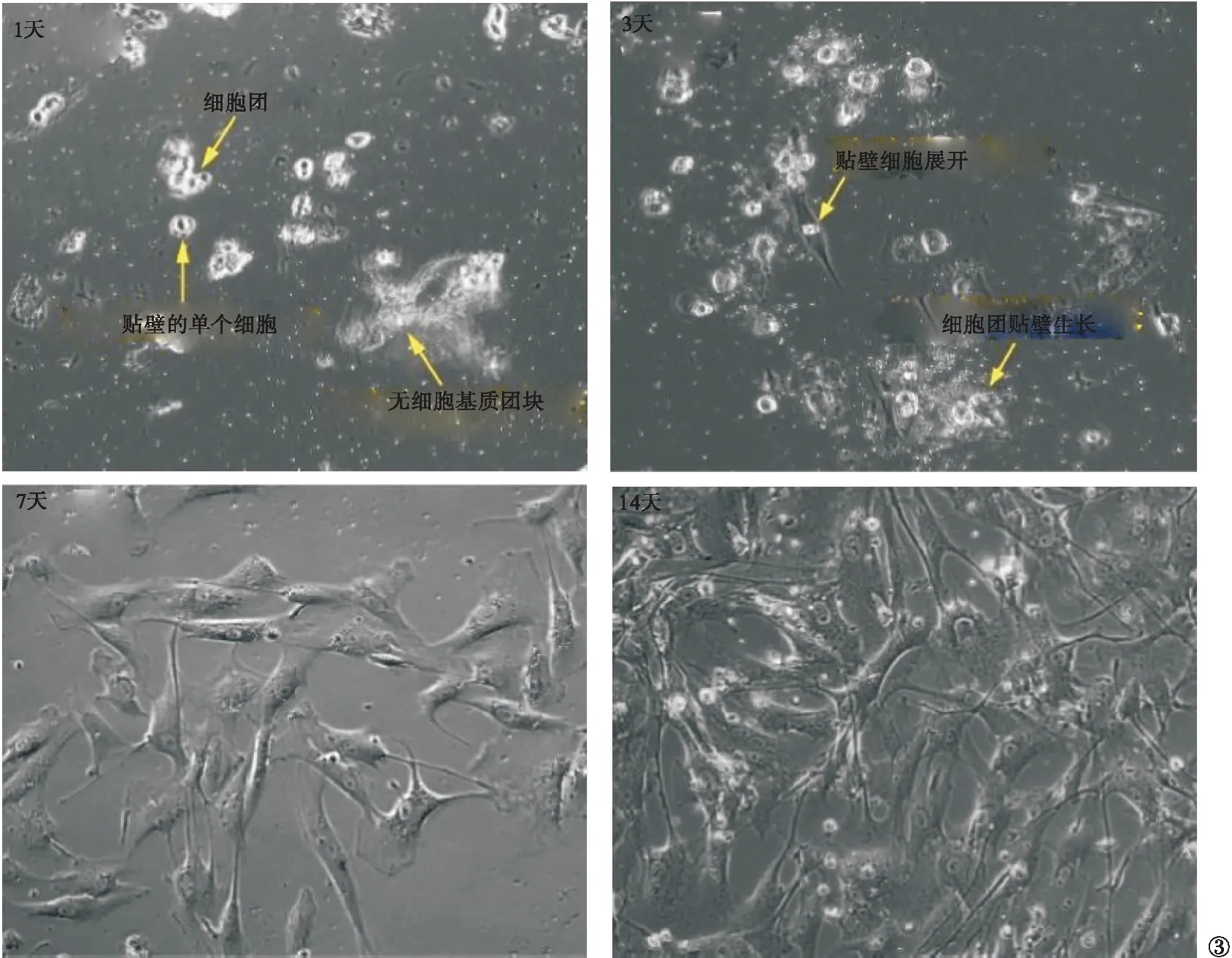
图3 不同时间点HAoSMC生长特点(200倍)
2.4 体外培养HAoSMC标志物染色阳性 对培养14 d的HAoSMC进行SMC标志物SM α-actin及SM 22α免疫荧光染色,发现两种标志物染色均为阳性。SM α-actin及SM 22α主要呈细丝状分布于细胞内。见图4。
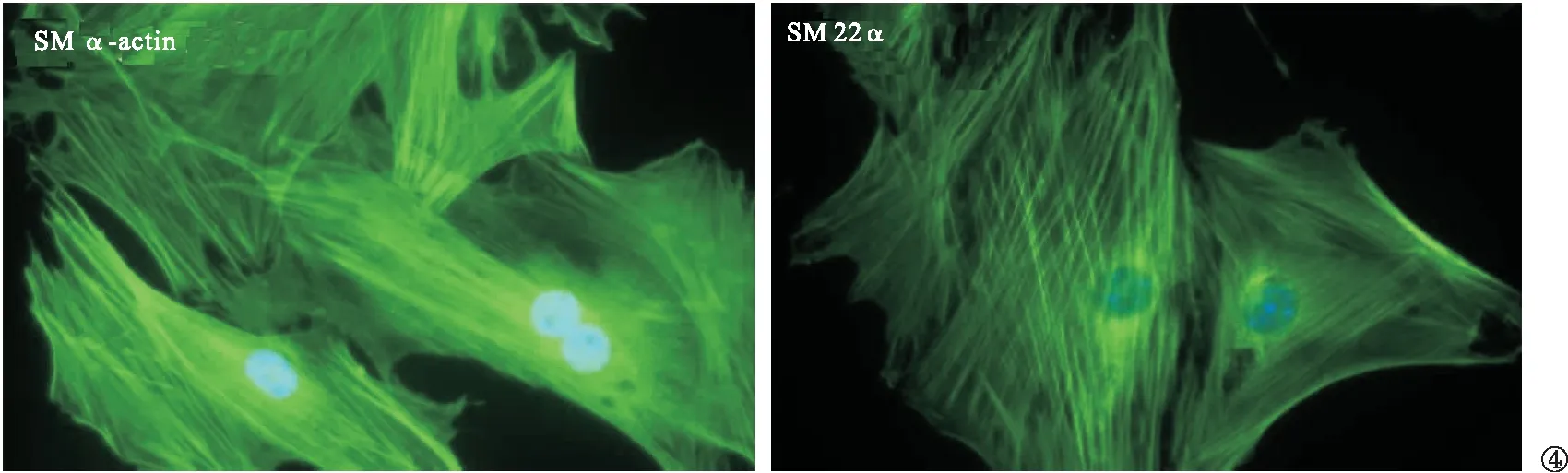
图4 HAoSMC SM α-actin及SM 22α免疫荧光染色(200倍)
3 讨论
在主动脉疾病的基础研究中,多采用小鼠或大鼠主动脉进行SMC分离培养[3,6]。这样做有以下优势:(1)小鼠及大鼠主动脉容易获取,可大量制备;(2)小鼠及大鼠个体差异小,一致性好;(3)小鼠及大鼠主动脉较薄,易处理。但有研究发现,HAoSMC与小鼠、大鼠主动脉SMC具有显著的种属差异[4],对相同的病理刺激可表现为完全不同的生物学行为[7]。因此,大鼠及小鼠主动脉来源的SMC不能替代HAoSMC在主动脉疾病研究中的地位。目前,HAoSMC分离及培养困难主要有以下3个原因:(1)人主动脉来源极其困难,研究人员很难获得正常人的主动脉作为对照,仅能从接受主动脉置换手术的主动脉夹层或破裂的主动脉瘤患者中获得主动脉组织;(2)接受手术的主动脉夹层或主动脉瘤患者大多年龄较大,且存在高血压等多种危险因素,因此,分离得到的细胞易于衰老,个体差异大;(3)人主动脉中膜厚且致密,SMC很难从中迁移出来。
本研究从人主动脉夹层标本中分离出主动脉中膜,这一过程需注意以下4点:(1)原代取材的组织要特别注意防止细菌及真菌污染。本研究在获得组织后,采用含有抗生素的无菌PBS清洗3遍,并在培养基中添加抗生素,抗生素中不仅含有针对细菌的青链霉素,还有针对真菌的两性霉素B。(2)保持细胞活性。本研究在酶消化之前,均采用冰的缓冲液处理组织,以降低细胞代谢过程中的氧化应激损伤。(3)熟练掌握主动脉解剖结构,准确区分外膜及内膜。在剥离内膜时,用镊子撕除即可,不需用剪刀或手术刀锐性分离。(4)在小鼠及大鼠主动脉SMC分离时,要将主动脉组织块剪成或切成1 mm3的小块,但在实际操作中,人的主动脉中膜很难达到这一要求。因为小鼠主动脉中膜约50~100 μm厚,由6~8层SMC及弹力板构成[8-9];大鼠主动脉中膜约100~150 μm厚,由8~10层SMC及弹力板构成[10-11];而人主动脉中膜厚达2~4 mm,由40~50层SMC及弹力板构成[12]。因此,与薄而软的小鼠或大鼠主动脉相比,人主动脉中膜组织厚而致密,韧性很大,很难剪小。
本研究采用胶原酶消化法对HAoSMC进行分离培养。对小鼠及大鼠的主动脉SMC分离培养主要有贴块及酶消化两种方法[13-14]。(1)贴块法[15]:将剪碎的主动脉中膜组织块直接置于培养皿中,保持静止不动,使组织块贴在培养皿底,SMC将在2~3周内从组织块中迁移出来,生长于培养皿底。该方法培养的细胞活性较好、数量多,但需要时间较长。此外,培养过程中对培养皿的轻微晃动可造成组织块脱落,导致培养失败。(2)酶消化法[16]:采用胶原酶、弹性蛋白酶等将中膜组织中的SMC分离出来。该方法分离时间短,仅需24 h即可获得贴壁细胞。由于分离时间短,分离的细胞更贴近在体时的表型。缺点是细胞量较贴块法少。本实验室曾成功用上述两种方法分离得到小鼠及大鼠主动脉SMC。但在尝试采用贴块法分离培养HAoSMC时均以失败告终(未获得细胞)。分析原因,可能与人主动脉中膜厚而韧,难以剪成小组织块,导致组织块不易贴壁、SMC不易从组织块中迁移出来有关。本研究采用的Ⅱ型胶原酶浓度为0.15%,孵育条件为37℃ 10 h。酶浓度及消化时间差异较大,可能原因如下:(1)酶的生产商和品质不同,保存条件也不同,导致酶的活性差异较大;(2)人主动脉组织来源于不同性别、年龄、人种、疾病状态的患者,导致HAoSMC生物学特性差异较大[17-18],影响分离及培养效果。由上可知,即使在消化酶得到良好质控的情况下,主动脉组织的差异也会使HAoSMC的分离培养难有统一标准。因此,在实际研究工作中,应根据患者的不同临床特征,总结HAoSMC分离培养方法的差异和经验。
本研究在接种细胞前未用细胞滤网过滤细胞悬液。细胞滤网的作用是将未消化完全的组织块过滤掉,缺点是可能过滤掉细胞团,降低收获的数量[5]。本研究未用滤网,在接种1 d时发现单个及细胞团均有贴壁,而未过滤掉的大的悬浮团块为无细胞的基质成分,在换液时可轻松弃掉,对细胞生长无影响。在后续的时间点,发现细胞团贴壁后细胞增殖优于单个细胞贴壁。因此,分离HAoSMC时,在充分消化的基础上,不使用细胞滤网可能得到优于使用滤网的效果。
本研究系统观察了HAoSMC的生长特性及标志物表达,结果显示:1 d时细胞贴壁,7 d时细胞成典型的长梭形,14 d时细胞基本达到融合状态;SM α-actin及SM 22α染色均为阳性,且主要呈细丝状分布于细胞内。与既往研究[19-20]一致。
综上所述,本研究采用酶消化法成功从主动脉夹层患者标本中分离并培养出HAoSMC,为进一步阐明主动脉疾病的发病机制奠定了基础。

