HIF-1α激动剂或拮抗剂对脓毒症大鼠肠道黏膜通透性的影响
王玉龙,滕文彬,单 跃,姚刘旭,何 锐,李玉红,祝胜美*
(1.浙江大学医学院附属第一医院 麻醉科, 浙江 杭州 310000; 2.绍兴市人民医院 麻醉科,浙江 绍兴 312000;3.树人大学树兰国际医学院附属树兰(杭州)医院 麻醉科, 浙江 杭州 310004)
脓毒症(sepsis)是机体对感染反应失调导致的危及生命的器官功能障碍[1],是一个公认的全球健康问题,严重威胁人类生命安全。2017年全球统计数据显示[2],sepsis年发病例4 890万例,死亡病例约110万例,死亡率为19.7%;拯救sepsis运动指南为临床管理sepsis患者提供一些列循证医学建议,在sepsis发病机制方面仍然存在很多认识空白[3]。低氧诱导因子(hypoxia-inducible factor, HIF)是人体对适应低氧环境的关键转录因子,在急性低氧反应中发挥关键作用[4]。近年来,肠功能障碍对sepsis结局的影响受到研究者重点关注。Sepsis早期肠上皮细胞低氧能量障碍是肠功能障碍重要诱因,机体可能通过上调HIF-1α,促进能量代谢,改善脓毒性肠道黏膜屏障(intestinal mucosal barrier,IMB)损伤,二甲基乙二酰基甘氨酸(dimethyloxallyl glycine, DMOG)是脯氨酰羟化酶的抑制剂,可以抑制脯氨酰羟化酶从而上调HIF-1α表达;而拮抗剂BAY87-2243作用相反,下调HIF-1α表达。本研究旨在探索HIF-1α激动剂DMOG或拮抗剂BAY87-2243对脓毒症大鼠肠道黏膜通透性作用。为sepsis肠道黏膜屏障功能损伤救治提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物:选择SPF级Sprague-Dawley(SD)雄性大鼠24只,200~250 g[浙江省医学科学院实验动物中心,许可证号:SCXK (浙)2-14-0001]。研究方案经过绍兴市人民医院动物伦理委员会议讨论通过(伦理审批文号:2020-009)。
1.1.2 主要试剂和设备:二胺氧化酶(diamine oxidase, DAO)和肠型脂肪酸结合蛋白2(intestinal type fatty acid binding protein 2, I-FABP/FABP2)试剂盒(Cloud-Clone公司);D-乳酸(D-lactic)试剂盒(Abebio公司);荧光素标记的右旋糖苷(fluorescein isothiocyanate-dextran, FD4)和脂多糖(lipopolysaccharide,LPS)(Sigma-Aldrich公司); HIF-1α、ZO-1(zonula occludens-1)、occludin、claudin-1和GAPDH一抗(Abcam公司);二甲基乙二酰基甘氨酸(dimethyloxaloylglycine,DMOG)和BAY87-2243(MedChemExpress公司);辣根过氧化物酶(horseradish peroxidase, HRP)标记的山羊抗兔IgG(Jackson公司)。SpectraMax Plus全波长酶标仪(上海美谷分子仪器有限公司);ChemiDoc XRS凝胶成像系统和Quantity one 4.6图像处理与分析系统(Bio-Rad公司);R510IP小动物麻醉机(深圳瑞沃德公司)。
1.2 方法
1.2.1 动物的分组及处理:将大鼠随机数字法分为sham组(n=6)、sepsis组(n=6)[用盲肠结扎穿孔(ligation and perforation, CLP)]、(sepsis+DMOG)组(n=6)[CLP术前连续7 d腹腔注射DMOG(40 mg/kg)];(sepsis+BAY87-2243)组(n=6)[CLP术前连续3 d灌胃BAY87-2243(9 mg/kg)]。
1.2.2 标本的采集与处置:大鼠采用七氟烷麻醉后,分离出4 cm小肠,用手术缝线分别结扎肠管两端,将50 μg的FD4,药物配制浓度为100 mg/mL,注入肠管内,1 h后取门静脉0.5 mL,用于测定FD4血浆浓度。之后取腹主动脉血2 mL,低温离心后分装置于-80 ℃保存,用于检测DAO、FABP2、D-lactic血浆浓度。距离盲肠部2 cm处取1 cm回肠组织数段,部分制成蜡块用于形态学研究;部分分装置于-80 ℃存储,用于检测肠黏膜紧密连接(tight junctions, TJs)和HIF-1α蛋白的表达。随后颈椎脱臼法处死大鼠。
1.2.3 HE染色检测大鼠肠黏膜形态学变化:常规HE染色光镜下观察小肠黏膜形态学改变,采用Chiu’s 评分定量判定小肠组织损伤程度。
1.2.4 酶联免疫吸附试验(ELISA)检测DAO、FABP2和D-lactic血浆浓度:按照ELISA试剂盒说明书检测各标本DAO、FABP2和D-lactic血浆表达水平。每个样本和标准品均设3个复孔,获得酶标仪450 nm处吸光值(A),根据吸光值绘制标准曲线,计算各样本DAO、FABP2和D-lactic的含量,取平均值。
1.2.5 FD4浓度的测定:解冻后血浆作1∶8倍稀释,转移到96孔板,每个标本做个复孔,每个孔100 μL。用荧光酶标仪测定FD4血浆浓度。激发波长和发射波长分别设定为490 nm和520 nm。
1.2.6 Western blot测定小肠黏膜TJs和HIF-1α蛋白的表达: 具体操作步骤按常规方法进行。
1.3 统计学分析
2 结果
2.1 HIF-1α激动剂或拮抗剂对sepsis大鼠肠黏膜病理形态的影响
Sham组大鼠肠黏膜完整,绒毛整齐(图1A);Sepsis组膜黏膜完整性破坏,肠绒毛萎缩脱落;(sepsis+DMOG)组大鼠肠绒损伤程度介于sham组和sepsis组之间;而(sepsis+BAY87-2243)组绒毛损伤比sepsis组更严重,甚至出现溃疡。Chiu’s评分与黏膜损伤程度成正比,具体见图1A,B。
2.2 各组大鼠DAO、FABP2、D-lactic和FD4血浆的比较
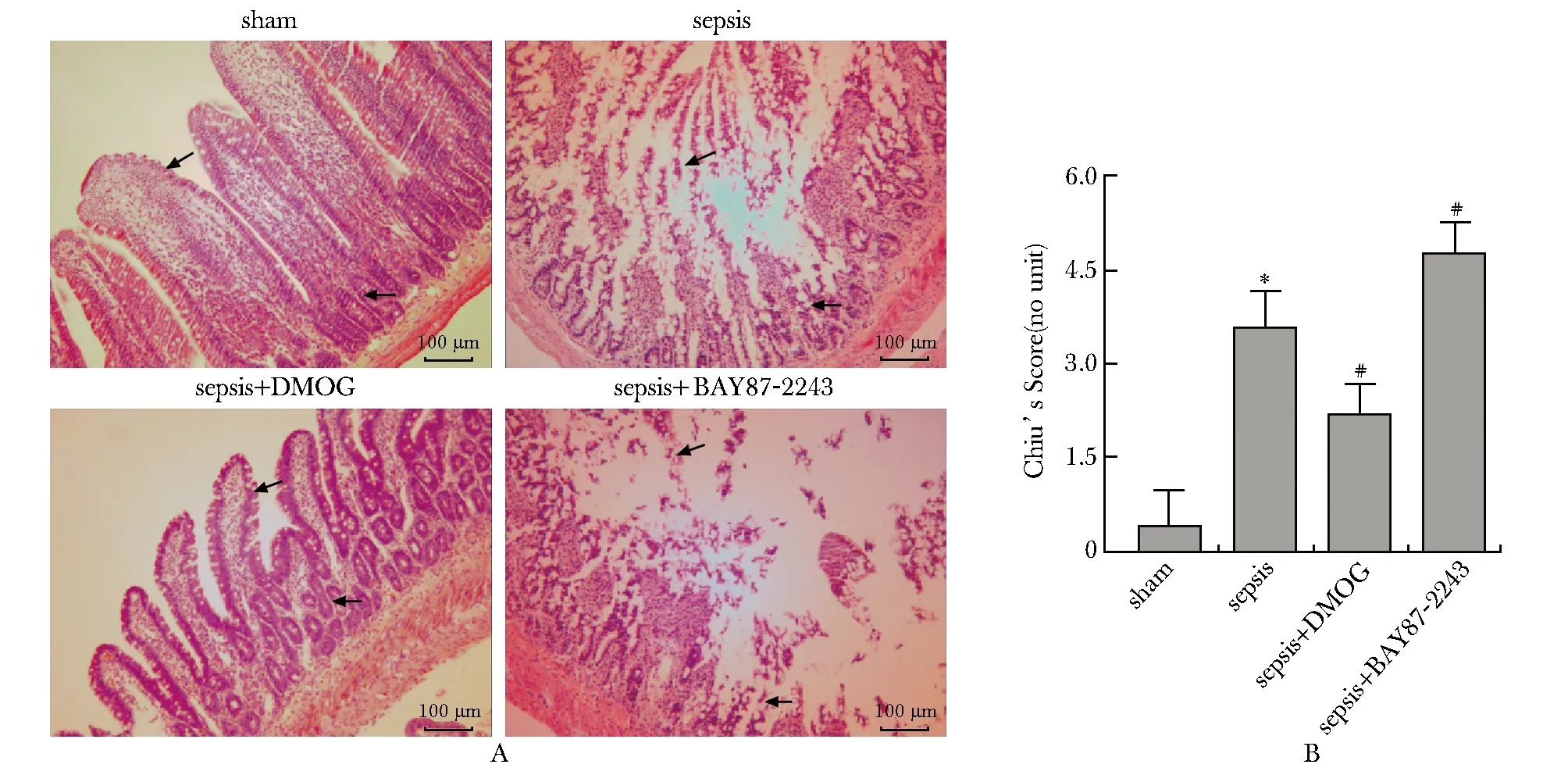
与sham组相比,sepsis组大鼠DAO、FABP2、D-lactic和FD4血浆浓度均增高(P<0.05)(图2A~D)。与sepsis相比,(sepsis+DMOG)组DAO、FABP2、D-lactic和FD4血浆浓度均明显降低(P<0.05)(图2A~D);(sepsis+BAY87-2243)组大鼠DAO、FABP2、D-lactic和FD-4血浆浓度均显著升高(P<0.05)(图2A,D)。
2.3 各组大鼠肠黏膜组织TJs和HIF-1α表达的比较
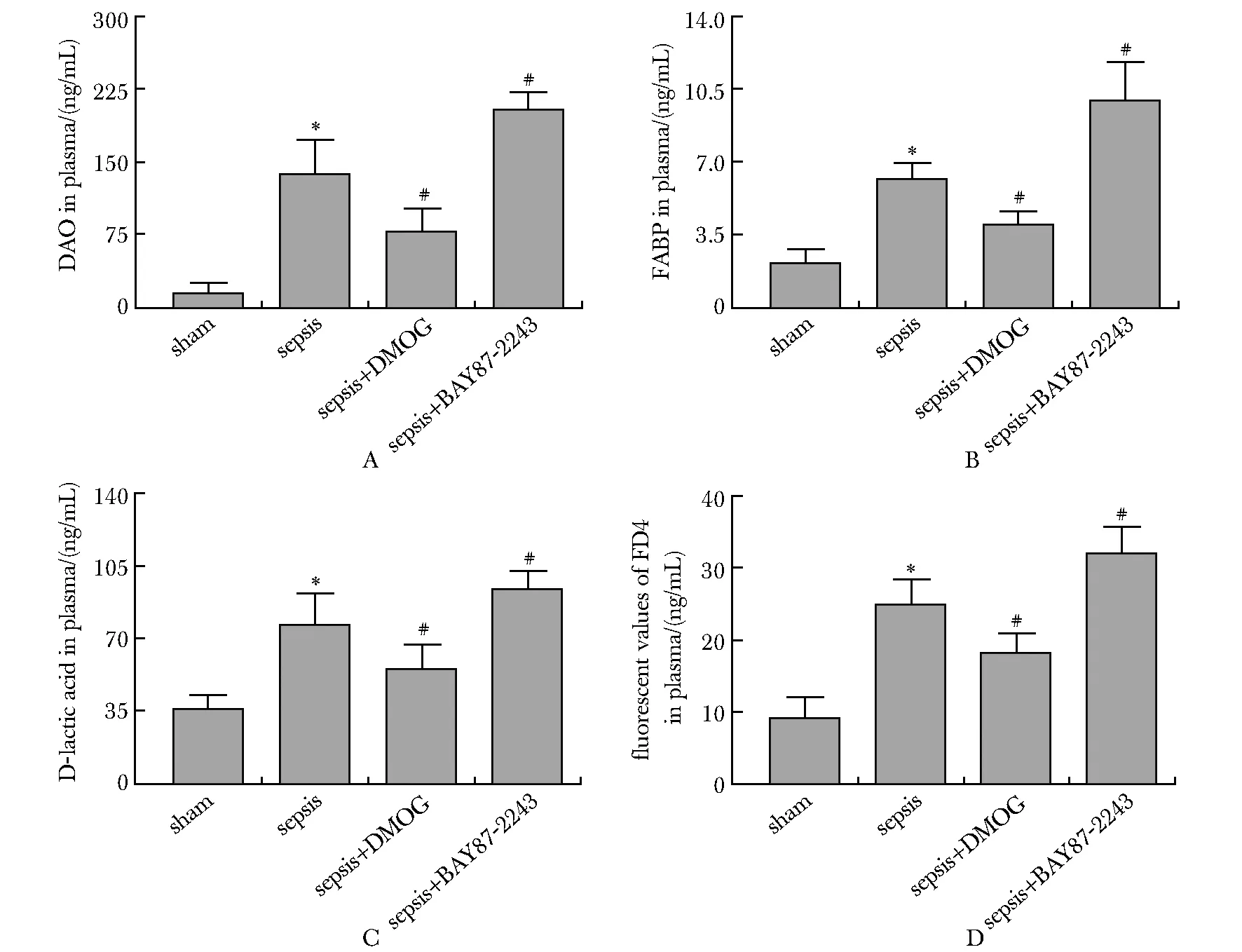
与sham组相比,sepsis组大鼠肠黏膜组织中HIF-1α的表达水平上调(P<0.05)(图3A,B),而TJs蛋白(ZO-1、occludin和claudin-1蛋白)的表达水平明显下调(P<0.05)(图3A,C~E)。与sepsis相比(sepsis+DMOG)组肠黏膜组织中HIF-1α、ZO-1、occludin和claudin-1蛋白的表达均显著上调P<0.05);而(sepsis+BAY87-2243)组相反,肠黏膜组织中上述蛋白表达水平均下调(P<0.05)(图3,表1)。
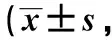
表1 HIF-1α激动剂或拮抗剂对大鼠肠黏膜HIF-1α和TJs蛋白表达的影响
A.images of intestinal morphology, the pathological status of intestinal mucosal barrier villi and lamina propria in the treated animals was shown at the arrow (HE staining,×200); B.intestinal mucosa injury was quantitative assessed by Chiu’s Score; *P<0.05 compared with sham group; #P<0.05 compared with sepsis group
*P<0.05 compared with sham group; #P<0.05 compared with sepsis group图2 HIF-1α激动剂或抑制剂对大鼠血浆DAO(A)、FABP2(B)、D-lactic(C)和FD4(D)的影响
3 讨论
Sepsis是一种危及生命的临床综合征,可导致自身组织和器官损伤,引起多个器官功能障碍[1]。危重患者肠道致病菌过度繁殖,肠黏膜受损,细菌毒素进入血循环,进而发展为全身性炎性反应综合征(systemic inflammatory response syndrome,SIRS)或多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS),因此,肠道是sepsis的“启动器官”。Sepsis中,肠黏膜微循环障碍,肠道黏膜屏障受损;通过肠道-淋巴通路使肠功能衰竭进一步恶化,肠道又是sepsis的“中心器官”[5]。
DAO和FABP2在肠黏膜细胞中表达, 肠黏膜损伤细胞脱落时,快速释放进入血循环,可以作为肠黏膜损伤的特异性标志物[6]。D-lactic是肠道细菌的代谢产物, 肠黏膜损伤致通透性增加时,D-lactic入血,哺乳动物不能代谢D-lactic,因此,血D-lactic浓度增加间接反映肠道通透性增加[6]。FD4是肠道通透性和肠道屏障改变的标志物[7]。本研究中,sepsis大鼠上述血浆标志物均升高,提示sepsis导致大鼠肠黏膜损伤,通透性增加。
TJs是维系细胞间链接与细胞屏障的重要组成部分。Occludin维持肠道物理特性,具有黏附功能;claudin-1形成细胞旁离子的选择性通道,影响着细胞间物质渗透率[8];ZO-1与多种细胞骨架蛋白绑定,对TJs起到支撑骨架作用[9]。本研究中,sepsis大鼠肠黏膜组织中TJs相关蛋白ZO-1、occluden、claudin-1的表达水平下降,病理形态破坏,提示sepsis导致大鼠肠黏膜形态结构破坏。
生理状态下,肠上皮细胞暴露于“生理性低氧”环境中,低氧环境是肠道共生菌生存的物质基础,并促进肠道物质运输[10];炎性反应时,氧耗增加、血管收缩导致氧供降低,肠上皮细胞出现缺氧[11]。本研究中,sepsis大鼠肠黏膜中HIF-1α表达明显增加,明显高于正常组,提示sepsis造成肠黏膜细胞缺氧,黏膜细胞通过自身代偿性HIF-1α的表达上调,以提高对缺氧的耐受并促进增殖维护肠道黏膜屏障的完整。既往研究使用HIF-1α激活剂明显减轻CLP引起小鼠肾脏损害[12]。在结肠炎小鼠中,HIF-1α激活剂AKB-4924能增强小鼠肠黏膜屏障功能,但是对HIF-1α缺陷小鼠无肠黏膜保护作用,表明肠黏膜HIF-1α是AKB-4924介导保护的组织靶点[13]。肠道HIF-1α敲除小鼠加剧肠酒精性肠道黏膜屏障的破坏[14]。通过敲除和过表达实验发现HIF在基因启动子水平上对claudin-1的表达起着基本的调节作用,揭示claudin-1可能是HIF的一个重要靶基因,HIF缺陷型肠黏膜claudin-1表达异常,导致TJs形态异常[15]。本研究中给予sepsis大鼠DMOG,sepsis大鼠肠道HIF-1α和TJs相关蛋白的表达上调,肠道黏膜损伤缓解。而给予BAY87-2243,出现HIF-1α和TJs相关蛋白表达下调,肠黏膜损伤缓解加重。
A.expression bands; B-E.protein expression of HIF-1α, ZO-1, occudin, and claudin-1; *P<0.05 compared with sham; #P<0.05 compared with sepsis
综上所述,sepsis时大鼠肠道黏膜屏障的结构和功能受到严重破坏,黏膜细胞通过自身调节HIF-1α表达上调。给予HIF-1α激动剂DMOG通过降低肠黏膜通透性,调节TJs中claudin-1而发挥保护肠道黏膜屏障作用,缓解脓毒引起的肠道黏膜屏障损伤作用;而给予HIF-1α抑制剂BAY87-2243,作用相反。结果提示HIF-1α对sepsis大鼠通过降低肠黏膜的通透性,发挥对脓毒症肠黏膜损伤具有保护作用,具体机制有待于进一步探索。

