有限取样法估算中国肾移植患者单个核细胞内他克莫司的暴露量*
王曦晗,邵 琨,安会敏,周佩军,陈 冰**
上海交通大学医学院附属瑞金医院 1药剂科;2 移植中心,上海200025
他克莫司(tacrolimus,TAC)是一种常用的免疫抑制药物,目前已逐步替代环孢素成为主要使用的钙调磷酸酶抑制剂。它在临床上常与霉酚酸和皮质类激素合用、广泛用于肾移植术后的免疫抑制治疗。TAC 的生物利用度个体间差异较大,受肝脏和小肠首过效应及红细胞比例和血红蛋白浓度的影响,TAC 的生物利用度可以从5%到90%,并且有着狭窄的治疗窗口[1]。为了减少TAC 的肾毒性,提高其有效性,在常规进行治疗药物浓度监测的基础上进行个体化给药是合理的手段。临床上多对TAC 全血谷浓度进行监测,但谷浓度合适范围内的患者仍然存在毒性或排斥反应,这说明全血谷浓度与药效学指标或毒性发生之间的相关性存在争议[2]。
近年研究发现约90%以上TAC 在进入体循环后与红细胞结合;但只有少量药物能进入淋巴细胞而发挥免疫抑制作用,外周血单个核细胞(PBMC)内TAC的变化可能是更好的监测指示[3]。Capron A 等[4]研究了96 例肾移植患者的细胞内TAC 浓度,发现急性排斥反应的发生率与低水平的细胞内TAC 浓度之间存在关联性。在另一项针对肝移植患者的研究中,移植后一周出现临床排斥反应的患者TAC 的PBMC浓度明显低于未出现排斥反应的患者[5]。TAC 在体内的暴露量能更好地反映药效与毒性。药时曲线下面积(AUC)被认为是目前反映药物暴露量的一个最佳标志[6]。精准计算AUC 需要在服药期间采集大量的标本(8~12 个采血点),但是这在临床实践中较为困难。有限取样法(limited sampling strategy,LSS)的策略,通过采集少量标本(2~4 个采血点)可对AUC0~12h进行较准确地估算[7]。基于以上观点,本研究拟通过利用多元线性回归法,建立一个LSS 模型,用于估算中国肾移植患者PBMC 内TAC 的AUC0~12h,以达到优化个体化给药的目的。
1 材料和方法
1.1 对象与方案
选择2017~2018 年在本院器官移植中心进行肾移植的患者,术后均采用TAC+霉酚酸+皮质类激素的三联免疫抑制方案:术后口服TAC(商品名:乐可复,安斯泰来制药)0.1 mg·kg-1·d-1,每日2 次,调整剂量使谷浓度维持在10~13 ng·mL-1;术前6 h 内口服霉酚酸酯(商品名:骁悉,瑞士诺华制药)1000 mg,术后每日1000 mg、给药2 次,并根据患者霉酚酸暴露量调整剂量;术中使用甲泼尼龙500 mg iv gtt,术后第1~7 天将甲泼尼龙280 mg 逐渐递减至40 mg iv gtt,以后改用口服泼尼松20 mg·d-1。术后达稳态采集患者服用TAC 后全血分离PBMC。
试验方案获本院附属瑞金医院伦理委员会批准,并签署患者知情同意书。
1.2 材料和仪器
他克莫司对照品(批号:20111101,纯度:98%)和内标子囊霉素标准品(批号:20111117,纯度:98.5%)均购于大连美仑生物技术有限公司;人外周血淋巴细胞分离液(批号:10291481)购于通用电气医疗集团(GE 医疗生命科学部);20×PBS 缓冲液(批号:FC16KA4123)购自生工生物工程(上海)股份有限公司;甲醇、乙腈(色谱级)购自Tedia(费尔菲尔德,美国);甲酸铵为分析纯。
API 4000 型三重四级杆质谱仪(美国Applied Biosystems 公司),配备电喷雾离子化源(ESI);UFLC色谱系统(日本岛津公司);BS224S 型万分之一精密天平(德国Sartorius 公司);Eppendorf 5804R 台式高速冷冻离心机(德国Eppendorf 公司)。
1.3 患者PBMC 样本采集
肾移植术后2 周,患者达到稳态。在服药前和服药后0、0.5、1、1.5、2、4、6、8、10、12 h 经肘静脉采血3~5 mL 置于EDTA 抗凝管中,采用梯度密度离心法,收集各个时间点患者PBMC,细胞计数后置于-80 ℃冰箱冷冻保存。
1.4 样本测定
患者PBMC 内TAC 的浓度采用前期建立的LC-MS/MS 法进行检测。色谱条件:采用Zorbax C18色谱柱(50 mm×2.1 mm,3.5 μm)[8];流动相:由A 相(2 mmol·L-1甲酸铵水溶液)与B 相(2 mmol·L-1甲酸铵甲醇溶液)组成,A 相与B 相比例如下:20%B(0~0.5 min),20%~100%B(0.5~1.5 min),100%B(1.5~5min),100%~20%B(5~6min)和20%B(6~7min);柱温:40 ℃;流速:0.35 mL·min-1。
质谱条件:采用电喷雾离子化电离源(ESI),正离子方式检测;离子喷射电压:5500 V;离子源温度500 ℃;GS1 压力:275.79 kPa;GS2 压力:275.79 kPa;扫描方式为多重反应监测(MRM);TAC 和子囊霉素的离子对分别为m/z 821.7 →m/z 768.5 和m/z 809.6→m/z 756.5;解簇电压(DP)分别为:101.7 eV 及97.7eV;碰撞能量(CE)分别为:10.6 eV 及10.5 eV。碰撞室射出电压(CXP)分别为:10.7 V 和10.4 V。
该方法经过体内药物分析方法学指标的验证,结果均满足生物样本的检测要求。
1.5 药动学参数计算
采用WinNonlin 软件以非房室法计算TAC 药动学参数。依据线性梯形法则计算用药后0~12 h 患者PBMC 中TAC 的AUC,Cmax、Tmax和AUC0~12h均为实际测量值。
1.6 LSS 模型的建立和验证
依据线性梯形法则计算用药后0~12 h 患者PBMC 中TAC 的药-时曲线下面积AUC0~12h的实测值。采用SPSS 25.0 和SAS 9.13 软件对数据进行统计分析,结果表示为平均值±标准差();P<0.05为差异具有统计学意义。
采用逐步多元线性回归分析(MRA)方法估算TAC PBMC 内AUC0~12h的模型方程,以决定系数r2最大为最优准则。以1~4 个点的TAC 的PBMC 内浓度作为自变量,以AUC0~12h为因变量,按照下面公式估算TAC 的AUC0~12h确定TAC AUC0~12h简化计算模型方程:
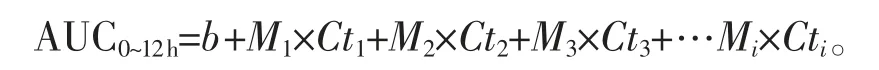
其中,b 为截距,Mi为偏相关系数,Cti为采样时间点为ti时PBMC 内的TAC 浓度。
预测误差(prediction error,PE)和绝对预测误差(absolute prediction error,APE)计算公式如下(式1 和式2),其中AUC(0~12)Obs和AUC(0~12)Est分别表示为AUC0~12h的观测值和估算值。并计算平均预测误差(MPE)表示模型的准确度(式3),计算平均绝对预测误差(MAPE)代表模型的精密度(式4)。MPE与MAPE 值应分别小于10%和15%[9]。另外采用Bland-Altamn 方法评估AUC0~12h观测值和AUC0~12h估算值之间的一致性,其界限表示为x±1.96 SD。

2 结果
2.1 患者的基本信息
本研究共纳入了23 例肾移植术后患者,其中女性为9 人,男性14 人。患者基本特征见表1。23例肾移植患者经多次给药达稳态后的药-时曲线见图1。AUC0~12h(23.18±14.52)ng·h/million PBMC,C0(1.28±0.88)ng/million PBMC,Cmax(3.73±2.31)ng/million PBMC,Tmax(4.79±3.08)h。TAC PBMC 和全血中谷浓度的相关性较弱(r2=0.1567,P=0.056)。
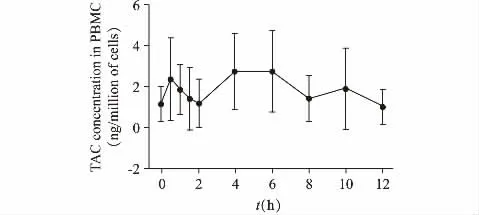
图1 中国肾移植患者TAC PBMC 内的药物浓度-时间曲线
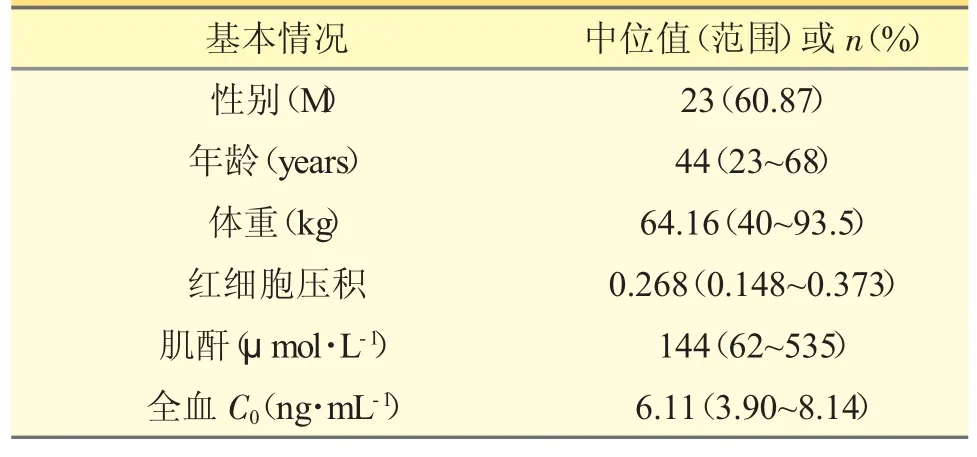
表1 24 例肾移植患者的基本情况和实验室检查
2.2 有限取样模型的建立
以梯形法计算患者实测TAC 的AUC0~12h,利用多元线性回归拟合1~4 个采血点TAC 之AUC0~12h估算模型,筛选出决定系数r2较大的不同采血点的模型1~17,结果见表2。然而发现C0与AUC0~12h之间的相关性并不好(r2=0.570),模型引入峰浓度的影响(C0h-C6h)后相关性有所改善(r2=0.820);但并未达到预测标准(MPE=2.48±19.71,MAPE=17.03±9.37)。相比于单点法或二点法,三点法或四点法相关性更好,且误差较小。结合临床因素和r2最大、最优原则,最终选择相对最优模型作后续评价。

表2 多元线性回归法估算细胞内TAC AUC0~12h 的LSS预测模型
2.3 模型的方案评价
采用Bland-Altman 分析方法评价4 组模型AUC0~12h观测值和AUC0~12h模型预测值之间的一致性(见图2)。从图2 中可看见模型4、9、14、17 的观测值与预测值的差值多数在观测值的2 个SD 以内,说明模型的预测误差较小。进一步通过bootstrap分析对所得到的LSS 模型进行验证,该分析是从原始数据集中生成1000 个复制数据集,用于评价不同模型的稳定性及参数估算的准确性(见表3)。从这些数据上看,平均值和95%CI 与原始数据集的估算参数具有可比性。结果表明,所选择的模型在准确性和稳定性方面都是可以接受的。
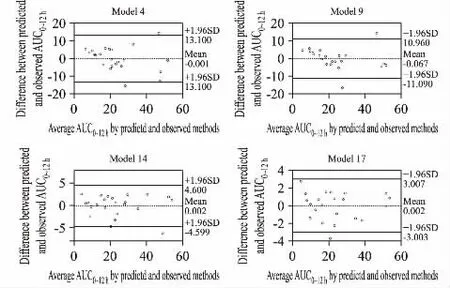
图2 Bland-Altman 分析法评价模型4、9、14、17 估算的
TAC AUC0~12h观测值和AUC0~12h估算值间的一致性
3 讨论
对于接受TAC 治疗的患者而言,维持一个合适的药物水平以避免移植后排斥反应的发生和药物相关的毒性作用是至关重要的。虽然有些研究已成功建立了TAC 全血AUC0~12h有限取样模型[10、11]。循环内大部分的TAC 都与红细胞结合,由于受到患者个体间红细胞压积的差异(31%~49%)及红细胞药物结合能力差异等因素的影响[12],全血中TAC 不同患者之间差异较大[13]。TAC 通过抑制淋巴细胞内CaN活性,进而影响T 细胞活性,达到免疫抑制的效果。因此与全血浓度相比,淋巴细胞内药物浓度可能与药物疗效联系更为紧密。T 淋巴细胞是PBMC 的重要组成部分,其中CD4+T 细胞占PBMC 的60.2%[14]。评估淋巴细胞内TAC 需要一个复杂的提取过程,而PBMC 可以作为监测的首选基质;但基于TAC 的PBMC 内的有限取样模型尚未见报道。有共识表明,对于TAC 全血AUC0~12h而言,维持150~200 ng·mL-1·h-1[15]。但目前TAC PBMC 的药动学结果之间研究有限,AUC0-12h范围与临床之间的关系还不完全清楚。监测全血谷浓度是临床上估算全血中TAC 暴露量的常规做法;但是发现在PBMC 中,C0与AUC0-12h之间仅存在中等相关(r2=0.570),且预测值存在较大的偏差,表明C0只是AUC0~12h的部分反映。随着更多取样点的加入,模型的预测的精密度和准确性更好,因为包含更多的取样点的模型提供了更大的相关性。对此也分析了包括1~4 个不同时间采样点的LSS 模型,结果表明,1、2、3、4 个采样点分别以C6h(r2=0.787 0)、C0.5h-C6h(r2=0.849 0)、C2h-C4h-C6h(r2=0.974 0)、C2h-C4h-C6h-C10h(r2=0.989 0)为最佳模型。TAC 峰浓度附近采样点例如C4h和C6h对模型的预测至关重要。模型方程14(C2h-C4h-C6h)和17(C2h-C4h-C6h-C10h)优于其他,选取其他采样时间点的包含3或4 时间点的模型方程。模型方程14 和17 的MPE和MAPE 分别为-0.00±10.24%与0.00±8.24%,7.82±6.38%与6.08±5.40%。需要注意的是,特别是对于门诊随访的患者而言,给药后10 h 采集标本并不方便。因为模型方程14(C2h-C4h-C6h)和17(C2h-C4h-C6h-C10h)具有更为准确的预测性能,可能对依赖于准确估算PBMC 内TAC AUC0~12h来调节剂量的住院患者具有更大的价值。C0.5h-C6h也有较好的精确度和较低的偏差(MAPE<10.57%,76.47%的预测PE 值在±15%范围内)。这个模型可能更适合需要在较短时间内采集标本的门诊随访患者。
本研究尚存在着一些缺陷,首先仅有23 例完整药-时曲线标本,数据并没有分成模型组和验证组。其次,LSS 模型建立是基于接受包括TAC 在内的三联免疫抑制治疗,没考虑无合并类固醇患者的药代动力学特点。有研究表明,糖皮质激素可能会通过影响细胞色素3A 或p-糖蛋白,而影响TAC 的暴露;但是,糖皮质激素对PBMC 内TAC 药代动力学的影响还仍然未可知。尽管存在这些局限性,本研究已清楚地表明,与监测TAC 谷浓度相比,有限取样模型在预测TAC 暴露量方面可能更为准确。
4 结论
综上所述,本研究成功建立了基于少量取样点的可靠的多元回归分析,估计TAC 的PBMC 内AUC0~12h的LSS 模型。内部验证法证明:该方法在取样时间方面有更好的灵活性,且具有较好的精密度和准确度,估算方程简单,适用于临床上操作和推广。

