131I治疗Graves病后甲状腺功能及骨代谢水平的变化及相关性分析
文晓琴 高海波 黎心四 李鹏 杨凭飞 张西 欧阳良 张雅薇
[关键词] 131I;Graves病;骨代谢;甲状腺功能
[中图分类号] R581.1 [文献标识码] A [文章编号] 1673-9701(2021)23-0021-04
Changes and correlation analysis of thyroid function and bone metabolism after 131I treatment of Graves disease
WEN Xiaoqin1 GAO Haibo2 LI Xinsi1 LI Peng1 YANG Pingfei1 ZHANG Xi1 OUYANG Liang1 ZHANG Yawei2
1.Department of Nuclear Medicine, Pingxiang People′s Hospital in Jiangxi Province, Pingxiang 337000, China; 2.Department of Endocrinology, Pingxiang People′s Hospital in Jiangxi Province, Pingxiang 337000, China
[Abstract] Objective To observe and analyze the changes of thyroid function and bone metabolism related indexes in patients with Graves′ disease after 131I treatment, and to evaluate the efficacy of 131I in the treatment of Graves′ disease. Methods A total of 120 Graves patients who were treated with 131I in our hospital from June 2017 to January 2019 were retrospective enrolled as the treatment group. Another 60 normal physical examination center of our hospital during the same period were selected as the control group. The serum of the treatment group before treatment, 1, 3, 6, and 12 months after treatment and the control group were collected. Chemiluminescence method was used to detect changes in the expression levels of serum bone metabolism indexes (TP1NP, β-CrossLaps, N-MID, PTH, Ca2+) and various thyroid function indexes (FT3, FT4, TSH, TRAb). Results Compared with the control group, the treatment group had significant differences in thyroid function indexes (FT3, FT4, TSH, TRAb) and bone metabolism indexes (TP1NP, β-CrossLaps, N-MID, PTH, Ca2+) before treatment (P<0.05, P<0.01). Thyroid and bone metabolism index in the treatment group tended to be normal after 131I treatment for one year(P<0.01). The results of multivariate correlation analysis showed that the thyroid function index was significantly related to the patients′ BMI, alcohol abuse, and bone metabolism index. Conclusion 131I treatment can effectively improve the thyroid function and bone metabolism in Graves patients. The changes in bone metabolism should be detected in time during treatment to reduce the risk of osteoporosis and fractures in patients with Graves disease.
[Key words] 131I; Graves disease; Bone metabolism; Thyroid function
Graves病,又稱毒性弥漫性甲状腺肿,属于临床内分泌类中的常见病和多发病,是一种器官特异性自身免疫性疾病,具有高代谢、弥漫性甲状腺肿大和突眼三大特点,本病多见于女性,其发病率约为男性的5~10倍[1]。其主要病因多为甲状腺滤泡上皮细胞分泌过多的甲状腺激素,进入血液循环从而导致甲状腺毒症,也是导致甲状腺功能亢进的主要原因[2-3];血液中过多的甲状腺激素可以导致骨代谢的紊乱,引起骨量丢失甚至出现骨质疏松[1,4-5],进而降低患者的生活质量,及时采取有效的措施加以治疗干预至关重要[6]。目前,131I是治疗Graves病的主要方法之一,被认为是最成熟、最广泛的典型治疗方法[7]。大量文章报道131I治疗Graves病患者的临床疗效,发现131I治疗Graves病能缩短病程、安全有效、无明显副作用[8-9]。然而131I治疗对Graves病患者骨代谢的影响目前较少有文献报道。本文拟观察131I治疗Graves病后血清中骨代谢指标(TP1NP,β-CrossLaps,N-MID,PTH,Ca2+)含量及各甲状腺功能指标(FT3,FT4,TSH,TRAb),并与正常体检者进行对比,探讨临床131I对骨代谢异常的Graves病患者的治疗意义,现报道如下。
1 资料与方法
1.1 一般资料
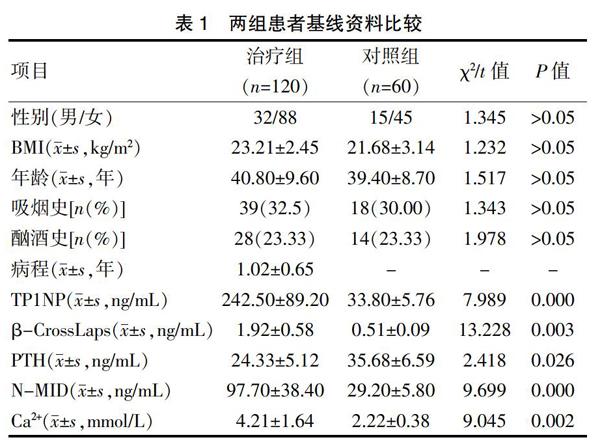
回顾性收集2017年6月至2019年1月于我院治疗的Graves病患者120例,所有患者均通过检测甲状腺相关指标和影像学确诊后,作为治疗组。同时回顾性收集同期于我院体检中心检查的正常体检者60例作为对照组。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。
1.2 治疗组患者纳入及排除标准
纳入标准:①符合《中国甲状腺疾病诊治指南》中指定的标准[10];②患者对治疗内容知情并签署治疗知情同意书;③无其他内分泌系统疾病。排除标准:①伴有严重心肝肾等重要脏器功能不全或恶性肿瘤患者;②妊娠、哺乳期妇女。
1.3 方法
治疗组患者均予以131I治疗,131I治疗剂量=(每克甲状腺组织剂量×甲状腺质量)/24 h摄碘率。收集患者治疗前及治疗后1、3、6、12个月外周静脉血3 mL,离心3 min后取上清备检。同时收集对照组外周静脉血,离心后取上清备检。采用化学发光法检测血清中甲状腺功能指标(FT3、FT4、TSH、TRAb);全自动生化分析仪检测血清骨代谢指标(TP1NP、β-CrossLaps、N-MID、PTH、Ca2+)指标变化。所有检测均有我院检验科完成,全自动生化分析仪为日立HICTHI-7080,化学发光分析仪为罗氏Cobas 601电化学发光免疫分析仪。
1.4 统计学方法
使用SPSS 22.2统计学软件对数据进行分析,计量资料用均数±标准差(x±s)表示,两组间比较采用t检验,计数资料以[n(%)]表示,多组间比较采用单因素方差分析(One-way ANOVA),组间两两比较用LSD法,相关性分析应用Pearson相关系数进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 两组一般资料比较
本研究共回顾性收集符合纳排标准患者120例,其中治疗组中男32例,女88例;对照组中男15例,女45例。治疗组平均年龄(40.8±9.6)岁,对照组平均(39.4±8.7)岁,两组患者基线资料比较,差异无统计学意义(P>0.05),具有可比性。采用化学发光法检测两组患者血清中骨代谢指标(TP1NP、β-CrossLaps、N-MID、PTH、Ca2+)表达水平。与对照组比较,治疗组在治疗前血清中TP1NP、β-CrossLaps、N-MID、Ca2+均呈明显高表达(P<0.01),PTH呈低表达(P<0.05),提示Graves病患者(治疗前)骨代谢明显加速。见表1。
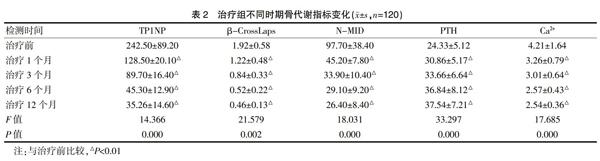
2.2 治疗组不同时期骨代谢指标变化比较
治疗前及治疗后1、3、6、12个月血清中骨代谢指标表达情况比较,与治疗前比较,予以131I治疗后可以显著降低血清中TP1NP、β-CrossLaps、N-MID、Ca2+含量,提高PTH表达,差异有统计学意义(P<0.01),且随时间变化逐渐降低。见表2。
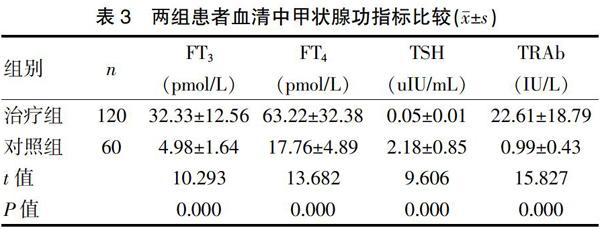
2.3 两组血清中甲状腺功能指标比较
收集治疗组与对照組血清中甲状腺功能指标(FT3,FT4,TSH,TRAb)表达水平,治疗组治疗前血清中FT3、FT4、TRAb表达水平均显著高于对照组,而TSH则显著低于对照组(P<0.01)。见表3。
2.4 治疗组不同时期甲状腺功能指标变化比较
检测治疗组治疗前后不同时期甲状腺功能指标改善情况,与治疗前比较,予以131I治疗后可以显著降低血清中FT3、FT4和TRAb含量,促进TSH表达(P<0.01),差异有统计学意义,且随时间变化逐渐降低。见表4。
2.5 甲状腺功能指标与骨代谢指标相关性分析
采用多元线性相关分析对131I治疗Graves病甲状腺功能指标与患者基线资料及骨代谢指标之间进行相关性分析,甲状腺功能指标(FT3、FT4、TSH、TRAb)相关的因素有BMI、酗酒以及骨代谢指标(TP1NP、β-CrossLaps、N-MID及PTH),说明131I治疗Graves病甲状腺功能与患者BMI、酗酒呈明显相关性。而随着甲状腺功能逐渐好转,患者血清中骨代谢指标也逐渐趋于恢复正常。见表5。
3 讨论
Graves病是一种内分泌系统疾病中的常见病和多发病,以突眼、弥漫性甲状腺肿、神经精神症状、器官高代谢症候群及甲状腺激素过量分泌为主要病征,多见于30~60岁人群,发病率约为0.5%~3.0%[11]。此外,Graves病还是导致甲亢的主要原因之一,流行病学结果显示,有高达80%的甲亢是因为Graves病导致的[3]。甲状腺激素对全身骨骼代谢是至关重要的,其不仅参与骨的正常生长、成熟,对于成熟骨组织的更新、重建也起着重要作用。而Graves病可以导致甲状腺激素过量的分泌,从而加速骨更新过程,骨组织吸收大于骨形成,导致骨钙含量降低,进而引起骨质疏松甚至骨折[12-13]。
临床上对于Graves病的治疗一般包括抗甲状腺药物治疗、辅助治疗和加强营养的生活治疗等[14]。抗甲状腺药物以硫脲类化合物为主,此方法是内科治疗中的主要方法,辅助治疗主要采用心得安、利血平等对症治疗[15]。生活治疗主要予以适当休息,饮食给予足够的营养和热量,包括糖、蛋白质、脂肪及B族维生素等,并注意避免精神刺激和过度疲劳[16]。目前,针对Graves病的药物治疗中,131I药物的应用较为常见,且131I治疗甲亢被誉为放射性核素治疗应用最成熟、最广泛的典型治疗[13]。Moll等[17]587例接受131I治疗Graves病青少年患者进行为期23年的随访,并未发现严重并发症,提示该治疗方式具有一定安全性。
近年来由于Graves病发病率逐年增高,并呈现出一定的年轻化趋势,临床防治形势不容乐观,其导致的骨质疏松及骨折现象也日益受到重视。因此有学者提出骨代谢指标是Graves病治疗的重要疗效判断指标,加强对Graves病治疗前后各骨代谢指标水平的变化检测,可用于指导Graves病预后[18]。徐明付等[19]认为在采用抗甲状腺药物治疗Graves病时,骨代谢指标会受到不同程度的影响,进而对治疗效果产生影响,要求科学合理地进行治疗,以此改善患者的β-CTX、PINP、N-MID、BGP等骨代谢指标水平。随华等[20]在比较药物治疗、131I治疗和手术治疗对甲状腺功能亢进患者骨密度以及骨代谢指标的影响研究中发现,相较于治疗前,治疗后患者的TSH、FT3、FT4等甲状腺功能指标和骨密度以及β-CTX等骨代谢指标均有明显改善,因而认为药物、131I和手术治疗均能有效改善甲状腺功能亢进患者骨密度,纠正骨代谢紊乱。但较少有文章报道131I治疗后甲状腺功能指标与骨代谢指标之间的变化及其相关性。
本文回顾性收集120例Graves病患者在131I治疗前后甲状腺功能指标与骨代谢指标变化,131I放射性治疗后可以显著降低血清中FT3、FT4、TRAb表达水平,提高TSH表达,改善甲状腺功能;同时促进降低血清中TP1NP、β-CrossLaps、N-MID、Ca2+含量,提高PTH表达,恢复骨代谢水平,这与之前报道文献相符[21-22],进一步证实131I放射疗法对于Graves患者的治疗效果。此外,本研究对甲状腺功能指标与患者基线资料及骨代谢指标进行相关性分析,结果显示,甲状腺功能指标与患者BMI、酗酒及骨代谢指标比较,差异有统计学意义(P<0.05),进一步证实Graves病患者中甲状腺功能与骨质疏松之间的关联性。
综上所述,采用131I的治疗方式可以有效恢复Graves病患者甲状腺功能及骨代谢水平,临床上在检测甲状腺功能的同时应及时检测骨代谢水平变化,降低Graves病患者骨质疏松及骨折发病风险。
[参考文献]
[1] 胡斌,成莉霞,徐建莉,等.老年Graves病患者治疗前后骨密度与骨代谢指标的变化[J].中国老年学杂志,2014, 34(22):6316-6318.
[2] Folkestad L,Brandt F,Lillevang-Johansen M,et al.Graves' disease and toxic nodular goiter,aggravated by duration of hyperthyroidism,are associated with Alzheimer's and vascular dementia. A register-based long-term follow-up of two large cohorts[J].Thyroid,2020. Online ahead of print.
[3] Subekti I,Pramono L.A.current diagnosis and management of Graves' disease[J].Acta Med Indones,2018,50(2):177-182.
[4] Gogakos AI,Duncan BJ,Williams GR.Thyroid and bone[J].Arch Biochem Biophys,2010,503(1):129-136.
[5] Dhanwal DK,Kochupillai N,Gupta N,et al.Hypovitaminosis D and bone mineral metabolism and bone density in hyperthyroidism[J].J Clin Densitom,2010,13(4):462-466.
[6] Sardo L,Palange P,Di Mario F,et al.Intrarenal hemodynamic and oxidative stress in patients with obstructive sleep apnea syndrome[J].Sleep Breath,2015,19(4):1205-1212.
[7] 劉胜峰,金玮,杜玉珍.上海临港地区健康人群骨代谢标志物β-CTx和tP1NP参考区间的建立[J].检验医学与临床,2018,15(20):3121-3124.
[8] 窦家庆,荚静芳.Graves病患者131碘治疗后甲状腺相关抗体的变化及意义[J].安徽医药,2015,19(12):2377-2379.
[9] Munigoti S,Samat A,Jones M K.Graves′ disease and thyroid associated ophthalmopathy following radioiodine therapy in euthyroid multinodular goiter[J].Thyroid Official Journal of the American Thyroid Association,2008, 18(5):585.
[10] 单忠艳.《中国甲状腺疾病诊治指南》导读[J].中国实用内科杂志,2008(4):260-261.
[11] Wang Y,Zhao F,Rijntjes E,et al.Role of selenium intake for risk and development of hyperthyroidism[J].J Clin Endocrinol Metab,2019,104(2):568-580.
[12] Ju Yuan,Lu Xiuqing,Yan Yuan.Comparison of curative effect of 131I and antithyroid drugs in Graves' disease:A meta-analysis[Z].2018:43,511-516.
[13] Yz X,K Z,G J.Predictive factors for the outcomes of Graves' disease patients with radioactive iodine (131I) treatment[J].Bioscience Reports (Biosci Rep),2020,40(1):288-293.
[14] Xie LJ,Zhou HJ,Li JF,et al.Redistribution of body composition in patients with Graves' disease after iodine-131 treatment[J].Eur J Clin Nutr,2015,69(7):856-861.
[15] 覃诗华,刘春红,王府存,等.中西医结合治疗Graves病的研究进展[J].湖南中医杂志,2019,35(9):165-168.
[16] Amashukeli M,Korinteli M,Zerekidze T,et al.The negative correlation between thyrotropin receptor-stimulating antibodies and bone mineral density in postmenopausal patients with Graves′ disease[J].J Investig Med,2013,61(5):842-847.
[17] Moll GJ,Patel BR. Pediatric Graves′ disease:therapeutic options and experience with radioiodine at the University of mississippi medical center[J].South Med J,1997,90(10):1017-1022.
[18] Szumowski P,Abdelrazek S,Sawicka AK,et al.Radioiodine therapy for Graves′ disease-Retrospective analysis of efficacy factors[J]. Endokrynologia Polska,2015,66(2):126-131.
[19] 徐明付,郝繼博,张继惠.抗甲状腺药物治疗对Graves病患者骨代谢的影响效果分析[J].当代医学,2018,24(36):55-57.
[20] 随华,耿秀琴,周艳红,等.药物、碘131和手术治疗对甲状腺功能亢进患者骨密度以及骨代谢指标的影响[J].中国骨质疏松杂志,2015(4):87-89.
[21] 马文杰,吕朝阳,张尧,等.住院Graves病患者骨代谢状况与131I治疗后转归分析[J].复旦学报(医学版),2017,44(2):186-191.
[22] 吴立兵,刘刚,谭凡,等.女性Graves病患者骨密度、骨代谢特点及131I治疗后的转归分析[J].中国骨质疏松杂志,2016,22(2):207-210.
(收稿日期:2021-03-18)

